



还剩32页未读,
继续阅读
所属成套资源:新苏教版化学选择性必修3课件PPT+分层练习+单元测试
成套系列资料,整套一键下载
苏教版2019高二化学选择性必修三 第4章++生活中常用的有机物——烃的含氧衍生物(同步课件)
展开
这是一份苏教版2019高二化学选择性必修三 第4章++生活中常用的有机物——烃的含氧衍生物(同步课件),共40页。
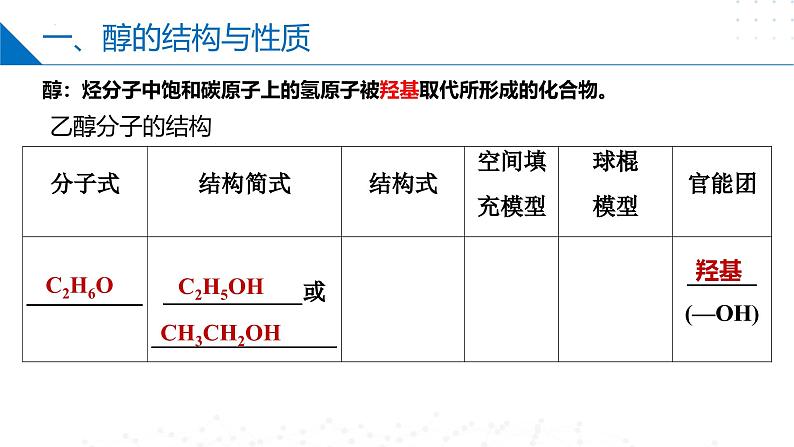
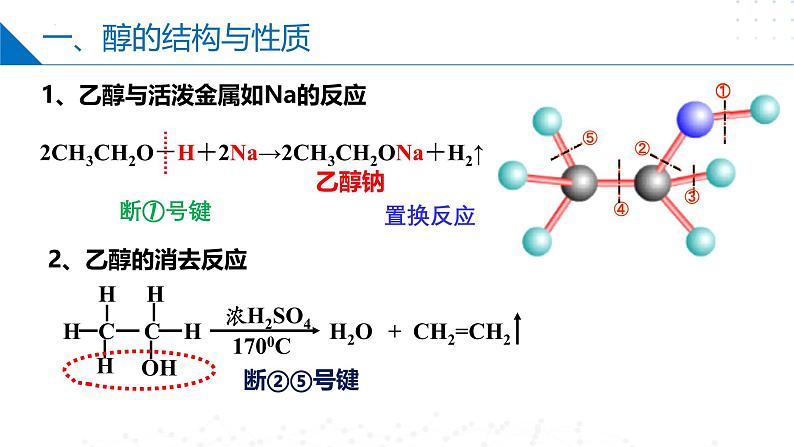
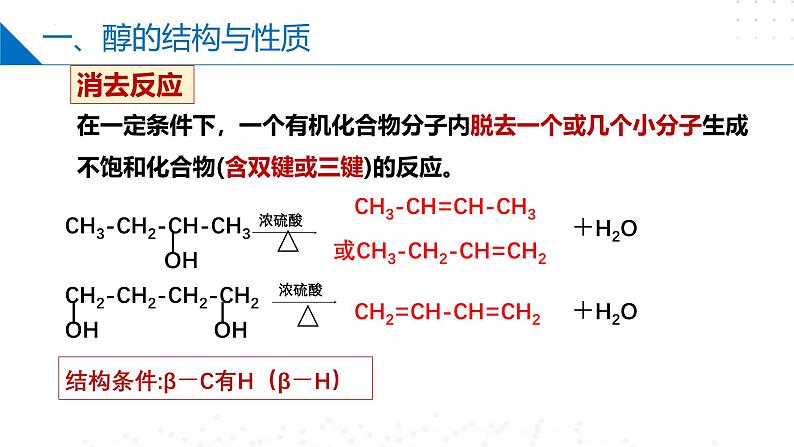
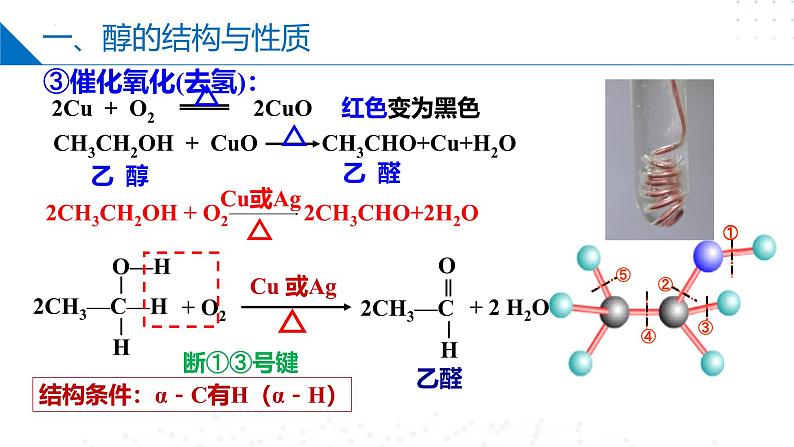
第四章 生活中常用的有机物——烃的含氧衍生物目录CONTENTS第一节 醇第二节 酚第三节 醛和酮第四节 羧酸第一节 Part One醇乙醇分子的结构C2H6OC2H5OHCH3CH2OH羟基醇:烃分子中饱和碳原子上的氢原子被羟基取代所形成的化合物。一、醇的结构与性质一、醇的结构与性质乙醇钠断①号键2CH3CH2O-H+2Na→2CH3CH2ONa+H2↑置换反应1、乙醇与活泼金属如Na的反应2、乙醇的消去反应断②⑤号键一、醇的结构与性质在一定条件下,一个有机化合物分子内脱去一个或几个小分子生成不饱和化合物(含双键或三键)的反应。消去反应CH3-CH=CH-CH3或CH3-CH2-CH=CH2+H2OCH2=CH-CH=CH2+H2O结构条件:β-C有H(β-H)一、醇的结构与性质3、乙醇能够被氧化剂氧化。①燃烧(淡蓝色火焰):②与强氧化剂反应:重铬酸钾由橙色变为绿色检验酒驾酸性高锰酸钾紫色褪去一、醇的结构与性质断①③号键结构条件:α-C有H(α-H)③催化氧化(去氢):一、醇的结构与性质4.取代反应 ①酯化反应: 乙酸乙酯△O=O=浓硫酸作催化剂和吸水剂 断①号键一、醇的结构与性质断②号键醇不仅可以与氢溴酸反应,还可以与其他氢卤酸反应。在反应中,醇分子中的羟基被卤素原子取代生成卤代烃。R—OH+HX―→R—X+H2O②与氢溴酸在加热条件下的取代反应一、醇的结构与性质乙醚4.取代反应 ③ 乙醇的分子间脱水成醚一个断①号键另一个断②号键第二节 Part Two酚一、苯酚的性质和应用俗称石炭酸,是组成最简单的酚。苯酚一、苯酚的性质和应用推测其可以发生氧化反应、取代反应、加成反应、置换反应等,但不能发生消去反应,因为其羟基直接连在了苯环上。1、苯酚的氧化反应 —— 久置变为粉红色苯酚能使酸性高锰酸钾溶液褪色一、苯酚的性质和应用苯酚电离方程式:2、弱酸性一、苯酚的性质和应用3、取代反应2,4,6-三溴苯酚酚醛树脂(电木)n+ nH+H CH2 OH+(n-1)H2OOHOH一、苯酚的性质和应用4、显色反应1滴 FeCl3溶液苯酚稀溶液 紫色溶液用作酚的检验向苯酚中滴加FeCl3溶液显紫色。其他酚类也有类似反应,该反应非常灵敏,常用酚类物质的定性检验。第三节 Part Three醛和酮一、醛的结构1、概念: 醛是由烃基或氢原子与醛基相连构成的化合物。2、官能团名称:醛基 结构简式: -CHO OHC--COH -CH=O简写为R—CHO饱和一元醛通式:CnH2nO (n≥1 )或CnH2n+1CHO一、醛的结构乙醛的结构比例模型球棍模型C2H4OCH3CHO —CHO(醛基)二、醛的化学性质被还原被氧化加氢加氧加H去O 的叫 还原反应加O去H 的叫 氧化反应还原氧化氧化二、醛的化学性质(1)加成反应+ H—H加热、加压+d–d+d–d+二、醛的化学性质(2)氧化反应①燃烧②催化氧化③与强氧化剂反应:乙醛具有较强的还原性5CH3CHO+2KMnO4+3H2SO4→ 5CH3COOH+2MnSO4+K2SO4+3H2O二、醛的化学性质H3C—C—OH氧化反应 H3C—C—HO弱氧化剂还原剂现象:向①中滴加氨水,现象为先产生白色沉淀后变澄清,加入乙醛,水浴加热一段时间后,试管内壁出现一层光亮的银镜。银镜反应与新制Cu(OH)2的反应二、醛的化学性质现象:①中溶液出现蓝色絮状沉淀,滴入乙醛,加热至沸腾后,③中溶液有砖红色沉淀产生。砖红色RCHO~2Cu(OH)2~Cu2O HCHO发生银镜反应的化学方程式H一C一HOH—O—C—O—HO即:H2CO3二、醛的化学性质相当于含两个醛基二、醛的化学性质缩聚反应由有机化合物分子间脱去小分子获得高分子化合物的反应。线型酚醛树脂三、酮的结构与性质酮的化学性质醛氧化羧酸伯醇酮不能被氧化(无C—H键)仲醇三、酮的结构与性质丙酮与HCN发生加成反应:碳链的加长:第四节 Part Four羧酸一、羧酸的结构与分类1.定义:由烃基(或H)与羧基相连的化合物饱和一元羧酸:CnH2nO2CnH2n+1-COOH或×结构式官能团-COOHHOOC-或羧基结构简式羧酸通式:R-COOH或R-(COOH)n二、羧酸的性质羧酸的化学性质1. 乙酸乙酸又叫醋酸,无色冰状晶体(又称冰醋酸),熔点16.6℃,沸点117.9℃,有刺激性气味,易溶于水。C2H4O2CH3COOH —COOH(羧基) H O ▏ ‖H-C-C-O-H ▏ H二、羧酸的性质①使石蕊变红,能电离出H+乙酸的化学性质(1)弱酸性(酸性:HCl>CH3COOH>H2CO3>C6H5OH>HCO3-)二、羧酸的性质酯化反应实验实验现象:饱和碳酸钠溶液的液面上有无色透明的油状液体生成,且能闻到香味。乙酸乙酯酸脱羟基醇脱氢二、羧酸的性质甲酸结构甲酸分子能表现出醛和羧酸两类物质的性质。甲酸与新制的Cu(OH)2混合,若加热二者发生氧化反应,若不加热二者发生酸碱中和反应。缩聚反应二、羧酸的性质聚酯类:—OH与—COOH间的缩聚nHO—CH2CH2—OH→(2n-1)H2O聚对苯二甲酸乙二酯(PET)三、酯酯是羧酸分子羧基中的—OH被—OR′取代后的产物1. 概念:2. 通式:(饱和一元羧酸和饱和一元醇生成的酯)(R可以是烃基或H原子, 而R′只能是烃基,可与R相同也可不同)(或RCOOR′)(1) CnH2nO2(n≥2)(2)与碳原子数相同饱和一元羧酸互为同分异构体三、酯注意:酯在无机酸、碱催化下,均能发生水解反应,其中在酸性条件下水解是可逆的,在碱性条件下水解是不可逆的。3. 化学性质:水解反应(或取代反应)+H2O CH3COOH+ C2H5OH稀H2SO4△CH3C—OC2H5 ‖O本章小结醇醛和酮不良反应酚醛的结构醛的化学性质酮的结构与性质苯酚的性质和应用醇的结构与性质羧酸羧酸的结构与分类羧酸的性质酯谢谢观看THANKS
第四章 生活中常用的有机物——烃的含氧衍生物目录CONTENTS第一节 醇第二节 酚第三节 醛和酮第四节 羧酸第一节 Part One醇乙醇分子的结构C2H6OC2H5OHCH3CH2OH羟基醇:烃分子中饱和碳原子上的氢原子被羟基取代所形成的化合物。一、醇的结构与性质一、醇的结构与性质乙醇钠断①号键2CH3CH2O-H+2Na→2CH3CH2ONa+H2↑置换反应1、乙醇与活泼金属如Na的反应2、乙醇的消去反应断②⑤号键一、醇的结构与性质在一定条件下,一个有机化合物分子内脱去一个或几个小分子生成不饱和化合物(含双键或三键)的反应。消去反应CH3-CH=CH-CH3或CH3-CH2-CH=CH2+H2OCH2=CH-CH=CH2+H2O结构条件:β-C有H(β-H)一、醇的结构与性质3、乙醇能够被氧化剂氧化。①燃烧(淡蓝色火焰):②与强氧化剂反应:重铬酸钾由橙色变为绿色检验酒驾酸性高锰酸钾紫色褪去一、醇的结构与性质断①③号键结构条件:α-C有H(α-H)③催化氧化(去氢):一、醇的结构与性质4.取代反应 ①酯化反应: 乙酸乙酯△O=O=浓硫酸作催化剂和吸水剂 断①号键一、醇的结构与性质断②号键醇不仅可以与氢溴酸反应,还可以与其他氢卤酸反应。在反应中,醇分子中的羟基被卤素原子取代生成卤代烃。R—OH+HX―→R—X+H2O②与氢溴酸在加热条件下的取代反应一、醇的结构与性质乙醚4.取代反应 ③ 乙醇的分子间脱水成醚一个断①号键另一个断②号键第二节 Part Two酚一、苯酚的性质和应用俗称石炭酸,是组成最简单的酚。苯酚一、苯酚的性质和应用推测其可以发生氧化反应、取代反应、加成反应、置换反应等,但不能发生消去反应,因为其羟基直接连在了苯环上。1、苯酚的氧化反应 —— 久置变为粉红色苯酚能使酸性高锰酸钾溶液褪色一、苯酚的性质和应用苯酚电离方程式:2、弱酸性一、苯酚的性质和应用3、取代反应2,4,6-三溴苯酚酚醛树脂(电木)n+ nH+H CH2 OH+(n-1)H2OOHOH一、苯酚的性质和应用4、显色反应1滴 FeCl3溶液苯酚稀溶液 紫色溶液用作酚的检验向苯酚中滴加FeCl3溶液显紫色。其他酚类也有类似反应,该反应非常灵敏,常用酚类物质的定性检验。第三节 Part Three醛和酮一、醛的结构1、概念: 醛是由烃基或氢原子与醛基相连构成的化合物。2、官能团名称:醛基 结构简式: -CHO OHC--COH -CH=O简写为R—CHO饱和一元醛通式:CnH2nO (n≥1 )或CnH2n+1CHO一、醛的结构乙醛的结构比例模型球棍模型C2H4OCH3CHO —CHO(醛基)二、醛的化学性质被还原被氧化加氢加氧加H去O 的叫 还原反应加O去H 的叫 氧化反应还原氧化氧化二、醛的化学性质(1)加成反应+ H—H加热、加压+d–d+d–d+二、醛的化学性质(2)氧化反应①燃烧②催化氧化③与强氧化剂反应:乙醛具有较强的还原性5CH3CHO+2KMnO4+3H2SO4→ 5CH3COOH+2MnSO4+K2SO4+3H2O二、醛的化学性质H3C—C—OH氧化反应 H3C—C—HO弱氧化剂还原剂现象:向①中滴加氨水,现象为先产生白色沉淀后变澄清,加入乙醛,水浴加热一段时间后,试管内壁出现一层光亮的银镜。银镜反应与新制Cu(OH)2的反应二、醛的化学性质现象:①中溶液出现蓝色絮状沉淀,滴入乙醛,加热至沸腾后,③中溶液有砖红色沉淀产生。砖红色RCHO~2Cu(OH)2~Cu2O HCHO发生银镜反应的化学方程式H一C一HOH—O—C—O—HO即:H2CO3二、醛的化学性质相当于含两个醛基二、醛的化学性质缩聚反应由有机化合物分子间脱去小分子获得高分子化合物的反应。线型酚醛树脂三、酮的结构与性质酮的化学性质醛氧化羧酸伯醇酮不能被氧化(无C—H键)仲醇三、酮的结构与性质丙酮与HCN发生加成反应:碳链的加长:第四节 Part Four羧酸一、羧酸的结构与分类1.定义:由烃基(或H)与羧基相连的化合物饱和一元羧酸:CnH2nO2CnH2n+1-COOH或×结构式官能团-COOHHOOC-或羧基结构简式羧酸通式:R-COOH或R-(COOH)n二、羧酸的性质羧酸的化学性质1. 乙酸乙酸又叫醋酸,无色冰状晶体(又称冰醋酸),熔点16.6℃,沸点117.9℃,有刺激性气味,易溶于水。C2H4O2CH3COOH —COOH(羧基) H O ▏ ‖H-C-C-O-H ▏ H二、羧酸的性质①使石蕊变红,能电离出H+乙酸的化学性质(1)弱酸性(酸性:HCl>CH3COOH>H2CO3>C6H5OH>HCO3-)二、羧酸的性质酯化反应实验实验现象:饱和碳酸钠溶液的液面上有无色透明的油状液体生成,且能闻到香味。乙酸乙酯酸脱羟基醇脱氢二、羧酸的性质甲酸结构甲酸分子能表现出醛和羧酸两类物质的性质。甲酸与新制的Cu(OH)2混合,若加热二者发生氧化反应,若不加热二者发生酸碱中和反应。缩聚反应二、羧酸的性质聚酯类:—OH与—COOH间的缩聚nHO—CH2CH2—OH→(2n-1)H2O聚对苯二甲酸乙二酯(PET)三、酯酯是羧酸分子羧基中的—OH被—OR′取代后的产物1. 概念:2. 通式:(饱和一元羧酸和饱和一元醇生成的酯)(R可以是烃基或H原子, 而R′只能是烃基,可与R相同也可不同)(或RCOOR′)(1) CnH2nO2(n≥2)(2)与碳原子数相同饱和一元羧酸互为同分异构体三、酯注意:酯在无机酸、碱催化下,均能发生水解反应,其中在酸性条件下水解是可逆的,在碱性条件下水解是不可逆的。3. 化学性质:水解反应(或取代反应)+H2O CH3COOH+ C2H5OH稀H2SO4△CH3C—OC2H5 ‖O本章小结醇醛和酮不良反应酚醛的结构醛的化学性质酮的结构与性质苯酚的性质和应用醇的结构与性质羧酸羧酸的结构与分类羧酸的性质酯谢谢观看THANKS
相关资料
更多









