




化学必修 第一册第二单元 物质的化学计量精品课件ppt
展开1.了解物质的量及其单位、阿伏加德罗常数、摩尔质量的含义与应用。2.能从宏观和微观相结合的视角认识物质的量、微观粒子数和物质的质量之间的关系,并建立三者之间简单计算的思维模型。
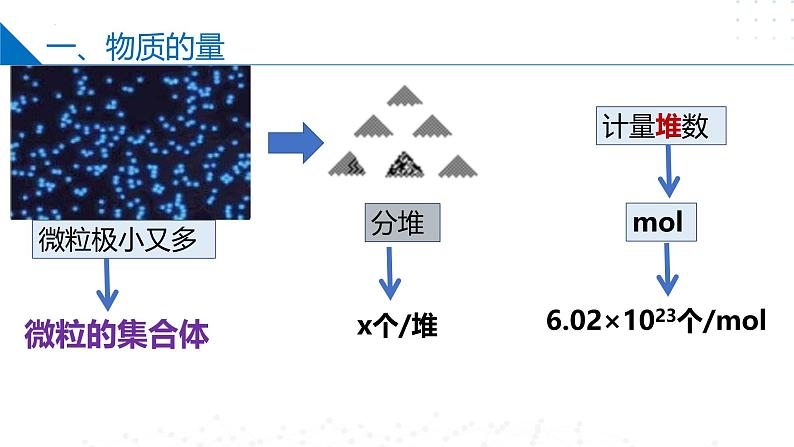
6.02×1023个/ml
1.定义:是用来描述一定数目微观粒子的集合体的物理量。
3.单位:摩尔 ,符号:ml
Amunt f substance
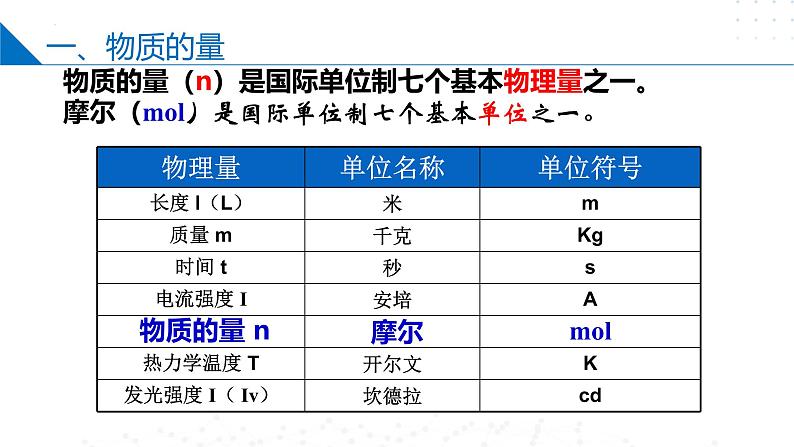
物质的量(n)是国际单位制七个基本物理量之一。摩尔(ml)是国际单位制七个基本单位之一。
“物质的量(Amunt f substance)”是一个物理量的全称,是一个专有名词;物质的量不能当成物质的数量或质量来理解。
物质的量只能用来描述微观粒子 ,像分子、离子、原子、质子、电子、中子之类,不能用来描述宏观物体。
用摩尔为单位表示某物质的物质的量时,必须指明物质微粒的名称、符号或化学式。如:1 ml H、1 ml H+、1 ml H2 ,不能用 “1 ml 氢”这样含糊无意义的表示。
物质的量是一个巨大数量粒子的集合体,可以是整数,也可以是小数,如可以有0.5mlO2、0.01mlH2SO4等。
指出下列符号的含义5 ml Cu 3 ml CO32- 4 ml H2O
符号为NA 单位:ml-1
NA≈6.02×1023 ml-1
科学上把0.012kg12C所含原子数称为阿伏加德罗常数,作为衡量微粒的集合体(即1ml)。
阿伏加德罗常数是一个基准,即每ml物质所含微粒的数目约为6.02×1023 个,如筷子是每双为2根,鞋子每双为2只等。
1ml C 约有多少个碳原子?1ml H2O约有多少个水分子?
1ml不同物质所含微粒的个数相同。
约为6.02×1023 个
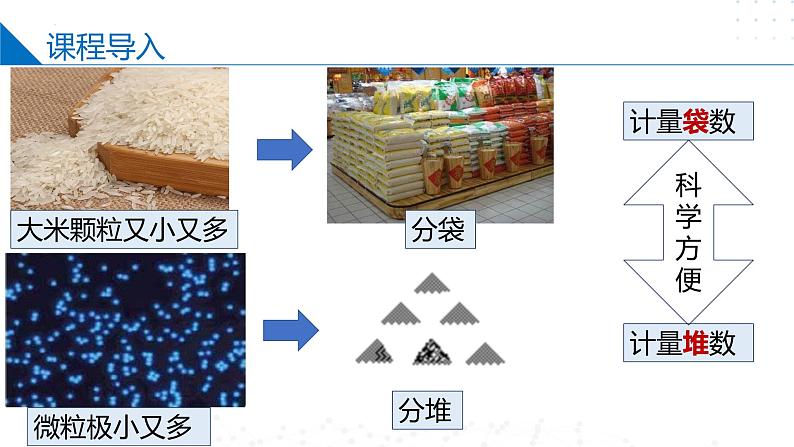
掌握一个“分堆”的思想,即“化大为小”
1mlH2O含有 个水分子,或约 个水分子
mlH2O含有 个水分子,或约 个水分子
1.204× 1024
物质的量(n)、阿伏加德罗常数(NA)、微粒数(N)之间的关系:
1、0.1mlCH4中有 ml H;
1个CH4中有4个H→1ml CH4中有4ml H→0.1ml CH4中有0.4ml H
2、含有0.12ml O的SO3的物质的量为 ml;
1个SO3中有3个O→1ml SO3中有3ml O→0.04mlSO3中有0.12ml O
3、0.2ml CuSO4·5H2O中含有 ml O
1个CuSO4·5H2O中含有9个O→1ml CuSO4·5H2O中含有9ml O→0.2ml CuSO4·5H2O中含有1.8 ml的O
2 : 1 : 2
2ml : 1ml : 2ml
(2 NA) : (NA) : ( 2NA)
2CO + O2 ==== 2CO2
化学反应方程式中,各物质的化学计量数之比等于其微粒数之比,等于其物质的量之比。
1ml任何原子的质量在数值上等于这种原子的相对原子质量。
1ml任何分子的质量在数值上等于这种分子的相对分子质量。
1ml任何离子的质量在数值上等于这种离子的相对原子质量或相对分子质量。
1.定义:单位物质的量的物质所具有的质量。即每ml物质具有的质量。
3.单位:g/ml,g·ml-1
当摩尔质量以“g·ml-1”为单位时,与相对原子(分子)质量在数值上相等。
摩尔质量与相对分子质量(或相对原子质量)是否等同?
不等同。摩尔质量与相对分子质量(或相对原子质量)是两个不同的概念。当摩尔质量以“g·ml-1”为单位时,两者在数值上相等,但前者单位是g·ml-1,后者单位是1,故两者不等同。
①等值性:摩尔质量以g·ml-1作单位时,在数值上与其相对分子质量或相对原子质量相等。②确定性:对于指定的物质来说,其摩尔质量的值是一个定值,不随物质的物质的量的多少而改变。
物质的量(单位:ml)
①已知任意状态物质的相对原子质量或分子质量时: M=Ar或Mr 。
例:已知氨气的相对分子质量为17,则氨气的摩尔质量为 。
②已知任意状态物质的质量时: (定义式)。
例:(1) 24.5gH2SO4的物质的量是多少? (2) 1.50mlNa2CO3的质量是多少?
例:已知一个铁原子的质量为b g,则铁的摩尔质量为 。
③已知一个分子的质量时:M=m(分子)×NA。
bNA g·ml-1
摩尔质量(M)与微粒总数(N)有什么计算关系?
1.28 g某气体含有的分子数目为1.204×1022,则该气体的摩尔质量为 。
用NA代表阿伏加德罗常数的值,已知a g某气体中含分子数为b,则该气体的摩尔质量为 。
483 g Na2SO4·10H2O中所含Na+和SO42-的物质的量各是多少?所含水分子的数目是多少?
则:n(Na+) = 1.50 ml×2 = 3.00 ml n(SO42-) = 1.50 ml×1 = 1.50 ml
解:Na2SO4·10H2O的相对分子质量为322,摩尔质量为322 g·ml-1。
n(H2O) = 1.50 ml×10 = 15.0 ml N(H2O) = n(H2O)×NA = 15.0 ml×6.02×1023 ml-1 = 9.03×1024
答:483 g Na2SO4·10H2O中所含Na+的物质的量为3.00 ml,SO42-的物质的量为1.50 ml,水分子的数目约为9.03×1024。
物质的量判断阿伏伽德罗常数相关计算
2.已知1.505×1023个X气体分子的质量为8 g,则X气体的摩尔质量是( )A.16 g B.32 gC.64 g·ml-1 D.32 g·ml-1
高中化学苏教版 (2019)必修 第一册第二单元 溶液组成的定量研究优质课件ppt: 这是一份高中化学苏教版 (2019)必修 第一册<a href="/hx/tb_c4002494_t3/?tag_id=26" target="_blank">第二单元 溶液组成的定量研究优质课件ppt</a>,文件包含222物质的量浓度相关计算同步课件pptx、02-一定浓度溶液的配置mp4等2份课件配套教学资源,其中PPT共26页, 欢迎下载使用。
高中化学苏教版 (2019)必修 第一册专题2 研究物质的基本方法第二单元 溶液组成的定量研究完美版ppt课件: 这是一份高中化学苏教版 (2019)必修 第一册<a href="/hx/tb_c4002494_t3/?tag_id=26" target="_blank">专题2 研究物质的基本方法第二单元 溶液组成的定量研究完美版ppt课件</a>,文件包含221物质的量浓度同步课件pptx、02-一定浓度溶液的配置mp4等2份课件配套教学资源,其中PPT共37页, 欢迎下载使用。
高中化学苏教版 (2019)必修 第一册第二单元 溶液组成的定量研究集体备课ppt课件: 这是一份高中化学苏教版 (2019)必修 第一册<a href="/hx/tb_c4002494_t3/?tag_id=26" target="_blank">第二单元 溶液组成的定量研究集体备课ppt课件</a>,共26页。PPT课件主要包含了学习目标,典例解析,mol,各物质的物质的量,各物质的粒子数,物质的量综合计算,解题步骤,相对密度,平均摩尔质量,不是质量之比等内容,欢迎下载使用。













