

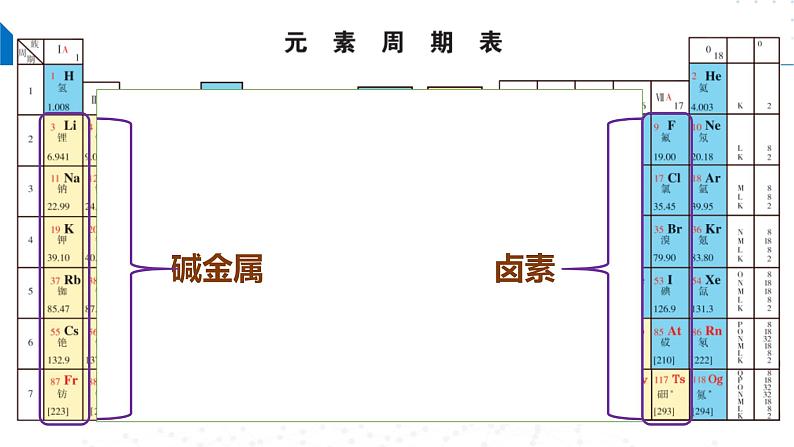


苏教版 (2019)必修 第一册第一单元 元素周期律和元素周期表优秀ppt课件
展开1.了解碱金属元素、卤素的原子结构和性质,能从原子结构角度解释同主族元素性质的递变规律,形成“结构决定性质”的观念,强化宏观辨识与微观探析的化学学科核心素养。2.能设计实验方案,探究同主族元素性质的递变性,提升科学探究与创新意识的化学学科核心素养。
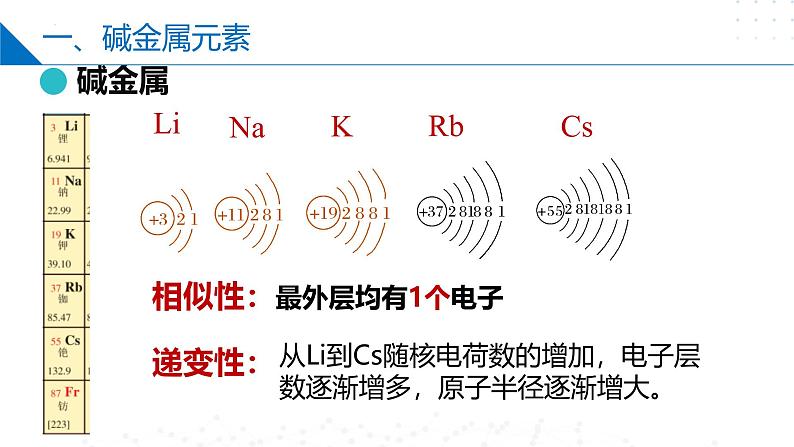
相似性:最外层均有1个电子
从Li到Cs随核电荷数的增加,电子层数逐渐增多,原子半径逐渐增大。
2R+2H2O===2ROH+H2↑
2R+2H+===2R++H2↑
②碱金属的最高价氧化物(R2O)对应的水化物(ROH),一般都具有强碱性。
锂、钠、钾与氧气反应的比较
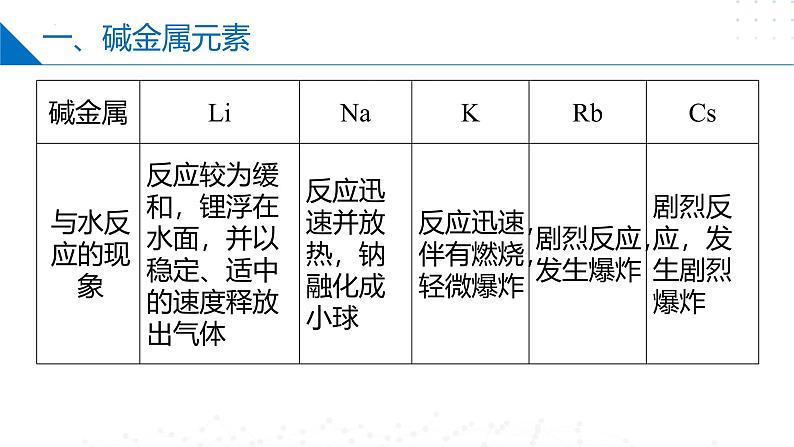
实验现象:都能在空气中燃烧,钠产生黄色火焰,钾产生紫色火焰,锂、钠、钾燃烧越来越剧烈。
例1.下列说法正确的是( )A.碱性:LiOH>NaOH>KOH>RbOHB.金属性:Rb>K>Na>LiC.Fe、Na分别和稀盐酸反应时,每个铁原子失去2个电子,每个钠原子失去1个电子,所以Fe的金属活动性强于NaD.Rb不易与水反应放出H2
从F2到I2,颜色逐渐加深,熔、沸点逐渐升高,密度逐渐增大。
相似性:最外层均有7个电子
从F到I随核电荷数的增加,电子层数逐渐增多,原子半径逐渐增大。
从F2到I2,生成氢化物的稳定性:逐渐减弱。
从F2到I2,与H2反应的难易程度:逐渐困难;
振荡静置后,液体分层,上层接近无色,下层呈橙红色
振荡静置后,液体分层,上层接近无色,下层呈紫红色
Cl2+2Br- = Br2+2Cl-
Cl2+2I- = 2Cl-+I2
荡静置后,液体分层,上层接近无色,下层呈紫红色
Br2+2I- = 2Br-+I2
2Br-+Cl2===2Cl-+Br2
2I-+Cl2===2Cl-+I2
2I-+Br2===2Br-+I2
结论:Cl2、Br2、I2单质的氧化性由强到弱的顺序是 ,相应阴离子的还原性由强到弱的顺序是 。
在常温下溴单质是唯一一种液态非金属单质,易挥发,用水封保存。
氟元素无正价,无含氧酸,而氯、溴、碘元素有最高正价和含氧酸。
X2+H2O ⇌HX+HXO(X为Cl、Br、I),而2F2+2H2O=4HF+O2。
碘为紫黑色固体,易升华,淀粉遇I2变蓝色。
例2 下列说法正确的是( )A.氟、氯、溴原子的最外层电子数都是7,次外层电子数都是8B.从HF、HCl、HBr、HI酸性递增的事实,推出F、Cl、Br、I的非金属性递增规律C.酸性:HFO4>HClO4>HBrO4>HIO4D.砹是原子序数最大的卤族元素,根据卤素性质的相似性,砹微溶于水,易溶于CCl4
物理性质化学性质及递变性
1、可能存在的第119号元素被称为“类钫”,根据元素周期表结构及元素性质变化趋势,下列有关“类钫”的预测说法正确的是( )A.“类钫”在化合物中呈+1价B.“类钫”属于过渡元素,具有放射性C.“类钫”单质的密度小于1 g·cm-3D.“类钫”单质有较高的熔点
2.下列关于Na、Mg、Cl、Br元素及其化合物的说法正确的是( )A.NaOH的碱性比Mg(OH)2的强B.Cl2得到电子的能力比Br2的弱C.原子半径r:r(Br)>r(Cl)>r(Mg)>r(Na)D.原子的最外层电子数n:n(Na)<n(Mg)<n(Cl)<n(Br)
化学必修 第一册第一单元 元素周期律和元素周期表教学ppt课件: 这是一份化学必修 第一册<a href="/hx/tb_c4002508_t3/?tag_id=26" target="_blank">第一单元 元素周期律和元素周期表教学ppt课件</a>,共26页。PPT课件主要包含了学习目标,碱金属,碱金属单质的物理性质,碱金属元素,递变性,碱金属化学性质,Li2O,K+O2,Li+O2,Na+O2等内容,欢迎下载使用。
人教版 (2019)必修 第一册实验活动3 同周期、同主族元素性质的递变说课ppt课件: 这是一份人教版 (2019)必修 第一册<a href="/hx/tb_c162002_t3/?tag_id=26" target="_blank">实验活动3 同周期、同主族元素性质的递变说课ppt课件</a>,共8页。
化学第3节 元素周期表的应用多媒体教学课件ppt: 这是一份化学第3节 元素周期表的应用多媒体教学课件ppt,文件包含132研究同主族元素的性质课件2022-2023学年高一化学鲁科版2019必修第二册ppt、同主族元素性质的递变wmv等2份课件配套教学资源,其中PPT共23页, 欢迎下载使用。













