


四川省成都市新津中学2021-2022学年高一下学期期末考试化学试题(Word版附解析)
展开可能用到的相对原子质量:H-1 C-12 O-16
一、单选题(每题2分,共40分)
1. “端午节”是中国传统节日,下列端午节的活动中发生了化学变化的是
A. 煮棕子B. 划龙舟C. 包棕子D. 割粽叶
【答案】A
【解析】
【详解】A.煮粽子过程中有新物质生成,属于化学变化,故A正确;
B.划龙舟过程中没有新物质生成,属于物理变化,故B错误;
C.包粽子过程中没有新物质生成,属于物理变化,故C错误;
D.割粽叶过程中没有新物质生成,属于物理变化,故D错误;
故选:A。
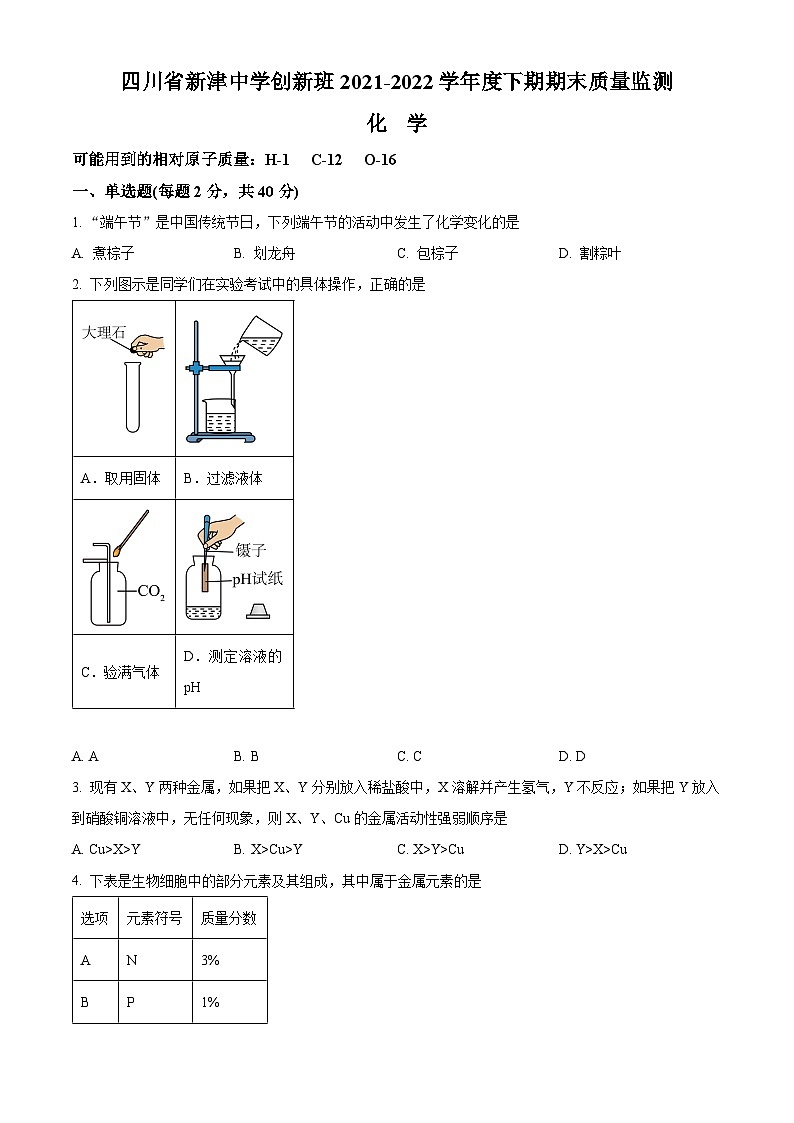
2. 下列图示是同学们在实验考试中的具体操作,正确的是
A AB. BC. CD. D
【答案】C
【解析】
【详解】A.向试管中装块状固体时,应先将试管横放,用镊子把块状固体放在试管口,再将试管慢慢竖立起来,使块状固体缓慢滑落至试管底部,A错误;
B.过滤液体时,要注意“一贴、二低、三靠”的原则,图中缺少用于引流的玻璃棒,B错误;
C.检验二氧化碳气体是否收集满时,应将燃着的木条放在集气瓶口,观察燃着的木条是否熄灭,C正确;
D.用pH试纸测定溶液的pH时,正确的操作方法为:取一小片pH试纸放在玻璃片或白瓷板上,用玻璃棒蘸取少量待测液滴在干燥的pH试纸上,将试纸显示的颜色与标准比色卡比较,读出溶液的pH,不能直接将pH试纸伸入至待测液中,以免污染待测液,D错误;
故选C。
3. 现有X、Y两种金属,如果把X、Y分别放入稀盐酸中,X溶解并产生氢气,Y不反应;如果把Y放入到硝酸铜溶液中,无任何现象,则X、Y、Cu的金属活动性强弱顺序是
A. Cu>X>YB. X>Cu>YC. X>Y>CuD. Y>X>Cu
【答案】B
【解析】
【详解】现有X、Y两种金属,如果把X、Y分别放入稀盐酸中,X溶解并产生氢气,Y不反应,说明X的位置排在氢的前面,Y的位置排在氢的后面,即X>H>Y;如果把Y放入到硝酸铜溶液中,无任何现象,说明Y的金属活动性比铜弱,即铜>Y。氢的位置排在铜的前面,则X、Y、Cu的金属活动性强弱顺序是X>Cu>Y,故选:B。
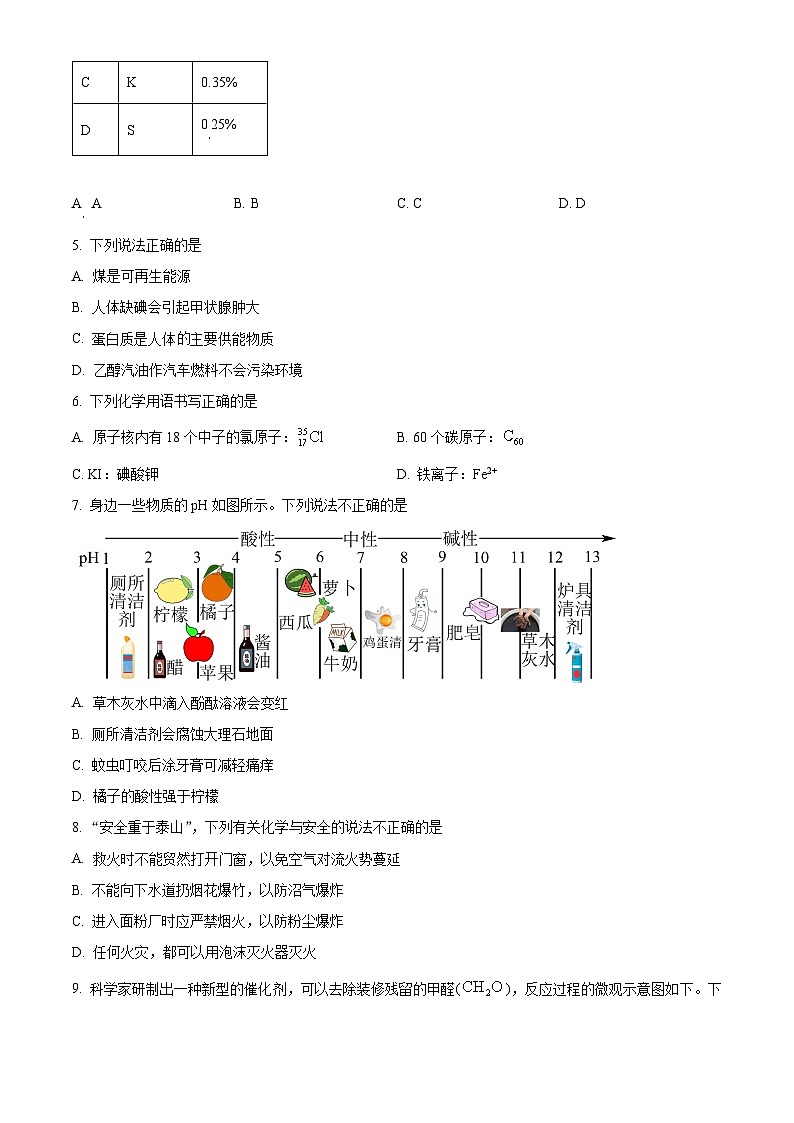
4. 下表是生物细胞中的部分元素及其组成,其中属于金属元素的是
A. AB. BC. CD. D
【答案】C
【解析】
【详解】A.N是氮元素的元素符号,氮元素属于非金属元素,A不符合题意;
B.P是磷元素的元素符号,磷元素属于非金属元素,B不符合题意;
C.K是钾元素的元素符号,钾元素带钅字旁,属于金属元素,C符合题意;
D.S是硫元素的元素符号,硫元素属于非金属元素,D不符合题意;
故选:C。
5. 下列说法正确的是
A. 煤是可再生能源
B. 人体缺碘会引起甲状腺肿大
C. 蛋白质是人体的主要供能物质
D. 乙醇汽油作汽车燃料不会污染环境
【答案】B
【解析】
【详解】A.煤属于化石燃料,是不可再生能源,A错误;
B.碘是人体所需的微量元素,人体缺碘会引起甲状腺肿大,B正确;
C.蛋白质不是人体主要的供能物质,糖类是人体主要的供能物质,C错误;
D.乙醇汽油作汽车燃料能够减少环境污染,但也会污染环境,这是因为汽油燃烧能够产生二氧化硫等物质,D错误;
故选B。
6. 下列化学用语书写正确的是
A. 原子核内有18个中子的氯原子:B. 60个碳原子:
C. KI:碘酸钾D. 铁离子:Fe2+
【答案】A
【解析】
【详解】A.原子核内有18个中子的氯原子,其质量数为18+17=35,所以其原子符号为:,故A正确;
B.为一种分子,60C表示60个碳原子,故B错误;
C.KI名称为碘化钾,碘酸钾的化学式为KIO3,故C错误;
D.铁离子:Fe3+,Fe2+表示亚铁离子,故D错误;
故选:A。
7. 身边一些物质的pH如图所示。下列说法不正确的是
A. 草木灰水中滴入酚酞溶液会变红
B. 厕所清洁剂会腐蚀大理石地面
C 蚊虫叮咬后涂牙膏可减轻痛痒
D. 橘子的酸性强于柠檬
【答案】D
【解析】
【详解】A.根据图示,草木灰pH大于7为碱性物质,酚酞溶液与到碱性物质变红,A正确;
B.厕所清洁剂为酸性物质,可与大理石中碳酸钙发生复分解反应,B正确;
C.蚊虫叮咬后分泌酸性物质,可用弱碱性的牙膏中和减轻痛痒,C正确;
D.柠檬pH小于橘子,说明柠檬酸性强于橘子,D错误;
答案选D。
8. “安全重于泰山”,下列有关化学与安全的说法不正确的是
A. 救火时不能贸然打开门窗,以免空气对流火势蔓延
B. 不能向下水道扔烟花爆竹,以防沼气爆炸
C. 进入面粉厂时应严禁烟火,以防粉尘爆炸
D. 任何火灾,都可以用泡沫灭火器灭火
【答案】D
【解析】
【详解】A.未知火情,救火时不能贸然打开门窗,使可燃物与氧气接触,以免空气对流火势蔓延,故A正确;
B.沼气的主要成分是甲烷,甲烷具有可燃性,不能向下水道扔烟花爆竹,以防沼气爆炸,故B正确;
C.面粉厂内弥漫着可燃性面粉小颗粒,进入面粉厂时应严禁烟火,以防粉尘爆炸,故C正确;
D.并不是任何火灾都可以用泡沫灭火器灭火,如活泼的金属失火、图书档案失火等,故D错误;
故选:D。
9. 科学家研制出一种新型的催化剂,可以去除装修残留的甲醛(),反应过程的微观示意图如下。下列说法错误的是
A. 分子在化学变化中可再分
B. 反应前后分子数且和原子数目均发生改变
C. 反应物和生成物共有3种化合物
D. 反应的化学方程式为
【答案】B
【解析】
【详解】A.分子是由原子构成的,化学变化中分子分为原子,原子可再重新形成新的分子,A正确;
B.根据质量守恒定律,化学反应前后原子个数不变,B错误;
C.反应物乙为氧气,属于单质,反应中其余三种物质化合物,C正确;
D.根据图示可知,该反应化学方程式:,D正确;
答案选B。
10. 水是地球上最普通、最常见的化学物质之一,下列关于水的说法正确的是
A. 海水、河水等天然水是混合物B. 过滤可以使海水转化为淡水
C. 用水灭火的原理是降低可燃物着火点D. 含有可溶性钙、镁化合物的水是硬水
【答案】A
【解析】
【详解】A.海水、河水等天然水中均含多种成分,属于混合物,A正确;
B.过滤只能除去不可溶性杂质,但不能将海水转化为淡水,B错误;
C.用水灭火的原理是使温度降低至可燃物着火点以下,C错误;
D.含有较多的可溶性钙、镁化合物的水是硬水,D错误;
答案选A。
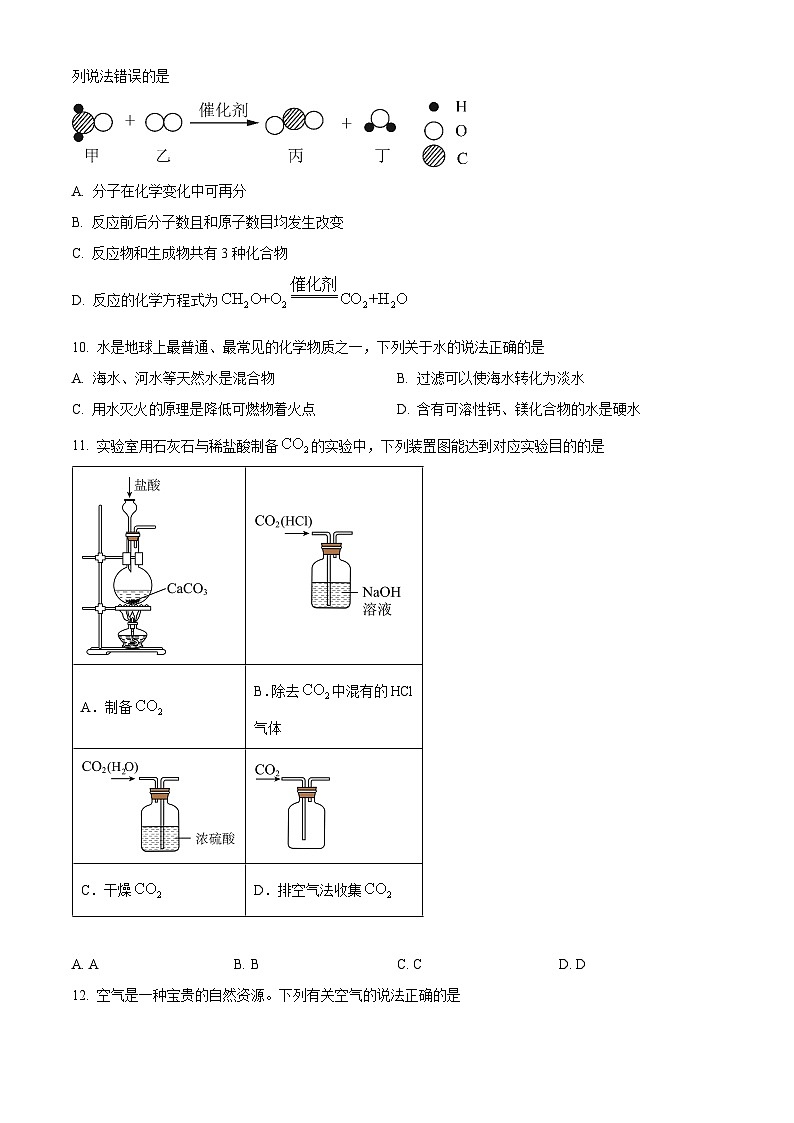
11. 实验室用石灰石与稀盐酸制备的实验中,下列装置图能达到对应实验目的的是
A. AB. BC. CD. D
【答案】D
【解析】
【详解】A.实验室常用石灰石和稀盐酸反应制取二氧化碳,属于固、液常温型,不用加热,不能使用长颈漏斗,需要用分液漏斗,故A错误;
B.二氧化碳可以和氢氧化钠发生反应,不能用氢氧化钠溶液除去二氧化碳中的氯化氢气体,故B错误;
C.浓硫酸具有吸水性,且不和二氧化碳反应,可以用来干燥二氧化碳,但导气管必须长进短出,故C错误;
D.二氧化碳的密度比空气大,用D中装置收集时,要长进短出,故D正确;
故选D。
12. 空气是一种宝贵的自然资源。下列有关空气的说法正确的是
A. 氮气约占空气体积的21%
B. 空气污染指数越高,空气质量越好
C. 铁在潮湿的空气中易生锈而铝不易生锈,说明铁的金属活动性比铝强
D. 食品在空气中因与氧气发生缓慢氧化而变质
【答案】D
【解析】
【详解】A.氮气约占空气体积的 78%,氧气约占空气体积的 21%,A错误;
B.空气污染指数越高,说明空气污染越严重,空气质量越差,B错误;
C.铝比铁活泼,但铝制品不易生锈的原因是常温下,铝易与空气中的氧气反应生成致密的氧化铝保护膜,从而阻止内部的铝进一步被氧化,C错误;
D.氧气具有氧化性,食品在空气中因与氧气发生缓慢氧化而变质,D正确;
故选D。
13. 观察实验现象是科学探究的必要步骤,下列对实验现象描述错误的是
A. 木炭在氧气中燃烧后生成黑色固体
B. 少量二氧化碳通入澄清石灰水中,溶液变浑浊
C. 氯化铁溶液中加入氢氧化钠溶液,出现红褐色沉淀
D. 稀盐酸中加入少量铁锈,溶液变为黄色
【答案】A
【解析】
【详解】A.木炭在氧气中燃烧,发出白光,生成无色的气体,故A错误;
B.少量二氧化碳通入澄清石灰水中,生成碳酸钙沉淀和水,溶液变浑浊,故B正确;
C.氯化铁溶液与氢氧化钠溶液生成氢氧化铁沉淀和氯化钠,会观察到出现红褐色沉淀,故C正确;
D.稀盐酸中加入少量铁锈,铁锈的主要成分氧化铁与稀盐酸反应生成氯化铁和水,溶液变为黄色,故D正确;
故选A。
14. 证据推理是学习化学的一种常用方法。下列推理正确的是
A. 将CO2通入紫色石蕊试液,试液变红,说明CO2是一种酸
B. 有机物中都含有碳元素,则含有碳元素的化合物都是有机物
C. 二氧化锰能催化加速氯酸钾的分解,因此为加快化学反应速率可以选择适宜的催化剂
D. 稀有气体元素的原子最外层电子数为8(氦除外),因此微粒一定是稀有气体元素的原子
【答案】C
【解析】
【详解】A.将CO2通入紫色石蕊试液,试液变红,是因为二氧化碳和水生成酸性物质碳酸,不能说明CO2是一种酸,故A错误;
B.有机物为除一氧化碳、二氧化碳、碳酸、碳酸盐以外的含碳化合物,故B错误;
C.催化剂改变反应速率;二氧化锰能催化加速氯酸钾的分解,因此为加快化学反应速率可以选择适宜的催化剂,故C正确;
D.稀有气体元素的原子最外层电子数为8(氦除外),但微粒不一定是稀有气体元素的原子,也可能是离子,故D错误;
故选C。
15. 某化学实验小组书写化学式、俗名以及归类完全正确的是
A. NaOH、苛性钠、碱B. C2H5OH、酒精、无机物
C. CO2、干冰、有机物D. Na2CO3、小苏打、盐
【答案】A
【解析】
【详解】A.NaOH是氢氧化钠的化学式,俗称苛性钠,是一种电离时产生的阴离子全部是氢氧根离子的化合物,属于碱,A正确;
B.酒精的化学式为C2H5OH,属于有机物,B错误;
C.固态的CO2俗称干冰,属于无机物,C错误;
D.Na2CO3是碳酸钠的化学式,俗称苏打或纯碱,小苏打是碳酸氢钠(NaHCO3)的俗称,D错误;
故选A。
16. “清明插柳,端午插艾。”艾草含有丰富的黄酮素(),它具有较高的药用价值。下列有关黄酮素的叙述正确的是
A. 该分子中含有B. 黄酮素完全燃烧生成和H2O
C. 黄酮素由3个元素构成D. 黄酮素中碳、氢、氧元素质量比为15:10:2
【答案】B
【解析】
【详解】A.黄酮素是由黄酮素分子构成,黄酮素分子由碳原子、氢原子、氧原子构成,故该分子中不含有氧分子,故A错误;
B.由黄酮素化学式可知,该物质属于有机物,含有碳、氢、氧3种元素,完全燃烧生成二氧化碳和水,故B正确;
C.黄酮素由碳、氢、氧3种元素组成,元素不讲个数,故C错误;
D.黄酮素中碳、氢、氧元素质量比为(12×15):(1×10):(16×2)=90:5:16,黄酮素中氢元素质量分数最小,故D错误;
故选:B。
17. 下列各组离子在环境中能形成无色透明溶液的一组
A. B.
C. D.
【答案】A
【解析】
【详解】A.四种离子在pH=13的环境中能形成无色透明溶液,A符合题意;
B.pH=13的溶液呈强碱性,存在大量OH-,OH-与Mg2+反应生成氢氧化镁沉淀,不能形成无色透明的溶液,B不符合题意;
C.Cu2+是有色离子,且Cu2+和溶液中的OH-反应生成氢氧化铜沉淀,不能形成无色透明的溶液,C不符合题意;
D.反应生成硫酸钡沉淀,不能形成无色透明的溶液,D不符合题意;
故选A。
18. 甲、乙、丙三种固体物质的溶解度曲线如图所示。下列说法正确的是
A. 20℃时,甲的溶解度大于乙的溶解度
B. 图中P点表示10℃时丙的饱和溶液
C. 20℃时,100g乙的饱和溶液中含有乙的质量为30g
D. 50℃时,同质量的甲、乙、丙饱和溶液降温至10℃,甲溶液中析出固体最多
【答案】D
【解析】
【详解】A.根据图示,20℃时,甲的溶解度小于乙的溶解度,A错误;
B.p点在丙曲线下方,表示10℃时丙的不饱和溶液,B错误;
C.20℃时,乙的溶解度为30g,表示100g水中溶解30g乙行成130g饱和溶液,C错误;
D.50℃时,同质量的甲、乙、丙饱和溶液降温至10℃,甲溶解度减小幅度最大,甲溶液中析出固体最多,D正确;
答案选D。
19. 某无色水溶液中可能含有以下离子中的几种:H+、Mg2+、Cu2+、Cl-、、,为确定其成分,小芳进行了以下实验:
①经测定,溶液pH=1;
②取部分未知溶液加入过量NaOH溶液,有白色沉淀产生,过滤;
③取②的部分滤液加入溶液,有白色沉淀产生。
分析上述实验,下列对溶液中含有离子的判断正确的是
A. 一定含有,可能含有
B. 一定含有,,可能含有
C. 一定含有,可能含有
D. 一定含有、,可能含有
【答案】B
【解析】
【分析】镁离子和碳酸根离子会生成溶于酸的碳酸镁沉淀,铜离子在溶液中显蓝色,镁离子和氢氧根离子会生成氢氧化镁沉淀,铜离子和氢氧根离子会生成氢氧化铜沉淀,钡离子和硫酸根离子反应生成不溶于酸的硫酸钡沉淀,和碳酸根离子反应生成溶于酸的碳酸钡沉淀。①经测定,溶液pH=1,溶液中含有大量的氢离子,所以样品中一定不含碳酸根离子;②取部分未知溶液加入过量NaOH溶液,有白色沉淀产生,过滤,所以样品中一定含有镁离子,一定不含铜离子;③取②的部分滤液加入BaCl2溶液,有白色沉淀产生,所以样品中一定含有硫酸根离子,题中的现象不能确定是否含有氯离子,
【详解】A.根据分析,一定含有H+、Mg2+、,一定不含碳酸根离子,故A错误;
B.根据分析,一定含有H+、Mg2+、,可能含有Cl-,故B正确;
C.根据分析,一定含有H+、Mg2+、,一定不含铜离子,故C错误;
D.根据分析,一定含有H+、Mg2+、,可能含有Cl-,一定不含铜离子,故D错误;
故选:B。
20. 1919年卢瑟福在核反应中用α粒子(即氦核)轰击短周期非金属原子,得到核素和一种新的粒子M,其核反应原理为。其中X、Y、M的质子数之和为16.下列说法正确的是
A. 粒子M中含有1个中子
B. X形成的氧化物均为酸性氧化物
C. Y形成的常见单质常温下是固态
D. 中所有原子均满足8电子稳定结构
【答案】D
【解析】
【分析】原子轰击实验中,满足质子和质量数守恒,因此A+4=A+3+1,Z+2=Z+1+1,则M的质量数为1,质子数为1,可知M为H,元素X、Y、M的质子数之和为16,X的质子数为Z,则Z+Z+1+1=16,解得Z=7,因此X为N,Y为O,据此分析解答。
【详解】A.粒子M为H原子,质量数为1,质子数为1,则中子数=1-1=0,故粒子M中没有中子,故A错误;
B.X为N元素,N和O能形成NO、NO2、N2O4等多种氧化物,NO不能与碱溶液反应,不属于酸性氧化物,故B错误;
C.Y为O,常见单质O2、O3常温下是气态,故C错误;
D.N原子最外层有5个电子,Cl原子最外层有7个电子,三个Cl原子可与一个N原子共用三对电子形成NCl3,所有原子均为8电子稳定结构,故D正确;
答案选D。
二、填空题(共38分)
21. 阅读信息,回答问题。
(1)烤焦的食物表面呈黑色,说明这些食物中含有_______元素。
(2)精美的食材在烧烤架上翻滚着,接受来自炭火的淬炼,香气四溢,远远就能闻到随烟火升起的肉香、油香、孜然香……,从微观角度解释其原因是_______。
(3)揉搓冷敷袋,水袋破裂,盐溶解吸热。这种盐是_______(填“氯化钠”或“硝酸铵”),塑料膜属于____(填“合成”或“复合”)材料。
(4)将太阳能转化为电能的常用材料是硅,硅属于_______(填“金属”或“非金属”)元素,它在地壳里的含量居第_______位。
(5)杂交水稻之父袁隆平说“人就像一粒种子,要做一粒好的种子”。水稻种子的主要成分为淀粉,淀粉属于_______营养物质。
A. 蛋白质B. 糖类C. 油脂D. 维生素
(6)李明在水稻生长过程中发现部分水稻有叶片发黄和倒伏现象,他需要及时施加的一种肥料是______(填序号)。
A. KClB. C. D.
【答案】(1)碳或C (2)分子在不断运动
(3) ①. 硝酸铵 ②. 合成
(4) ①. 非金属 ②. 二 (5)B (6)C
【解析】
【小问1详解】
烤焦的食物表面呈现黑色,证明食物中含有碳元素;
【小问2详解】
香气四溢,远远就能闻到随烟火升起的肉香、油香、孜然香,表明分子是不断运动的;
【小问3详解】
氯化钠溶于水温度变化不大,硝酸铵溶于水吸收热量;塑料膜不是天然存在的,属于合成材料;
【小问4详解】
硅属于非金属元素,在地壳中含量第一位是氧元素,硅元素居第二位;
【小问5详解】
水稻种子的主要成分为淀粉,淀粉属于糖类,故选B;
【小问6详解】
李明在水稻生长过程中发现部分水稻有叶片发黄(缺乏氮元素)和倒伏现象(缺乏钾元素),他需要及时施加的含有氮元素与钾元素的肥料,即KNO3;故答案为:C。
22. 金属材料与人类生活息息相关,请回答下列问题。
(1)钙元素在元素周期表中的信息如图所示,则钙元素在周期表的位置是_______。
(2)家用台灯通常采用铜质插头,是利用金属铜的_______性。
(3)我国是最早采用湿法炼铜的国家,铁与硫酸铜溶液反应的化学方程式是_______。
(4)将一定质量的Zn片加入的混合溶液中,充分反应后过滤,得到滤渣和滤液,则滤渣中一定含有的金属是_______;若滤液显蓝色,则滤液中溶质一定有_______。
【答案】(1)第四周期IIA族
(2)导电 (3)
(4) ①. Ag ②.
【解析】
【小问1详解】
Ca原子序数20,位于元素周期表第四周期IIA族;
【小问2详解】
台灯通常采用铜质插头,是利用金属铜的导电性;
【小问3详解】
铁与硫酸铜溶液反应,生成硫酸亚铁和铜,化学方程式:;
【小问4详解】
将一定质量的Zn片加入的混合溶液中,Zn优先与反应,充分反应后过滤,得到滤渣和滤液,则滤渣中一定含有的金属Ag;若滤液显蓝色,说明硫酸铜剩余,则滤液中溶质一定有。
23. A~H是初中化学常见的物质,其中A是发酵粉的主要成分之一,B是常用调味品,E、F的俗称分别是熟石灰、纯碱。它们之间的相互转化关系如图所示。
(1)在物质的分类中,D属于_______(填“单质”“酸”“碱”“盐”或“氧化物”)。
(2)写出A、B、E的化学式:A_______,B_______,E_______。
(3)图中反应②的化学方程式为_______,反应基本类型为_______。
(4)图中反应④的化学方程式为_______,反应基本类型为_______。
【答案】(1)氧化物 (2) ①. NaHCO3 ②. NaCl ③. Ca(OH)2
(3) ①. CaO+H2O=Ca(OH)2 ②. 化合反应
(4) ①. Ca(OH)2+Na2CO3=CaCO3↓ +2NaOH ②. 复分解反应
【解析】
【分析】A~H是初中化学常见的物质,A是发酵粉的主要成分之一,所以A是碳酸氢钠,B是常用调味品,所以B是氯化钠,E、F的俗称分别是熟石灰、纯碱,所以E是Ca(OH)2,F是碳酸钠,碳酸氢钠和盐酸反应生成氯化钠、水和二氧化碳,C会生成氢氧化钙,所以C是水,D是二氧化碳,碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,经过验证,推导正确,所以A是NaHCO3,B是NaCl,C是H2O;
【小问1详解】
由分析可知D为CO2,在物质的分类中,CO2由C和O两种元素组成,属于氧化物;
【小问2详解】
A是发酵粉的主要成分之一,则A为NaHCO3;B是常用调味品,又是A生成的,所以B为NaCl;氧化钙与水反应生成E为Ca(OH)2;
【小问3详解】
反应②是氧化钙和水反应生成氢氧化钙,化学方程式为CaO+H2O=Ca(OH)2,反应类型是化合反应;
【小问4详解】
反应④是氢氧化钙和碳酸钠反应生成碳酸钙沉淀和氢氧化钠,化学方程式为:Ca(OH)2+Na2CO3=CaCO3↓ +2NaOH,反应类型是复分解反应。
24. 高锰酸钾是一种重要的化工产品,在化学、生产、生活等场境中都有重要的用途。某工厂生产高锰酸钾的流程如下图所示。
请回答下列问题:
(1)高锰酸钾常常可以用于实验室制氧气,请写出化学方程式_______。
(2)“Ⅰ混合加热”发生的主要是_______(填“物理”或“化学”)变化。
(3)请将“Ⅱ氧化反应”发生反应的化学方程式补充完整(在横线上填化学式)_____。
____________。
(4)“Ⅲ电解”反应中,反应前后化合价发生变化的元素有______(写元素符号)。
(5)生产流程中可循环利用的物质是_______(写化学式)。
【答案】(1)
(2)物理 (3)O2、H2O
(4)Mn、H (5)KOH
【解析】
【分析】“Ⅰ混合加热”将二氧化锰、KOH从固态转化为液体,“Ⅱ氧化反应”中MnO2被氧化为K2MnO4,空气中O2被还原为H2O,反应方程式为,“Ⅲ电解”反应中,K2MnO4转化为KMnO4,H2转化为KOH;
【小问1详解】
实验室加热高锰酸钾分解错锰酸钾、二氧化锰和氧气,反应的化学方程式为;
【小问2详解】
“Ⅰ混合加热”只是物质状态发生了改变,没有新物质生成,属于物理变化;
【小问3详解】
根据化学方程式可知,反应物中含K、Mn、O、H的个数分别是4、2、8、4,生成物中含K、Mn、O、H的个数分别是4、2、8、0,根据质量守恒定律,化学反应前后,原子的种类和数目不变,生成物4个氢原子需2个氧原子结合,生成2个水分子,故反应物中还含有2个O,即O2,配平可得化学方程式为;
【小问4详解】
“Ⅲ电解”反应中,K2MnO4转化为KMnO4,Mn元素化合价从+6升高至+7价,H2转化为KOH,H元素化合价从0升高至+1价,反应前后化合价发生变化的元素有Mn、H;
【小问5详解】
氢氧化钾可以作反应原料,还可以由反应制得,所以生产流程中可循环利用的物质是氢氧化钾,化学式为:KOH。
三、实验题(共22分)
25. 海洋是一座天然的大宝藏。
(1)通过晾晒海水得到的粗盐中含有少量和泥沙,甲同学将该粗盐样品进行精制,流程如图:
①分别写出加入过量溶液和NaOH溶液时发生的化学反应方程式______、_______。
②蒸发溶液时,_______,须停止加热。
(2)乙同学用制得氯化钠和蒸馏水配制生理盐水。配制步骤:①称量和量取②溶解③计算④装入试剂瓶贴好标签。正确的顺序是___(填序号)
(3)海水淡化可缓解淡水资源匮乏的问题。如图为太阳能海水淡化装置,该装置利用的是原理_______(填分离操作名称)。
【答案】(1) ①. ②. ③. 当有较多晶体析出
(2)③①②④ (3)蒸馏
【解析】
【分析】粗盐中含有少量和泥沙,加水溶解、过滤出泥沙,向混合液I中加入过量氯化钡溶液与硫酸钠反应生成硫酸钡沉淀,加入NaOH溶液与氯化镁反应生成氢氧化镁沉淀,加入过量碳酸钠溶液与氯化钙和过量的氯化钡反应生成碳酸钙、碳酸钡沉淀,过滤后溶液存在NaCl、NaOH、碳酸钠,加入适量稀盐酸与NaOH、碳酸钠反应生成NaCl,最后蒸发结晶得到精盐;
【小问1详解】
①氯化钡与硫酸钠反应生成硫酸钡沉淀和氯化钠,化学方程式Na2SO4+BaCl2=BaSO4↓+2NaCl;氢氧化钠与氯化镁反应生成氢氧化镁沉淀和氯化钠,化学方程式为2NaOH+MgCl2=Mg(OH)2↓+2NaCl;
②蒸发溶液时,当有较多晶体析出,须停止加热,利用余热蒸干溶液;
【小问2详解】
用制得的氯化钠和蒸馏水配制生理盐水,配制步骤为③计算、①称量和量取、②溶解、④装入试剂瓶贴好标签。正确的顺序是③①②④;
【小问3详解】
图为太阳能海水淡化装置,该装置将一定量的海水暴晒一段时间后,水会蒸发,水蒸气再冷凝成水,原理是蒸馏操作。
26. 实验课上,老师向滴有无色酚酞试液的NaOH红色溶液中滴加稀HCl,同学们观察到溶液颜色由红色变为无色,说明酸碱发生了中和反应。
【提出问题】HCl和NaOH是否恰好完全反应了?
【查阅资料】I.常温下,酚酞在pH≤8.2的溶液中呈无色,在pH>8.2的溶液中呈红色。
Ⅱ.相同温度下,NaOH稀溶液中溶质的质量分数越大,溶液pH越大。
【猜想假设】
(1)①_______,溶液pH>7;
②恰好完全反应,溶液pH=7;
③HCl过量,溶液pH<7。
【理论论证】
(2)分别取少量反应后的无色溶液于3支试管中,按下列方案实验:
【结论分析】
(3)反应后的无色溶液中还有少量NaOH,此时pH的范围_______;加热蒸发一段时间后,恢复至常温,当溶液的pH>8.2时,变为红色。
【反思总结】
(4)向某碱性溶液中滴加2~3滴无色酚酞试液,振荡后,溶液的颜色_______变为红色。(填“一定”或“不一定”)
【拓展应用】
(5)在探究酸碱性质的实验中,可借助pH传感器监测溶液pH的变化情况。常温下,向盐酸中加水稀释,溶液pH变化与下图吻合的是___。(填序号)
【答案】(1)NaOH过量
(2) ①. ③ ②.
(3)7
【解析】
【小问1详解】
溶液pH > 7,说明溶液呈碱性,说明氢氧化钠过量,故填:NaOH过量;
【小问2详解】
向反应后的无色溶液中加入碳酸氢钠溶液,无气泡产生,由于盐酸能与碳酸氢钠反应会生成氯化钠、水和二氧化碳,说明反应后的溶液中不含盐酸,故假设③错误;故填:③;
向反应后的溶液中滴加几滴硫酸铜溶液,产生蓝色沉淀,发生的反应为氢氧化钠与硫酸铜反应生成氢氧化铜沉淀和硫酸钠,方程式为: ;
【小问3详解】
反应后的无色溶液中还有少量NaOH,溶液为碱性,pH >7,但溶液为无色,由于酚酞在pH≤8.2的溶液中呈无色,因此此时pH的范围为:7
由于酚酞在pH≤8.2的溶液中呈无色,向某碱性溶液中滴加2~3滴无色酚酞试液,振荡后,溶液的颜色不一定为红色,故答案为:不一定;
【小问5详解】
向盐酸中加水稀释,酸性减弱,但pH值只能无限接近于7,不会大于7,故答案为:②。A.取用固体
B.过滤液体
C.验满气体
D.测定溶液的pH
选项
元素符号
质量分数
A
N
3%
B
P
1%
C
K
0.35%
D
S
0.25%
A.制备
B.除去中混有的HCl气体
C.干燥
D.排空气法收集
实验操作
实验现象
实验结论
方案1
滴加几滴碳酸氢钠溶液
无气泡产生
假设_______错误(填序号)
方案2
加热蒸发
蒸发过程中,发现溶液由无色变为红色
假设①正确方案3的化学反应方程式_______
方案3
滴加几滴硫酸铜溶液
有蓝色沉淀生成
四川省成都市新津中学2022-2023学年高一下学期4月月考化学试题(Word版附解析): 这是一份四川省成都市新津中学2022-2023学年高一下学期4月月考化学试题(Word版附解析),文件包含四川省成都市新津中学2022-2023学年高一下学期4月月考化学试题Word版含解析docx、四川省成都市新津中学2022-2023学年高一下学期4月月考化学试题Word版无答案docx等2份试卷配套教学资源,其中试卷共25页, 欢迎下载使用。
四川省成都市石室中学2023-2024学年高一下学期竞赛班期末考试化学试题(Word版附答案): 这是一份四川省成都市石室中学2023-2024学年高一下学期竞赛班期末考试化学试题(Word版附答案),共10页。试卷主要包含了选择题等内容,欢迎下载使用。
四川省成都市石室中学2023-2024学年高一下学期期末考试化学试题(Word版附答案): 这是一份四川省成都市石室中学2023-2024学年高一下学期期末考试化学试题(Word版附答案),共11页。试卷主要包含了下列叙述正确的是,NA是阿伏加 德罗常数的值,下列说法不正确的是,化学是一门以实验为基础的学科,下列关于物质性质比较,不正确的等内容,欢迎下载使用。












