
所属成套资源:人教版九年级化学上册同步课堂精讲练(原卷版+解析)
初中化学人教版(2024)九年级上册课题2 原子的结构第2课时巩固练习
展开这是一份初中化学人教版(2024)九年级上册课题2 原子的结构第2课时巩固练习,共20页。试卷主要包含了原子核外电子排布,离子等内容,欢迎下载使用。
一、原子核外电子排布
1.核外电子排布规律
(1)核外电子无固定的运动轨迹,但有经常出现的区域,该区域叫做电子层,电子层由内而外总共分为7层,电子分层运动,电子优先排在离核较近的电子层,依次向外排布。
(2)第1层最多容纳 电子,第2层最多容纳 个电子。
最外层电子数不超过 个(只有1层的,电子不超过 个)(每层最多容纳电子数 个,n为电子层数)
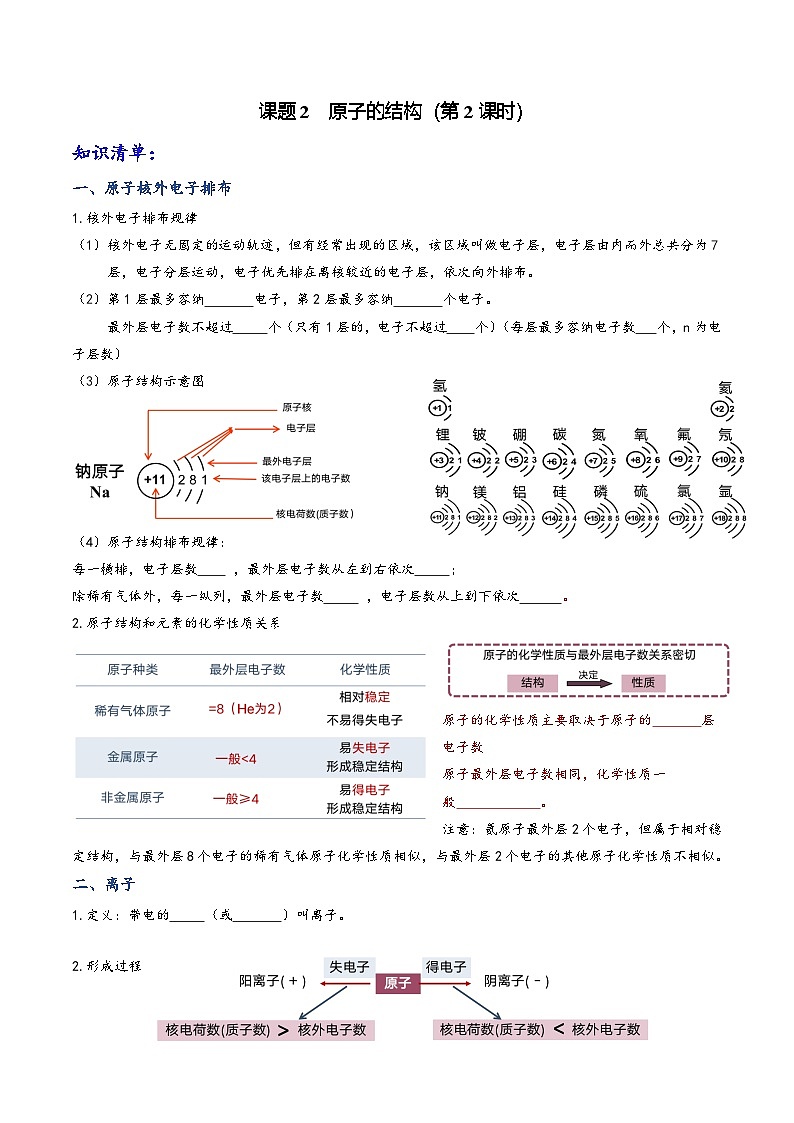
(3)原子结构示意图
(4)原子结构排布规律:
每一横排,电子层数 ,最外层电子数从左到右依次 ;
除稀有气体外,每一纵列,最外层电子数 ,电子层数从上到下依次 。
2.原子结构和元素的化学性质关系
原子的化学性质主要取决于原子的 层电子数
原子最外层电子数相同,化学性质一般 。
注意:氦原子最外层2个电子,但属于相对稳定结构,与最外层8个电子的稀有气体原子化学性质相似,与最外层2个电子的其他原子化学性质不相似。
二、离子
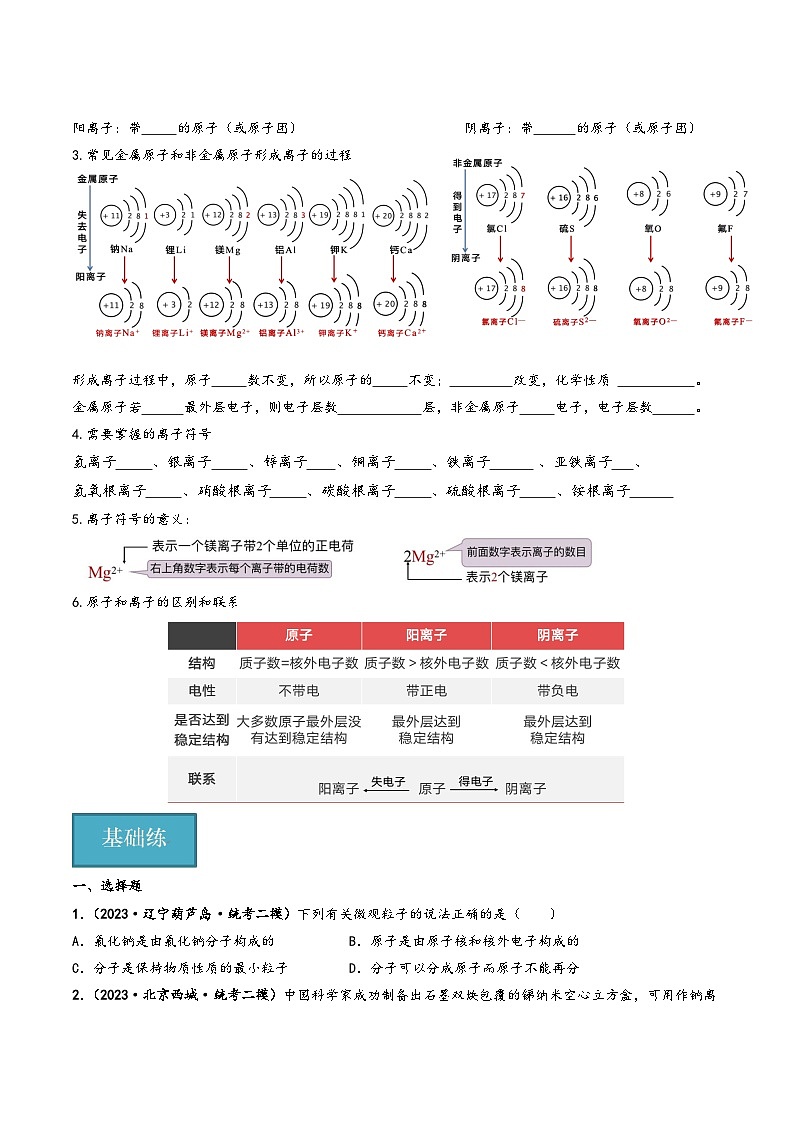
1.定义:带电的 (或 )叫离子。
2.形成过程
阳离子:带 的原子(或原子团) 阴离子:带 的原子(或原子团)
3.常见金属原子和非金属原子形成离子的过程
形成离子过程中,原子 数不变,所以原子的 不变; 改变,化学性质 。
金属原子若 最外层电子,则电子层数 层,非金属原子 电子,电子层数 。
4.需要掌握的离子符号
氢离子 、银离子 、锌离子 、铜离子 、铁离子 、亚铁离子 、
氢氧根离子 、硝酸根离子 、碳酸根离子 、硫酸根离子 、铵根离子
5.离子符号的意义:
6.原子和离子的区别和联系
一、选择题
1.(2023·辽宁葫芦岛·统考二模)下列有关微观粒子的说法正确的是( )
A.氯化钠是由氯化钠分子构成的B.原子是由原子核和核外电子构成的
C.分子是保持物质性质的最小粒子D.分子可以分成原子而原子不能再分
2.(2023·北京西城·统考二模)中国科学家成功制备出石墨双炔包覆的锑纳米空心立方盒,可用作钠离子电池负极材料。一种锑原子中含有51个质子和70个中子,它的核外电子数是( )
A.51B.70
C.121D.19
3.(2023·云南昆明·统考二模)我国科研人员实现了对极其稀有同位素氪-81的单原子探测,这一方法助力于地球与环境科学研究。如图为氪原子的结构示意图,有关该原子说法错误的是( )
A.原子核带正电B.核外有4个电子层
C.第一层电子数为8D.该结构为一种相对稳定的结构
4.(2023·湖南长沙·长沙市第六中学校考模拟预测)如图是五种粒子的结构示意图,下列说法错误的是( )
A.图中粒子共能表示四种元素
B.图中表示阴离子的是c、e
C.图中b粒子的化学符号为Mg2+
D.图中d粒子在化学反应中易失去电子
5.(2023·山西朔州·校考模拟预测)阴离子交换树脂可用于水的处理,以下粒子中属于阴离子的是( )
A. B.
C. D.
6.(2023·陕西咸阳·统考三模)如图是四种粒子的结构示意图,下列说法正确的是( )
A.①③④具有相对稳定结构B.①表示的是阳离子
C.②在化学反应中易得到电子D.③与氯离子核外电子排布相同
7.(2023·湖南长沙·校考一模)“结构决定性质”是化学的核心观念。下列有关氯原子和氯离子的说法错误的是( )
A.氯离子的结构示意图为
B.氯原子核内有17个质子
C.氯原子的最外层有7个电子
D.和氯原子相比,氯离子的化学性质更稳定
8.(2023·黑龙江哈尔滨·哈尔滨市虹桥初级中学校校考模拟预测)下列粒子结构示意图中属于稀有气体原子的是( )
A. B.
C. D.
8.(2023·云南玉溪·统考三模)“结构决定性质“是化学的核心观念,下列说法不正确的是( )
A.硫原子的最外层电子数为6
B.硫原子易失电子变成硫离子
C.硫元素呈-2价与硫原子的最外层电子数有关
D.硫离子的结构示意图为
9.(2023·黑龙江绥化·校考二模)对Fe3+、Fe2+、Fe三种粒子的判断中,正确的是( )
①核电荷数相同 ②核外电子数相等 ③电子层结构完全相同 ④质量几乎相等 ⑤等质量的三种微粒含有的质子数相等。
①④⑤B.①③⑤
C.①②③④⑤D.②③④
二、填空题
10.(2023·湖南怀化·一模)某元素是人体中的常见元素,该元素在人体内99%存在于骨骼和牙齿中,其原子结构示意图为 ,该元素的原子序数为 ,该元素的核内质子数为 ,原子核外有 个电子层;该元素属于 (填“金属”和“非金属”)元素,该元素原子失去最外层电子所形成的离子为 (用离子符号表示)。
11.(2023·湖北武汉·校联考一模)碘是人体必须得一种微量元素。碘元素的符号为I,下图I-(碘离子)的结构示意图。
(1)图中x = 。
(2)碘属于 元素(填“金属”或“非金属”),位于第 周期。下图表示的微粒中,与I化学性质相似的是 (填字母序号)
12.(2023·辽宁葫芦岛·校联考一模)将宏观、微观及化学符号联系在一起是化学学科的特点。如图是五种粒子的结构示意图,请回答下列问题:
①在化学反应中,容易失去电子的是 (填字母);
②属于同种元素的粒子是 (填字母);
③在B、C、D中与A具有相似化学性质的微粒是 (填字母)。
一、选择题
1.(2023·四川乐山·统考模拟预测)原子和离子可以用结构示意图表示,下列结构示意图表示阴离子的是( )
A. B.
C. D.
2.(2023·山东淄博·统考一模)认识物质的微观世界,是化学学科的重要内容之一,关于下列微粒说法错误的是( )
A.①④属于相对稳定结构B.它们表示四种不同的元素
C.③表示是阳离子D.②表示的元素在化合物中通常显-2价
3.(2023·陕西榆林·校考二模)化学符号含义丰富。下列说法正确的是( )
①O ②O2- ③2O ④O2 ⑤
A.①和②所示微粒的质子数不相同B.②和④所示符号都具有宏观含义
C.③和④均可表示2个氧原子D.①和⑤表示的微粒相同
4.(2023·上海·模拟预测)Na2SO4 中的原子团名称是( )
A.硫酸根B.碳酸根
C.硝酸根D.氢氧根
5.(2023·江苏常州·统考二模)已知一个硫原子的质量为m g,其相对原子质量为32,则一个相对原子质量为152的铕(Eu)原子的质量为( )
A.B.
C.D.
6.(2023·广东东莞·校考一模)锶的原子结构示意图及在元素周期表中某些信息如图所示,下列说法正确的是( )
A.x的值为8B.锶的相对原子质量为87.62g
C.锶原子的中子数为38D.锶原子在化学反应中易失去电子
二、填空题
7.(2023·湖北荆州·校联考一模)图中A、B、C、D是四种粒子的结构示意图,请回答下列问题:
(1)以上四种粒子的结构示意图中,属于同种元素的粒子是 (填字母代号)。
(2)以上四种粒子中,达到稳定结构的是 (填字母代号)。
(3)以上四种结构示意图所表示的粒子中,表示离子的是 (填离子符号)。
(4)A、C化学性质相似的原因是 。
8.(2023·山东济宁·统考二模)用锶(Sr)等材料制成的原子钟精准度极高,常被用于卫星的精准计时。图1是锶原子的结构示意图。图2是几种粒子的结构示意图。
(1)图1中x= ;
(2)图2中与锶原子化学性质相似的原子是 (填化学符号);
(3)已知原子的核外电子层数越多,原子半径越大,当核外电子层数相等时,核电荷数越多,原子半径越小。B~D中半径最大的原子是 (填字母)。
9.(2023·天津·黄浦区二模)建立“宏观—微观”之间的联系,是化学学习的重要方法。根据图示回答下列问题:
(1)硒元素被科学家称为“抗癌之王”,科学界研究发现血硒水平的高低与癌的发生息息相关。如图一是硒元素的相关信息:硒元素属于 (填“金属”或“非金属”)元素,相对原子质量是 。
(2)如图二,Na、Mg、Al三种元素位于元素周期表中第 周期,对于Na、Mg、Al三种元素来说,原子最外层电子数越多,原子半径反而越小,原子核对核外电子的引力越大,Na、Mg、Al三种原子失电子能力由强到弱顺序是 。
(3)二氧化碳和氢气在一定条件下转换为化工原料乙烯(C2H4),是我国科学研究的又一重大突破,其反应微观过程如图三所示,用化学方程式表示为 ,由图三得到启示。请用微观的观点解释化学变化的实质 。
课题2 原子的结构(第2课时)
知识清单:
一、原子核外电子排布
1.核外电子排布规律
(1)核外电子无固定的运动轨迹,但有经常出现的区域,该区域叫做电子层,电子层由内而外总共分为7层,电子分层运动,电子优先排在离核较近的电子层,依次向外排布。
(2)第1层最多容纳2个电子,第2层最多容纳8个电子。
最外层电子数不超过8个(只有1层的,电子不超过2个)(每层最多容纳电子数2n2个,n为电子层数)
(3)原子结构示意图
(4)原子结构排布规律:
每一横排,电子层数相同,最外层电子数从左到右依次递增;
除稀有气体外,每一纵列,最外层电子数相同,电子层数从上到下依次递增。
2.原子结构和元素的化学性质关系
原子的化学性质主要取决于原子的最外层电子数
原子最外层电子数相同,化学性质一般相似。
注意:氦原子最外层2个电子,但属于相对稳定结构,与最外层8个电子的稀有气体原子化学性质相似,与最外层2个电子的其他原子化学性质不相似。
二、离子
1.定义:带电的原子(或原子团)叫离子。
2.形成过程
阳离子:带正电的原子(或原子团) 阴离子:带负电的原子(或原子团)
3.常见金属原子和非金属原子形成离子的过程
形成离子过程中,原子质子数不变,所以原子的种类不变;核外电子数改变,化学性质改变。
金属原子若失去最外层电子,则电子层数减少1层,非金属原子得到电子,电子层数不改变。
4.需要掌握的离子符号
氢离子H+、银离子Ag+、锌离子Zn2+、铜离子Cu2+、铁离子Fe3+、亚铁离子Fe2+、
氢氧根离子OH-、硝酸根离子NO3-、碳酸根离子CO32-、硫酸根离子SO42-、铵根离子NH4+
5.离子符号的意义:
6.原子和离子的区别和联系
一、选择题
1.(2023·辽宁葫芦岛·统考二模)下列有关微观粒子的说法正确的是( )
A.氯化钠是由氯化钠分子构成的B.原子是由原子核和核外电子构成的
C.分子是保持物质性质的最小粒子D.分子可以分成原子而原子不能再分
【答案】B
【解析】A、氯化钠是由氯离子、钠离子构成的,此选项错误;B、原子是由原子核和核外电子构成的,此选项正确;C、分子是保持物质化学性质的最小粒子,此选项错误; D、在化学变化中,分子可以分成原子而原子不能再分,但从结构上来说,原子还可以再分,此选项错误。故选B。
2.(2023·北京西城·统考二模)中国科学家成功制备出石墨双炔包覆的锑纳米空心立方盒,可用作钠离子电池负极材料。一种锑原子中含有51个质子和70个中子,它的核外电子数是( )
A.51B.70
C.121D.19
【答案】A
【解析】原子中,质子数=核外电子数,一种锑原子中含有51个质子和70个中子,它的核外电子数是51。
故选A。
3.(2023·云南昆明·统考二模)我国科研人员实现了对极其稀有同位素氪-81的单原子探测,这一方法助力于地球与环境科学研究。如图为氪原子的结构示意图,有关该原子说法错误的是( )
A.原子核带正电B.核外有4个电子层
C.第一层电子数为8D.该结构为一种相对稳定的结构
【答案】C
【解析】A.原子核带正电,说法正确;B.由氪原子的结构示意图可知,该原子核外有4个电子层,说法正确;
C.由氪原子的结构示意图可知,该原子第一层电子数为2,说法错误;D.由氪原子的结构示意图可知,该原子最外层电子数为8,所以该结构为一种相对稳定的结构,说法正确;故选C。
4.(2023·湖南长沙·长沙市第六中学校考模拟预测)如图是五种粒子的结构示意图,下列说法错误的是( )
A.图中粒子共能表示四种元素
B.图中表示阴离子的是c、e
C.图中b粒子的化学符号为Mg2+
D.图中d粒子在化学反应中易失去电子
【答案】B
【解析】A、不同种元素最本质的区别是质子数不同,a和e核内质子数相同,属于同一种元素,图中共表示4种元素,故选项说法正确,不符合题意。B、c质子数=核外电子数=18,为原子;e质子数=17,核外电子数=18,质子数<核外电子数,为阴离子,故选项说法错误,符合题意。C、b质子数=12,核外电子数=10,质子数>核外电子数,为镁离子;化学符号为Mg2+,故选项说法正确,不符合题意。D、图中d粒子最外层电子数为1,小于4个,在化学反应中易失去电子,故选项说法正确,不符合题意。故选B。
5.(2023·山西朔州·校考模拟预测)阴离子交换树脂可用于水的处理,以下粒子中属于阴离子的是( )
A. B.
C. D.
【答案】A
【解析】A、质子数为17,核外电子数为2+8+8=18,质子数<核外电子数,为阴离子,故A正确;B、质子数为18,核外电子数为2+8+8=18,质子数=核外电子数,为原子,故B错误;C、质子数为19,核外电子数为2+8+8=18,质子数>核外电子数,为阳离子,故C错误;D、质子数为20,核外电子数为2+8+8=18,质子数>核外电子数,为阳离子,故D错误。故选A。
6.(2023·陕西咸阳·统考三模)如图是四种粒子的结构示意图,下列说法正确的是( )
A.①③④具有相对稳定结构B.①表示的是阳离子
C.②在化学反应中易得到电子D.③与氯离子核外电子排布相同
【答案】A
【解析】A.①③④最外层电子数都是8,所以具有相对稳定结构,正确;B.①核内质子数<核外电子数,所以表示的是阴离子,错误;C.②在化学反应中易失去最外层2个电子变成稳定结构,错误; D.③核外2个电子层,与氯离子(2,8,8)核外电子排布不相同,错误。故选A。
7.(2023·湖南长沙·校考一模)“结构决定性质”是化学的核心观念。下列有关氯原子和氯离子的说法错误的是( )
A.氯离子的结构示意图为
B.氯原子核内有17个质子
C.氯原子的最外层有7个电子
D.和氯原子相比,氯离子的化学性质更稳定
【答案】A
【解析】A、氯元素是第17号元素,在原子中,质子数=核外电子数=原子序数,氯原子的核外电子排布为2、8、7,最外层电子数为7,氯离子是氯原子得到1个电子形成的,故氯离子的核外电子排布为2、8、8,因此氯离子的结构示意图为 ,故A选项符合题意;B、氯元素是第17号元素,在原子中,质子数=原子序数=17,故B选项不符合题意;C、氯元素是第17号元素,在原子中,质子数=核外电子数=原子序数,氯原子的核外电子排布为2、8、7,氯原子的最外层有7个电子,故C选项不符合题意;D、氯原子的最外层电子数为7,易得到电子,氯离子的最外层电子数为8,不易得失电子,达到稳定结构,故和氯原子相比,氯离子的化学性质更稳定,故D选项不符合题意。故选A。
8.(2023·黑龙江哈尔滨·哈尔滨市虹桥初级中学校校考模拟预测)下列粒子结构示意图中属于稀有气体原子的是( )
A. B.
C. D.
【答案】B
【解析】A、表示氧离子,错误;B、表示氖原子,属于稀有气体原子,正确;C、表示钠离子,错误;D、表示氯离子,错误;故选B。
8.(2023·云南玉溪·统考三模)“结构决定性质“是化学的核心观念,下列说法不正确的是( )
A.硫原子的最外层电子数为6
B.硫原子易失电子变成硫离子
C.硫元素呈-2价与硫原子的最外层电子数有关
D.硫离子的结构示意图为
【答案】B
【解析】A、硫原子核外共3层电子,第一层2个电子,次外层有8个电子,最外层6个电子,故选项A正确;B、硫原子的最外层电子数为6,大于4,易得到电子变成硫离子,故选项B错误; C、硫原子的最外层有6个电子,形成化合物时,易得到2个电子,带2个单位负电荷,化合价为-2价,所以硫元素呈-2价与硫原子的最外层电子数有关,故选项C正确;D、硫原子的最外层有6个电子,易得到2个电子,变成硫离子,故硫离子的结构示意图为 ,故选项 D正确;故选:B。
9.(2023·黑龙江绥化·校考二模)对Fe3+、Fe2+、Fe三种粒子的判断中,正确的是( )
①核电荷数相同 ②核外电子数相等 ③电子层结构完全相同 ④质量几乎相等 ⑤等质量的三种微粒含有的质子数相等。
①④⑤B.①③⑤
C.①②③④⑤D.②③④
【答案】A
【解析】Fe原子失去2个电子形成Fe2+,失去3个电子形成Fe3+;元素是质子数(即核电荷数)相同的一类原子的总称,同种元素的粒子是质子数相同;据此结合题意进行分析判断。①1个Fe失去2个电子形成Fe2+,失去3个电子形成Fe3+,它们的核电荷数没有发生改变,它们的核电荷数相同,故选项①说法正确;
②1个Fe失去2个电子形成Fe2+,失去3个电子形成Fe3+,则Fe3+、Fe2+、Fe三种粒子的核外电子数不同,故选项②说法错误;③1个Fe失去2个电子形成Fe2+,失去3个电子形成Fe3+,它们的电子层结构不完全相同,故选项③说法错误;④Fe3+、Fe2+、Fe三种粒子的核外电子数不同,而原子的质量主要是集中在原子核上,则三者的质量几乎相等,故选项④说法正确;⑤由于三种粒子的质量几乎相等,它们核内质子数相等,则等质量的三种微粒含有的质子数相等,故选项⑤说法正确;故①④⑤说法正确。故选:A。
二、填空题
10.(2023·湖南怀化·一模)某元素是人体中的常见元素,该元素在人体内99%存在于骨骼和牙齿中,其原子结构示意图为 ,该元素的原子序数为 ,该元素的核内质子数为 ,原子核外有 个电子层;该元素属于 (填“金属”和“非金属”)元素,该元素原子失去最外层电子所形成的离子为 (用离子符号表示)。
【答案】 20 ; 20 ; 4 ;金属 ; Ca2+
【解析】根据在原子中,原子序数=质子数=核外电子数可得:元素的原子序数为:2+8+2+8=20;从电子结构示意图看出该元素原子核外有4个电子层;20号元素是钙元素,属于金属元素;在化学反应中易失去2个电子,形成阳离子,所形成的离子为Ca2+。
11.(2023·湖北武汉·校联考一模)碘是人体必须得一种微量元素。碘元素的符号为I,下图I-(碘离子)的结构示意图。
(1)图中x = 。
(2)碘属于 元素(填“金属”或“非金属”),位于第 周期。下图表示的微粒中,与I化学性质相似的是 (填字母序号)
【答案】53;非金属 ;五 ; E
【解析】(1)碘离子是碘原子得到一个电子形成的,在原子中,核内质子数等于核外电子数,则
。(2)碘元素的汉字名称是石字旁,最外层电子数是7,属于非金属元素,位于第五周期。下图表示的微粒中,与I化学性质相似的是E。
12.(2023·辽宁葫芦岛·校联考一模)将宏观、微观及化学符号联系在一起是化学学科的特点。如图是五种粒子的结构示意图,请回答下列问题:
①在化学反应中,容易失去电子的是 (填字母);
②属于同种元素的粒子是 (填字母);
③在B、C、D中与A具有相似化学性质的微粒是 (填字母)。
【答案】 C ; AD; B
【解析】若原子的最外层电子数≥4,在化学反应中易得电子,若最外层电子数<4,在化学反应中易失去电子。元素是质子数(即核电荷数)相同的一类原子的总称,元素的化学性质由它的原子的最外层电子数决定。①C的最外层电子数为1,在化学反应中易失去1个电子而形成阳离子。②元素是质子数(即核电荷数)相同的一类原子的总称,决定元素种类的是质子数(即核电荷数),同种元素的粒子是质子数相同,AD的质子数相同,属于同种元素。③元素性质与原子核外电子的排布,特别是最外层上的电子数目有密切关系,决定元素化学性质的是最外层电子数,在B、C、D中与A具有相似化学性质的微粒是B。
一、选择题
1.(2023·四川乐山·统考模拟预测)原子和离子可以用结构示意图表示,下列结构示意图表示阴离子的是( )
A. B.
C. D.
【答案】A
【解析】A、该粒子中,质子数小于核外电子数,表示阴离子,符合题意;B、该粒子中,质子数=核外电子数,表示原子,不符合题意;C、该粒子中,质子数大于核外电子数,表示阳离子,不符合题意;D、该粒子中,质子数=核外电子数, 表示原子,不符合题意。故选A。
2.(2023·山东淄博·统考一模)认识物质的微观世界,是化学学科的重要内容之一,关于下列微粒说法错误的是( )
A.①④属于相对稳定结构B.它们表示四种不同的元素
C.③表示是阳离子D.②表示的元素在化合物中通常显-2价
【答案】C
【解析】A、在①④微粒结构示意图中,最外层电子数都是8,都达到稳定结构,故选项说法正确;B、不同种元素最本质的区别是质子数不同,图中共表示4种元素,故选项说法正确;C、③质子数=17,核外电子数=18,质子数<核外电子数,为阴离子,故选项说法错误;D、②原子的最外层电子数为6,在化学反应中易得到2个电子而形成2个单位负电荷的阴离子,化合价的数值等于离子所带电荷的数值,且符号一致,则该元素的化合价为-2价,故选项说法正确。
3.(2023·陕西榆林·校考二模)化学符号含义丰富。下列说法正确的是( )
①O ②O2- ③2O ④O2 ⑤
A.①和②所示微粒的质子数不相同B.②和④所示符号都具有宏观含义
C.③和④均可表示2个氧原子D.①和⑤表示的微粒相同
【答案】D
【解析】A、质子数等于核电荷数,氧原子和氧离子的质子数都是8,故A错误不符合题意;B、②表示的是氧离子,不具有宏观含义,④可以表示氧气这种物质,有宏观含义,故B错误不符合题意;C、③表示2个氧原子④表示1个氧气分子中含有两个氧原子,不可直接表示2个氧原子,故C错误不符合题意;D、①⑤表示的都为氧原子,故D正确符合题意;故选D。
4.(2023·上海·模拟预测)Na2SO4 中的原子团名称是( )
A.硫酸根B.碳酸根
C.硝酸根D.氢氧根
【答案】A
【解析】硫酸钠中含有两种离子,Na+离子和离子,其中硫酸根离子属于原子团。A选项为硫酸根,符合题意;B、碳酸根为,不符合题意;C、硝酸根为,不符合题意;D、氢氧根为OH-,不符合题意。故选A。
5.(2023·江苏常州·统考二模)已知一个硫原子的质量为m g,其相对原子质量为32,则一个相对原子质量为152的铕(Eu)原子的质量为( )
A.B.
C.D.
【答案】C
【解析】两个原子的相对原子质量比等于其实际质量比,故,铕原子质量 =。故选C。
6.(2023·广东东莞·校考一模)锶的原子结构示意图及在元素周期表中某些信息如图所示,下列说法正确的是( )
A.x的值为8B.锶的相对原子质量为87.62g
C.锶原子的中子数为38D.锶原子在化学反应中易失去电子
【答案】D
【解析】A、原子中,核内质子数=核外电子数=核电荷数=原子序数,故锶原子的电子数应该为38,故2+8+x+8+2=38,x=18,故A错误,不符合题意;B、根据元素周期表信息图可知:锶的相对原子质量为87.62,单位为“1”,不为g,故B错误,不符合题意;C、原子中,质子数+中子数≈相对原子质量,故锶原子的中子数=88-38=50,故C错误,不符合题意;D、根据锶原子的原子结构示意图可知:锶原子最外层电子数为2,故锶原子在化学反应中易失去2个电子,故D正确,符合题意。故选:D。
二、填空题
7.(2023·湖北荆州·校联考一模)图中A、B、C、D是四种粒子的结构示意图,请回答下列问题:
(1)以上四种粒子的结构示意图中,属于同种元素的粒子是 (填字母代号)。
(2)以上四种粒子中,达到稳定结构的是 (填字母代号)。
(3)以上四种结构示意图所表示的粒子中,表示离子的是 (填离子符号)。
(4)A、C化学性质相似的原因是 。
【答案】 AB ; BD ; F- ;其原子的最外层电子数相同
【解析】由图中A、B、C、D是四种粒子的结构示意图可知,A是氟原子,B是氟离子,C是氯原子,D是氩原子。(1) 同种元素的质子数相同,A是氟原子,B是氟离子,质子数都是9,故属于同种元素的粒子是AB。(2)最外层电子数是8的为稳定结构,B氟离子和D氩原子最外层电子数是8,故达到稳定结构的是BD。(3)离子核外电子数和质子数不相等,A是氟原子,B是氟离子,C是氯原子,D是氩原子,故表示离子的是。(4)最外层电子数相同,化学性质相似,故A、C化学性质相似的原因是原子的最外层电子数相同。
8.(2023·山东济宁·统考二模)用锶(Sr)等材料制成的原子钟精准度极高,常被用于卫星的精准计时。图1是锶原子的结构示意图。图2是几种粒子的结构示意图。
(1)图1中x= ;
(2)图2中与锶原子化学性质相似的原子是 (填化学符号);
(3)已知原子的核外电子层数越多,原子半径越大,当核外电子层数相等时,核电荷数越多,原子半径越小。B~D中半径最大的原子是 (填字母)。
【答案】(1)18;(2)Mg;(3)C
【解析】(1)图1是锶原子的结构示意图,在原子中,质子数=核外电子数,即38=2+8+x+8+2,解得x=18;
(2)原子的最外层电子数相同,元素的化学性质相似,锶原子最外层有2个电子,所以图2中与锶原子化学性质相似的是C,C中质子数=核外电子数=12,是镁原子,其微粒化学符号是Mg;(3)已知原子的核外电子层数越多,原子半径越大,当核外电子层数相等时,核电荷数越多,原子半径越小。B~D中半径最大的原子是C。
9.(2023·天津·黄浦区二模)建立“宏观—微观”之间的联系,是化学学习的重要方法。根据图示回答下列问题:
(1)硒元素被科学家称为“抗癌之王”,科学界研究发现血硒水平的高低与癌的发生息息相关。如图一是硒元素的相关信息:硒元素属于 (填“金属”或“非金属”)元素,相对原子质量是 。
(2)如图二,Na、Mg、Al三种元素位于元素周期表中第 周期,对于Na、Mg、Al三种元素来说,原子最外层电子数越多,原子半径反而越小,原子核对核外电子的引力越大,Na、Mg、Al三种原子失电子能力由强到弱顺序是 。
(3)二氧化碳和氢气在一定条件下转换为化工原料乙烯(C2H4),是我国科学研究的又一重大突破,其反应微观过程如图三所示,用化学方程式表示为 ,由图三得到启示。请用微观的观点解释化学变化的实质 。
【答案】非金属 ;78.96; 三; Na>Mg>Al ;2CO2+6H2C2H4+4H2O ;分子拆分成原子,原子重新组合成新的分子
【解析】元素周期表每格能得到每一个原子的原子序数、元素符号、元素名称和相对原子质量,二氧化碳和氢气在一定条件下转换为化工原料乙烯(C2H4),化学方程式为。(1)硒是石字旁,故硒元素属于非金属元素,由图1可知,硒元素的相对原子质量是78.96。(2)元素周期表中,原子的电子层数等于周期数,则Na、Mg、Al三种元素位于元素周期表中第三周期,原子半径 同一周期(稀有气体除外),从左到右,随着原子序数的递增,元素原子的半径递减,对于Na、Mg、Al三种元素来说,原子最外层电子数越多,原子半径反而越小,原子核对核外电子的引力越大,Na、Mg、Al三种原子失电子能力由强到弱顺序是Na>Mg>Al。(3)二氧化碳和氢气在一定条件下转换为化工原料乙烯(C2H4),化学方程式表示为,化学反应是指分子破裂成原子,原子重新排列组合生成新分子的过程,由图三微观的观点待测化学变化的实质是分子破裂成原子,原子重新组合成新的分子。
相关试卷
这是一份化学人教版(2024)课题2 原子的结构课后练习题,共42页。试卷主要包含了原子的构成,相对原子质量,原子的核外电子排布等内容,欢迎下载使用。
这是一份初中化学人教版九年级上册第三单元 物质构成的奥秘课题2 原子的结构当堂达标检测题,共49页。试卷主要包含了原子的结构等内容,欢迎下载使用。
这是一份人教版九年级化学上册教材知识点梳理讲练测 课题2 原子的结构(原卷版+解析),共26页。试卷主要包含了原子的构成,原子核外电子的排布,离子,相对原子质量等内容,欢迎下载使用。













