


人教版高考化学一轮复习讲义第16章第74讲 以性质为主的探究类综合实验(2份打包,原卷版+教师版)
展开类型一 物质性质的探究
1.物质性质探究类实验的类型
(1)根据物质性质设计实验方案
(2)根据物质的结构(或官能团)设计实验方案
2.物质性质探究类实验的常见操作及原因
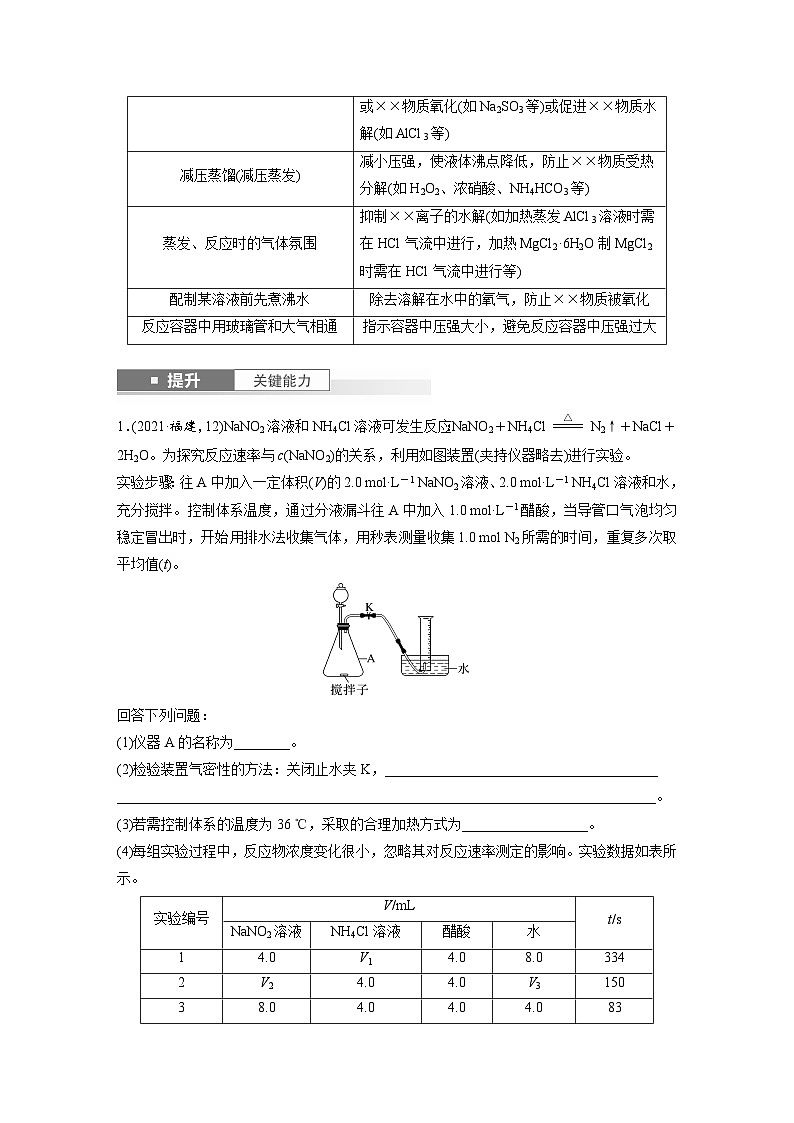
1.(2021·福建,12)NaNO2溶液和NH4Cl溶液可发生反应:NaNO2+NH4Cleq \(=====,\s\up7(△))N2↑+NaCl+2H2O。为探究反应速率与c(NaNO2)的关系,利用如图装置(夹持仪器略去)进行实验。
实验步骤:往A中加入一定体积(V)的2.0 ml·L-1 NaNO2溶液、2.0 ml·L-1 NH4Cl溶液和水,充分搅拌。控制体系温度,通过分液漏斗往A中加入1.0 ml·L-1醋酸,当导管口气泡均匀稳定冒出时,开始用排水法收集气体,用秒表测量收集1.0 ml N2所需的时间,重复多次取平均值(t)。
回答下列问题:
(1)仪器A的名称为________。
(2)检验装置气密性的方法:关闭止水夹K,_______________________________________
_____________________________________________________________________________。
(3)若需控制体系的温度为36 ℃,采取的合理加热方式为__________________。
(4)每组实验过程中,反应物浓度变化很小,忽略其对反应速率测定的影响。实验数据如表所示。
①V1=________,V3=________。
②该反应的速率方程为v=k·cm(NaNO2)·c(NH4Cl)·c(H+),k为反应速率常数。利用实验数据计算得m=________(填整数)。
③醋酸的作用是________________________________________________________________。
(5)如果用同浓度的盐酸代替醋酸进行实验1,NaNO2与盐酸反应生成HNO2,HNO2分解产生等物质的量的两种气体,反应结束后,A中红棕色气体逐渐变浅,装置中还能观察到的现象有____________________________________________________________________________。
HNO2分解的化学方程式为_______________________________________________________
______________________________________________________________________________。
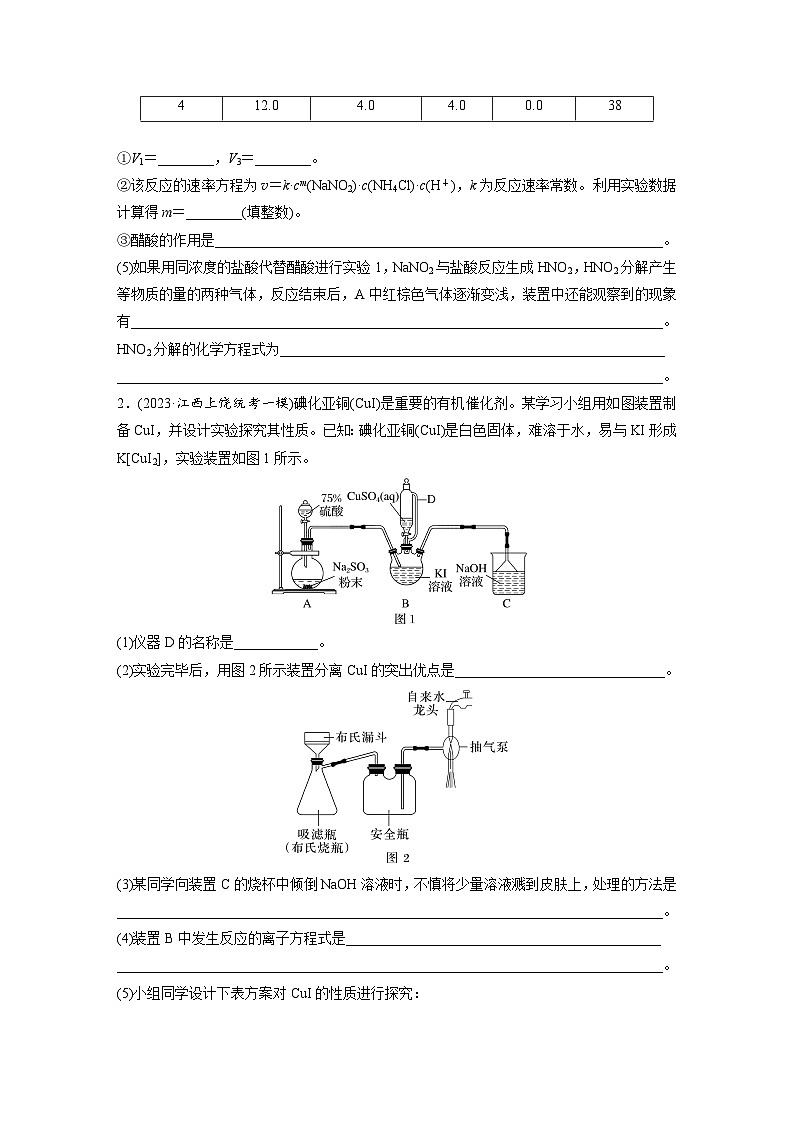
2.(2023·江西上饶统考一模)碘化亚铜(CuI)是重要的有机催化剂。某学习小组用如图装置制备CuI,并设计实验探究其性质。已知:碘化亚铜(CuI)是白色固体,难溶于水,易与KI形成K[CuI2],实验装置如图1所示。
(1)仪器D的名称是____________。
(2)实验完毕后,用图2所示装置分离CuI的突出优点是______________________________。
(3)某同学向装置C的烧杯中倾倒NaOH溶液时,不慎将少量溶液溅到皮肤上,处理的方法是
______________________________________________________________________________。
(4)装置B中发生反应的离子方程式是_____________________________________________
______________________________________________________________________________。
(5)小组同学设计下表方案对CuI的性质进行探究:
①在实验 Ⅰ 中“加水,又生成白色沉淀”的原理是________________________________
______________________________________________________________________________。
②根据实验 Ⅱ ,CuI与NaOH溶液反应的化学方程式是____________________________
______________________________________________________________________________。
(6)测定CuI样品纯度。取a g CuI样品与适量NaOH溶液充分反应后,过滤;在滤液中加入足量的酸化的双氧水,滴几滴淀粉溶液,用b ml·L-1Na2S2O3标准溶液滴定至终点,消耗Na2S2O3溶液的体积为V mL[已知:滴定反应为I2+2S2Oeq \\al(2-,3)===S4Oeq \\al(2-,6)(无色)+2I-]。该样品纯度为________(用含a、b、V的代数式表示)。如果其他操作均正确,仅滴定前盛标准溶液的滴定管用蒸馏水洗净后没有用标准溶液润洗,测得结果________(填“偏高”“偏低”或“无影响”)。
类型二 反应产物、反应机理的探究
1.解答产物确定题的思路分析
由性质确定反应产物是解此类题目的根本思路,而题目中所涉及的物质,一般分为两类。
2.文字表述题的各种答题规范
(1)沉淀洗涤是否完全的检验答题模板
取少许最后一次洗涤液,滴入少量……溶液(试剂),若……(现象),表示已经洗涤完全。
解答此类题目要注意四个得分点:取样+试剂+现象+结论。
(2)实验操作的原因、目的、作用的答题要点
(3)实验现象的准确、全面描述
(4)试剂的作用的答题模板
1.(2023·北京,19)资料显示,I2可以将Cu氧化为Cu2+。某小组同学设计实验探究Cu被I2氧化的产物及铜元素的价态。
已知:I2易溶于KI溶液,发生反应I2+I-Ieq \\al(-,3)(红棕色);I2和Ieq \\al(-,3)氧化性几乎相同。
(1)将等体积的KI溶液加入到m ml铜粉和n ml I2(n>m)的固体混合物中,振荡。
实验记录如下:
①初始阶段,Cu被氧化的反应速率:实验 Ⅰ________(填“>”“<”或“=”)实验 Ⅱ。
②实验Ⅲ所得溶液中,被氧化的铜元素的可能存在形式有[Cu(H2O)4]2+(蓝色)或[CuI2]-(无色),进行以下实验探究:
步骤a.取实验Ⅲ的深红棕色溶液,加入CCl4,多次萃取、分液。
步骤b.取分液后的无色水溶液,滴入浓氨水。溶液颜色变浅蓝色,并逐渐变深。
ⅰ.步骤a的目的是______________________________________________________________。
ⅱ.查阅资料,2Cu2++4I-===2CuI↓+I2,[Cu(NH3)2]+(无色)容易被空气氧化。用离子方程式解释步骤b的溶液中发生的变化:________________________________________________
______________________________________________________________________________
______________________________________________________________________________。
③结合实验Ⅲ,推测实验Ⅰ和Ⅱ中的白色沉淀可能是CuI,实验Ⅰ中铜被氧化的化学方程式是____________________________________________________________________________。
分别取实验Ⅰ和Ⅱ充分反应后的固体,洗涤后得到白色沉淀,加入浓KI溶液,________________________________(填实验现象),观察到少量红色的铜。分析铜未完全反应的原因是____________________________________________________________________。
(2)上述实验结果,I2仅将Cu氧化为+1价。在隔绝空气的条件下进行电化学实验,证实了I2能将Cu氧化为Cu2+。装置如图所示,a、b分别是____________________________________
______________________________________________________________________________。
(3)运用氧化还原反应规律,分析在上述实验中Cu被I2氧化的产物中价态不同的原因:______________________________________________________________________________
______________________________________________________________________________
______________________________________________________________________________。
2.某化学小组实验探究SO2与AgNO3溶液的反应。
实验一:用如图装置制备SO2,并将足量SO2通入AgNO3溶液中,迅速反应,得到无色溶液A和白色沉淀B(省略夹持、加热仪器)。
(1)制备的SO2中会混有少量的SO3,原因可能为____________________________________。
为了排除SO3的干扰,试剂a可以为________(填字母)。
a.浓硫酸
b.饱和Na2SO3溶液
c.饱和NaHS溶液
d.饱和NaHSO3溶液
实验二:验证白色沉淀B的成分。
分析:沉淀B可能为Ag2SO3、Ag2SO4或两者混合物。滴加氨水可释出其阴离子,便于后续检验。
相关反应为①Ag2SO3+4NH3·H2O===2[Ag(NH3)2]++SOeq \\al(2-,3)+4H2O;
②Ag2SO4+4NH3·H2O===2[Ag(NH3)2]++SOeq \\al(2-,4)+4H2O。
流程如下:
(2)欲检验溶液C中加入的Ba(NO3)2是否已经过量,请简述实验方法:_________________
______________________________________________________________________________。
(3)沉淀D中主要含BaSO3,理由是_______________________________________________
______________________________________________________________________________。
向滤液E中加入H2O2溶液,产生的现象是________________________________________
______________________________________________________________________________,
可进一步证实B中含Ag2SO3。
实验三:探究SOeq \\al(2-,4)的产生途径。
猜想1:实验一中,SO2在AgNO3溶液中被氧化生成Ag2SO4,随沉淀B进入D。
猜想2:实验二中,SOeq \\al(2-,3)被氧化为SOeq \\al(2-,4)进入D。
(4)取少量溶液A,滴加过量盐酸,产生白色沉淀。静置后,取上层清液再滴加BaCl2溶液,未出现白色沉淀,可判断猜想1不合理。理由是____________________________________
______________________________________________________________________________。
(5)不同反应的速率也有所不同。将实验一所得混合物放置一段时间,也会有SOeq \\al(2-,4)生成,同时生成单质Ag。请从化学反应速率的角度分析原因:_______________________________
______________________________________________________________________________。
(6)实验探究可知,SOeq \\al(2-,3)在________(填“酸性”“中性”或“碱性”)溶液中更易被氧化为SOeq \\al(2-,4)。
反应机理类探究性实验解题流程
操作
目的或原因
沉淀水洗
除去××(可溶于水)杂质
沉淀用乙醇洗涤
a.减小固体的溶解度;b.除去固体表面吸附的杂质;c.乙醇挥发带走水分,使固体快速干燥
冷凝回流
防止××蒸气逸出脱离反应体系;提高××物质的转化率
控制溶液pH
防止××离子水解;防止××离子沉淀;确保××离子沉淀完全;防止××溶解等
“趁热过滤”后,有时先向滤液中加入少量水,加热至沸腾,然后再“冷却结晶”
稀释溶液,防止降温过程中杂质析出,提高产品的纯度
加过量A试剂
使B物质反应完全(或提高B物质的转化率等)
温度不高于××℃
温度过高××物质分解(如H2O2、浓硝酸、NH4HCO3等)或××物质挥发(如浓硝酸、浓盐酸)或××物质氧化(如Na2SO3等)或促进××物质水解(如AlCl3等)
减压蒸馏(减压蒸发)
减小压强,使液体沸点降低,防止××物质受热分解(如H2O2、浓硝酸、NH4HCO3等)
蒸发、反应时的气体氛围
抑制××离子的水解(如加热蒸发AlCl3溶液时需在HCl气流中进行,加热MgCl2·6H2O制MgCl2时需在HCl气流中进行等)
配制某溶液前先煮沸水
除去溶解在水中的氧气,防止××物质被氧化
反应容器中用玻璃管和大气相通
指示容器中压强大小,避免反应容器中压强过大
实验编号
V/mL
t/s
NaNO2溶液
NH4Cl溶液
醋酸
水
1
4.0
V1
4.0
8.0
334
2
V2
4.0
4.0
V3
150
3
8.0
4.0
4.0
4.0
83
4
12.0
4.0
4.0
0.0
38
实验
实验操作及现象
Ⅰ
取少量CuI放入试管中,加入KI溶液,白色固体溶解得到无色溶液;加水,又生成白色沉淀
Ⅱ
取少量CuI放入试管中,加入NaOH溶液,振荡,产生砖红色沉淀。过滤,向所得上层清液中滴加淀粉溶液,无明显变化;将砖红色沉淀溶于稀硫酸,产生红色固体和蓝色溶液
第一类
常见的熟悉物质
要注意物质的特殊性质,比如颜色、状态、气味、溶解性等物理性质,或能与哪些物质反应生成特殊的沉淀、气体等化学性质
第二类
能类比迁移的陌生物质
虽然平时接触不多,但其某种组成成分、结构成分(如离子、原子团、官能团等)必然学过,则可以考虑与其结构相似的物质的性质,进而推断其具体组成
取样
要取“少许最后一次”洗涤液
试剂
选择合理的试剂
现象
须有明显的现象描述
结论
根据现象得出结论
答题要素
明确实验目的:做什么
明确操作目的:为什么这样做
明确结论:这样做会有什么结果?理由是什么
得分点及关键词
操作:怎么“做”,为什么这样“做”
作用:须有明确的结论、判断、理由
答题要素
现象描述要全面:看到的、听到的、触摸到的、闻到的
现象描述要准确:如A试管中……B处有……
按“现象+结论”格式描述,忌现象结论不分、由理论推现象、指出具体生成物的名称
得分点及关键词
溶液中:颜色由……变成……,液面上升或下降(形成液面差),溶液变浑浊,生成(产生)……沉淀,溶液发生倒吸,产生大量气泡(或有气体从溶液中逸出),有液体溢出等
固体:表面产生大量气泡,逐渐溶解,体积逐渐变小,颜色由……变成……等
气体:生成……色(味)气体,气体由……色变成……色,先变……后……(加深、变浅、褪色)等
答题要素
试剂的作用是什么?要达到的目的是什么
得分点及关键词
作用类:“除去”“防止”“抑制”“使……”等,回答要准确
作用—目的类:“作用”是“……”,“目的”是“……”,回答要准确全面
c(KI)
实验现象
实验 Ⅰ
0.01 ml·L-1
极少量I2溶解,溶液为淡红色;充分反应后,红色的铜粉转化为白色沉淀,溶液仍为淡红色
实验 Ⅱ
0.1 ml·L-1
部分I2溶解,溶液为红棕色;充分反应后,红色的铜粉转化为白色沉淀,溶液仍为红棕色
实验 Ⅲ
4 ml·L-1
I2完全溶解,溶液为深红棕色;充分反应后,红色的铜粉完全溶解,溶液为深红棕色
人教版高考化学一轮复习讲义第16章第72讲 以物质制备为主的综合实验(2份打包,原卷版+教师版): 这是一份人教版高考化学一轮复习讲义第16章第72讲 以物质制备为主的综合实验(2份打包,原卷版+教师版),文件包含人教版高考化学一轮复习讲义第16章第72讲以物质制备为主的综合实验原卷版doc、人教版高考化学一轮复习讲义第16章第72讲以物质制备为主的综合实验教师版doc等2份试卷配套教学资源,其中试卷共28页, 欢迎下载使用。
人教版高考化学一轮复习讲义第16章第71讲 简单实验方案的设计与评价(2份打包,原卷版+教师版): 这是一份人教版高考化学一轮复习讲义第16章第71讲 简单实验方案的设计与评价(2份打包,原卷版+教师版),文件包含人教版高考化学一轮复习讲义第16章第71讲简单实验方案的设计与评价原卷版doc、人教版高考化学一轮复习讲义第16章第71讲简单实验方案的设计与评价教师版doc等2份试卷配套教学资源,其中试卷共16页, 欢迎下载使用。
人教版高考化学一轮复习讲义第15章第70讲 有机合成与推断综合突破(2份打包,原卷版+教师版): 这是一份人教版高考化学一轮复习讲义第15章第70讲 有机合成与推断综合突破(2份打包,原卷版+教师版),文件包含人教版高考化学一轮复习讲义第15章第70讲有机合成与推断综合突破原卷版doc、人教版高考化学一轮复习讲义第15章第70讲有机合成与推断综合突破教师版doc等2份试卷配套教学资源,其中试卷共26页, 欢迎下载使用。












