



高中化学第3节 离子键、配位键与金属键精品课件ppt
展开meiyangyang8602
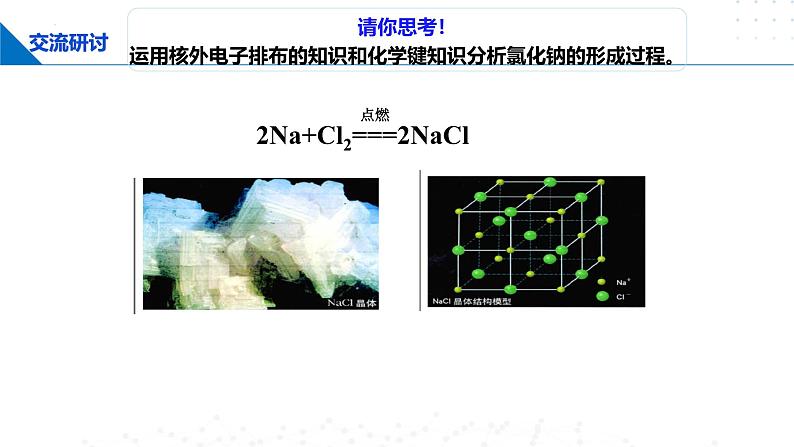
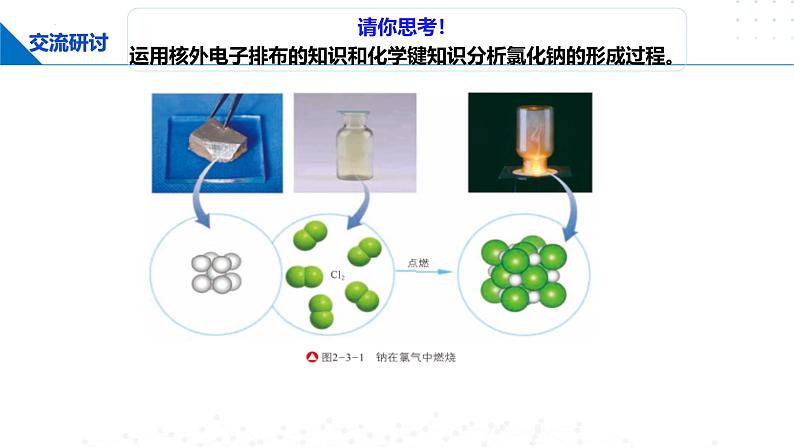
请你思考! 运用核外电子排布的知识和化学键知识分析氯化钠的形成过程。
第二章 微粒间相互作用与物质性质
第 3 节 离子键、配位键与金属键
课时1 离子键、金属键
离子键、配位键、金属键以及本章前两节所学的共价键共同构成了化学键(原子之间的强相互作用)的完整知识体系离子键和金属键决定着离子化合物和金属的成键方式并影响物质的性质,而配合物在生命科学、材料科学以及催化合成等方面有着重要的意义。因此,学习以上三种化学键的成键实质、成键特征,对全面了解微观原子的相互作用、了解化学学科在高科技领域的广泛应用大有益处。教材在认识共价键的基础上,从成键过程和成键特征(方向性和饱和性)上采用对比方式介绍离子键的内容;在共价键的基础上,从共用电子对不同形成方式的角度简单介绍配位键的形成和配合物的意义;通过金属的特征性质引出金属键并学以致用,解释金属的特性。
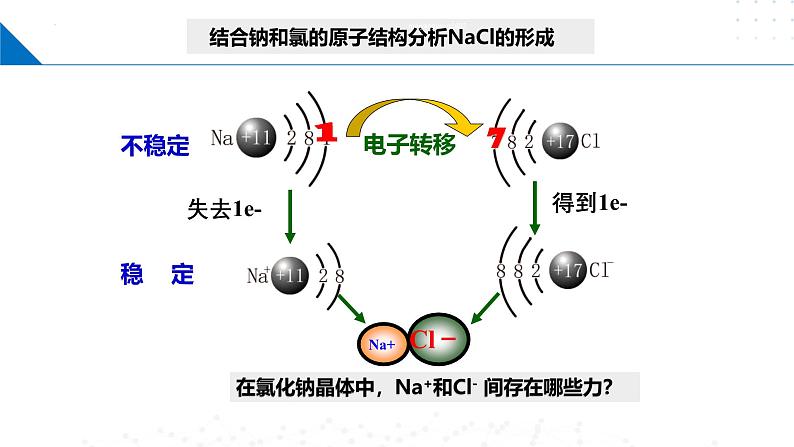
在氯化钠晶体中,Na+和Cl- 间存在哪些力?
在氯化钠晶体中的作用力
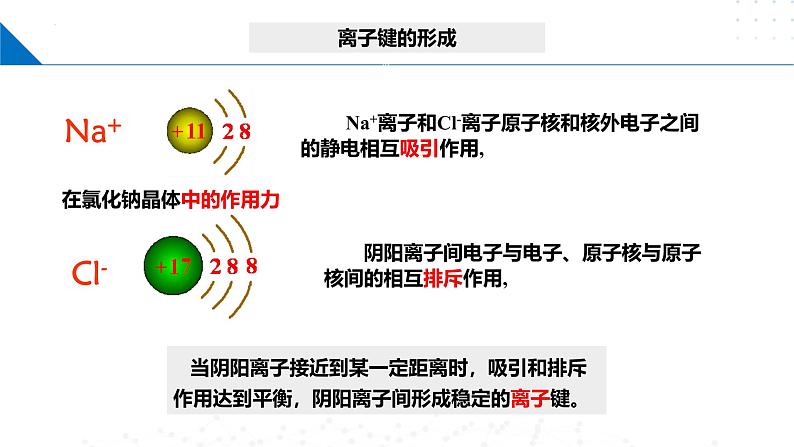
Na+离子和Cl-离子原子核和核外电子之间的静电相互吸引作用,
阴阳离子间电子与电子、原子核与原子核间的相互排斥作用,
当阴阳离子接近到某一定距离时,吸引和排斥作用达到平衡,阴阳离子间形成稳定的离子键。
Na+和Cl-(带异性电荷)间的相互吸引作用
电子与电子、原子核与原子核间(带同性电荷)的相互排斥作用
1. 概念:阴、阳离子通过静电作用而形成的化学键叫做离子键。2. 成键粒子:阴、阳离子。3. 成键本质:阴、阳离子之间的相互作用(静电吸引和静电排斥)。4. 成键原因: ①原子相互得失电子形成稳定的阴阳离子; ②离子间吸引与排斥处于平衡状态; ③体系的总能量降低。
请你思考! 请尝试判断下列哪些原子之间可以形成离子键,并说明你的判断依据。
Cs Mg K H F Cl S O
原子得失电子的能力可以用电负性表示,以上元素的电负性数据如下: Cs 0.7 Mg 1.2 K 0.8 H 2.0 F 4.0 Cl 3.0 S 2.5 O 3.5根据以上数据验证你的结论是否符合?
一般而言,电负性较大的非金属元素的原子容易获得电子形成阴离子,电负性较小的金属元素的原子容易失去价电子形成阳离子。
当成键原子所属元素的电负性的差值大于1.7时,原子间可以形成离子键。
一种离子可以对不同方向的带异性电荷离子产生吸引作用。
1个氯离子同时受6个钠离子共同吸引
1个钠离子同时受6氯离子个共同吸引
1个氯离子同时吸引6个钠离子;1个钠离子同时吸引6个氯离子
每个Cs+同时吸引8个 Cl-,每个Cl-同时吸引8个Cs+。
在离子化合物中,每个离子周围最邻近的带异性电荷的离子数目的多少,取决于阴、阳离子的相对大小。只要空间条件允许,阳离子将吸引尽可能多的阴离子排列在其周围,阴离子也将吸引尽可能多的阳离子排列在其周围。
离子半径比值的不同,使得离子周围所能容纳的带异性电荷离子的数目不同。
离子键没有方向性和饱和性,因此在以离子键相结合的化合物所形成的晶体中,每个离子周围尽可能多地排列带异性电荷的离子,这种情况下体系能量更低。
请你思考! 为什么从 AgCl到 Agl,实测键长与离子半径之和的差距在逐渐增大,难溶性随之增加?这些变化的本质原因是什么?
从表面上看,卤化银是由带正电荷的Ag+和带负电荷的X-通过离子键结合形成的,应当是离子化合物,但实际上并非如此
这是因为,基本上呈球形对称的离子本身所带有的电荷会形成一个电场
在相互的电场作用下,阴、阳离子中的电子分布会发生相对偏移。这种在电场的作用下产生的离子中电子分布发生偏移的现象称为离子极化。
离子极化可能导致阴、阳离子的外层轨道发生重叠,从而使得许多离子键不同程度地显示共价性,继而导致键长缩短、键能增加,甚至出现键型变异。
对于卤素阴离子而言,从F-到I-半径增大,在具有较强极化能力的Ag+的极化下,AgX的键型由离子键(AgF)向共价键过渡,AgI已成为以共价键为主的结构,因而从AgF到AgI,卤化物的性质发生了一定的变化。
请你思考! 回忆所学知识,列举金属的通性有哪些?
金属光泽、导电性、导热性、延展性 等
金属为什么具有这些共同性质呢?
请你思考! 为什么金属元素的原子之间会产生如此强的相互作用?这种相互作用的实质是什么?
通过实验测知,将1 ml Cu、1 ml Fe、1ml W转变成气态原子,需吸收的能量分别为 306.7 kJ、340.2 kJ和 824.0 kJ,因此金属铜、金属铁、金属钨的熔点分别高达1083℃、1 538℃和3 422 C。这说明由金属元素的原子构成的金属单质内存在一种强烈的相互作用。
金属元素的电负性和电离能较小,金属原子的价电子容易脱离原子核的束缚。在固态金属中,金属原子失去的电子在所形成的金属阳离子之间“自由”运动,成为“自由电子”。正是由于在整块固态金属中不停运动的“自由电子”与金属阳离子之间的相互作用,使得体系的能量大大降低。
这种“自由电子”和金属阳离子之间的强的相互作用,叫作金属键(metallic bnd)
电子在整个三维空间运动,属于整块固态金属,被所有原子所共用,从而把所有的原子维系在一起。
金属阳离子和自由电子之间的强烈的相互作用。
金属阳离子和自由电子。
电性作用——特殊形式的共价键
(1)无方向性和饱和性
(2)电子在整个三维空间运动,属于整块固态金属
金属键可以看成是由许多个原子共用许多个电子形成的,所以有人将金属键视为一种特殊形式的共价键。
请你思考!金属不透明,但具有金属光泽的原因是什么?
因为固态金属中有“自由电子”,所以当可见光照射到金属表面上时,“自由电子”能够吸收所有频率的光并迅速释放,使得金属不透明并具有金属光泽。
请你思考!金属为什么易导电?
当把金属导线分别接到电源的正、负极时,有了电势差,“自由电子”就能沿着导线由电源的负极向电源的正极流动而形成电流,使金属表现出导电性。
请你思考!金属为什么易导热?
当金属中存在温度差时,不停运动着的“自由电子”通过自身与金属阳离子之间的碰撞,将能量由高温处传向低温处,使金属表现出导热性。
请你思考! 金属为什么具有较好的延展性?
由于金属离子与自由电子间的相互作用没有方向性,各原子层之间发生相对滑动以后,仍可保持这种相互作用,因而即使在外力作用下,发生形变也不易断裂。
在金属中,金属原子或离子在空间是按照一定的规律周期性重复排列的。金属中的电子与金属离子的相互作用是与金属原子的排列密切相关的,而且电子之间也存在着相互作用。因此,金属中的"自由电子"会受到各种束缚,实际上不可能在金属中"完全自由"运动。
近代建立的分子轨道理论认为,金属中的 N个原子的每一种能量相同的原子轨道通过组合形成 N个属于整个金属的分子轨道。由于N值很大,这N个分子轨道形成一个能带。
金属钠的 1s、2s、 2p、3s轨道各自形成一个能带,每个能带中所填充的电子在整个金属中运动;各个能带按能量高低顺序排列起来构成能带结构。
充满电子的能带称为满带
部分填充电子的能带称为导带
没有填充电子的能带称为空带
各能带之间的间隔不能填充电子而称为禁带
能带理论能很好地解释金属的性能,成为研究金属结构的主要工具。
例如,导体的特征是具有导带;绝缘体的特征是只有满带和空带,而且禁带很宽;半导体也只有满带和空带,但禁带窄,当受到光或热的激发时,满带中的部分电子可以跃迁到空带中从而导电。另一方面,半导体掺杂后,由于外层能带结构的变化而成为导体。例如,纯硅晶体通常不导电,但是掺杂后可以分别成为n型半导体和p型半导体。
1、下列说法正确的是( )A.含有金属元素的化合物一定是离子化合物B.第IA族和第VIIA族原子化合时,一定形成离子键C.由非金属元素形成的化合物一定不是离子化合物D.活泼金属与非金属化合时,能形成离子键
2. 下列物质中属于离子化合物的是 ( ) A.硝酸 B.氨气 C.氯化铵 D.氯化氢 3. 下列物质中,含有离子键的是( )A.HCl B.H2O2 C.K2O D.H2SO4
4、具有下列选项中电负性数值的两种元素的原子,最容易形成离子键的是( ) A.4.0和1.0 B.3.5和1.0 C.1.8和2.5 D.4.0和0.8
5.一般认为,如果两个成键元素的电负性相差大于1.7,它们通常形成离子键;如果两个成键元素的电负性相差小于1.7,它们通常形成共价键。查阅下列元素的电负性数值,判断下列化合物:①NaF ②AlCl3 ③NO ④MgO ⑤BeCl2 ⑥CO2(1)属于共价化合物的是_________。(2)属于离子化合物的是______。
6.下列有关金属键和金属性质的说法中,错误的是( )。A. 金属键没有饱和性和方向性B. 金属键是金属阳离子和自由电子之间存在的强烈的相互作用C. 自由电子吸收可见光后又迅速释放,使金属具有不透明性和金属光泽D. 金属的导热性和导电性都是通过自由电子的定向运动实现的
鲁科版 (2019)选择性必修2第3节 离子键、配位键与金属键优质ppt课件: 这是一份鲁科版 (2019)选择性必修2<a href="/hx/tb_c4002603_t3/?tag_id=26" target="_blank">第3节 离子键、配位键与金属键优质ppt课件</a>,共37页。PPT课件主要包含了教材分析,离子键,Na+,Cl-,金属键等内容,欢迎下载使用。
高中鲁科版 (2019)第2章 微粒间相互作用与物质性质第3节 离子键、配位键与金属键多媒体教学课件ppt: 这是一份高中鲁科版 (2019)<a href="/hx/tb_c4002603_t3/?tag_id=26" target="_blank">第2章 微粒间相互作用与物质性质第3节 离子键、配位键与金属键多媒体教学课件ppt</a>,共36页。PPT课件主要包含了教材分析,Cl-,离子键,Na+,Cl-,金属键等内容,欢迎下载使用。
化学选择性必修2第3节 离子键、配位键与金属键教课ppt课件: 这是一份化学选择性必修2<a href="/hx/tb_c4002603_t3/?tag_id=26" target="_blank">第3节 离子键、配位键与金属键教课ppt课件</a>,共40页。PPT课件主要包含了知识点一配位键,知识点二金属键,自由电子,金属阳离子等内容,欢迎下载使用。













