





新高考化学一轮复习课件第4章 第15讲 铁及其氧化物和氢氧化物(含解析)
展开1.掌握铁的主要性质及应用。2.知道不同价态的铁的氧化物的主要性质和用途。3.掌握Fe(OH)2、Fe(OH)3的性质及Fe(OH)2的制备方法。
考点一 铁及其氧化物
考点二 铁的氢氧化物
真题演练 明确考向
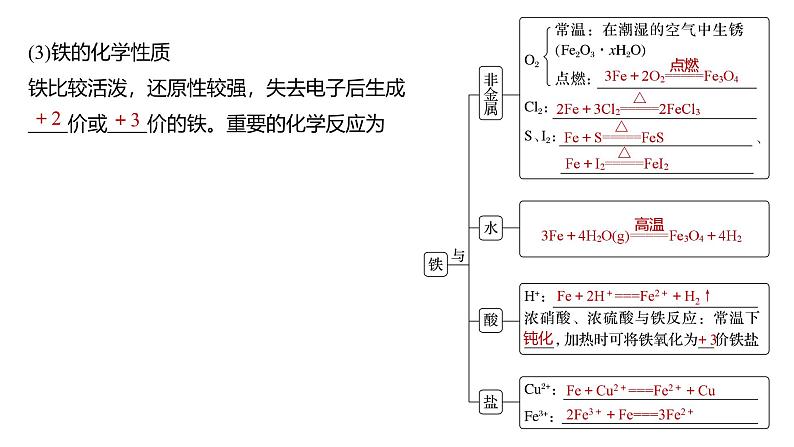
1.铁单质(1)铁的物理性质 色固体,熔点较高,具有良好的导热、导电、延展性,能被 吸引。(2)铁的原子结构Fe的价层电子排布式为 ,铁位于元素周期表的第 周期第 族,是应用最广泛的过渡金属元素,其原子结构示意图: 。
(3)铁的化学性质铁比较活泼,还原性较强,失去电子后生成 价或 价的铁。重要的化学反应为
Fe+2H+===Fe2++H2↑
Fe+Cu2+===Fe2++Cu
2Fe3++Fe===3Fe2+
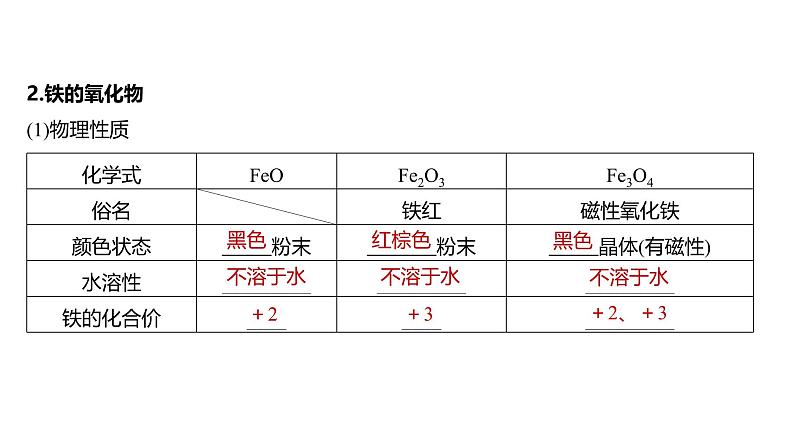
2.铁的氧化物(1)物理性质
(2)化学性质①FeO、Fe2O3都属于碱性氧化物,能溶于强酸,分别写出它们溶于盐酸的离子方程式: 。②铁的氧化物还能被CO、Al还原,以氧化铁为例写出化学方程式:_____________ , 。③分别写出Fe3O4溶于足量稀硝酸、氢碘酸(HI)的离子方程式:________________ 、 。
FeO+2H+===Fe2++H2O,Fe2O3+6H+===2Fe3++3H2O
3Fe3O4+28H++
Fe3O4+8H++2I-===3Fe2++I2+4H2O
1.铁的化学性质比较活泼,所以铁在自然界中全部以化合态形式存在( )2.Fe分别与Cl2和盐酸反应所得氯化物相同( )3.常温下可用铁制容器储存、运输浓硝酸、浓硫酸( )4.铁在纯氧中燃烧或高温下和水蒸气反应均能得到Fe3O4( )
一、铁及其氧化物的性质与应用1.下列叙述正确的是A.Fe与I2反应生成FeI3B.硫酸铜溶液中加入少量铁粉反应的离子方程式:3Cu2++2Fe===2Fe3++3CuC.5.6 g Fe与足量的S反应转移的电子数为0.3NAD.高温下水蒸气与Fe反应,固体的质量增加
Fe与I2反应生成FeI2,A错误;正确的离子方程式:Cu2++Fe===Fe2++Cu,B错误;
Fe变为Fe3O4,固体质量增加,D正确。
2.化学让生活更美好。下列说法不正确的是A.钢铁使用要尽可能减少钢铁的氧化损耗,Fe2O3是一种碱性氧化物B.常温下,铁的氧化物都不溶于水,也不与水反应C.故宫是中国最大的古代文化艺术博物馆,氧化铁可作故宫红色外墙的涂料D.氧化亚铁在空气中加热会被迅速氧化成三氧化二铁
氧化亚铁在空气中加热会被迅速氧化成四氧化三铁,故D错误。
3.铁与水蒸气反应实验改进前后的装置如图所示:
下列说法错误的是A.将湿棉花改为浸水的尿不湿,酒精灯由单头改为双头,可提供足量的水蒸气B.用具支试管可将试管口附近冷凝的水导出,避免冷凝水与灼热铁粉接触C.肥皂液改为吹泡泡水,收集H2效果更好,点燃效果更明显D.悬挂的磁铁仅能吸引铁粉,不能吸引反应产物
铁与水蒸气在高温下反应生成四氧化三铁和氢气,铁、四氧化三铁均可被磁铁吸引,故D错误。
二、铁与酸反应的定量分析4.向含有1 ml HNO3和1 ml H2SO4的混合溶液中逐渐加入铁粉至过量,溶液中金属阳离子a、b与所加铁粉的物质的量的关系如图所示(已知稀硝酸的还原产物只有NO)。下列有关判断不正确的是A.a表示Fe3+的关系曲线B.n1=0.75C.P点时,n(Fe2+)=0.562 5 mlD.向P点溶液中加入铜粉,最多可溶解14.4 g
该反应可以看做两步:①Fe+4H++ ===Fe3++NO↑+2H2O,硝酸根离子过量,氢离子不足;②2Fe3++Fe===3Fe2+。a表示Fe3+的关系曲线,A正确;
溶液中共有3 ml H+参加反应,消耗0.75 ml铁,B正确;P点n(Fe2+)=n(Fe3+),两者均为0.45 ml,C不正确;P点剩余0.45 ml Fe3+,消耗0.225 ml铜,质量为14.4 g,D正确。
三、铁的氧化物组成分析5.准确称取某种铁的氧化物2.88 g,用足量的CO进行还原,将生成的CO2全部用足量的澄清石灰水吸收,得到沉淀4.00 g,计算该氧化物的化学式:______。
4.00 g CaCO3沉淀的物质的量为0.04 ml,则CO、CO2的物质的量均为0.04 ml,增加的氧元素为0.04 ml,质量为0.04 ml×16 g·ml-1=0.64 g,铁的氧化物中氧元素的质量为0.64 g,铁元素的质量为2.88 g-0.64 g=2.24 g,铁的氧化物中铁元素与氧元素的物质的量之比为 ∶0.04 ml=1∶1,则这种铁的氧化物的化学式为FeO。
6.(2022·丽江质检)有一块铁的“氧化物”样品,用140 mL 5.0 ml·L-1盐酸恰好将之完全溶解,所得溶液还能吸收0.025 ml Cl2,恰好使其中的Fe2+全部转变为Fe3+,则该样品的化学式可能为_______。
根据2Fe2++Cl2===2Fe3++2Cl-,可知铁的“氧化物”样品用盐酸溶解后所得溶液中n(Fe2+)=0.025 ml×2=0.05 ml,根据电荷守恒得2n(Fe2+)+3n(Fe3+)=n(Cl-)=0.14 L×5 ml·L-1=0.7 ml,则n(Fe3+)=0.2 ml,故n(Fe2+)∶n(Fe3+)=0.05 ml∶0.2 ml=1∶4,故该氧化物可表示为FeO·2Fe2O3,即Fe5O7。
确定铁的氧化物组成的基本方法
设铁的氧化物中铁元素与氧元素的质量比为m∶n,则氧化物中n(Fe)∶n(O)= =a∶b,若a∶b=1∶1,则铁的氧化物为FeO;若a∶b=2∶3,则铁的氧化物为Fe2O3;若a∶b=3∶4,则铁的氧化物是Fe3O4或FeO与Fe2O3按物质的量之比为1∶1组成的混合物或FeO、Fe2O3、Fe3O4的混合物(其中FeO、Fe2O3的物质的量之比为1∶1,Fe3O4的物质的量为任意值)。
1.氢氧化铁和氢氧化亚铁的比较
Fe(OH)2+2H+===Fe2++2H2O
Fe(OH)3+3H+===Fe3++3H2O
Fe2++2OH-===Fe(OH)2↓
3OH-===Fe(OH)3↓
絮状沉淀迅速变成灰绿色
4Fe(OH)2+O2+2H2O===4Fe(OH)3
2.Fe(OH)2的制备(1)制备原理①制备原理:Fe2++2OH-===Fe(OH)2↓。②成功关键:溶液中不含O2等氧化性物质;制备过程中,保证生成的Fe(OH)2在密闭、隔绝空气的体系中。(2)常用方法
空气与Fe(OH)2接触
1.在空气中,白色的Fe(OH)2迅速转变成灰绿色,最终变成红褐色( )2.FeCl3溶液滴入热的浓NaOH溶液中可得到Fe(OH)3胶体( )3.Fe(OH)2与HNO3发生反应的离子方程式为Fe(OH)2+2H+===Fe2++2H2O( )4.Fe(OH)3与氢碘酸反应生成FeI3( )5.Fe(OH)3呈红褐色、透明,能产生丁达尔效应( )6.Fe(OH)3在空气中加热分解生成Fe2O3,则Fe(OH)2在空气中加热分解生成FeO( )7.制备氢氧化亚铁时,向硫酸亚铁溶液中滴加氢氧化钠溶液,边加边搅拌,即可制得白色的氢氧化亚铁( )
氢氧化亚铁制备实验探究1.用FeSO4溶液与不含O2的蒸馏水配制的NaOH溶液反应制备Fe(OH)2。(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需要加入_______________。
Fe2+易水解,要加入稀H2SO4防止其水解;Fe2+易被空气中的O2氧化,要加铁粉,将被氧化生成的Fe3+还原成Fe2+。
(2)除去蒸馏水中溶解的O2常采用______的方法。
气体的溶解度是随温度升高而降低的,所以煮沸后的蒸馏水中溶解的O2变少。
(3)生成Fe(OH)2白色沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液,这样操作的理由是_________________________________________。
避免生成的Fe(OH)2沉淀
2.下列各图示中能较长时间看到Fe(OH)2白色沉淀的是________(填序号)。
①②原理一样,都是先用氢气将装置中的空气排尽,并使生成的Fe(OH)2处在氢气的保护中;④中液面加苯阻止了空气进入;③由于带入空气中的氧气,能迅速将 Fe(OH)2氧化,因而不能较长时间看到白色沉淀。
3.用如图所示装置(夹持仪器省略)制备氢氧化亚铁。
实验步骤如下:Ⅰ.检查装置气密性后,关闭K2、K5、K6,打开K1、K3、K4,使装置A中产生的气体进入装置B中,排尽装置B中空气。Ⅱ.待装置B中空气排尽后,关闭K3,打开K2,将装置A中溶液压入装置B中并观察现象。Ⅲ.关闭K1、K2,打开K5、K6,使装置C中气体通入装置B中并观察现象。
回答下列问题:(1)仪器a的名称是______________,B中长玻璃管的作用是___________________________________。(2)装置A中金属离子的检验方法是______
____________________________________________________________________________________________________________。(3)步骤Ⅲ 装置B中的现象是________________________________________,其发生反应的化学方程式为_______________________________。
量装置A烧瓶中的液体于洁净试管中,滴加几滴KSCN溶液,无红色出现,再滴加H2O2,溶液变为红色,则证明存在Fe2+
白色沉淀逐渐变为灰绿色,最后变为红褐色
氢氧化亚铁容易被氧气氧化,因此打开K1、K3、K4,关闭K2、K5、K6,装置A中产生H2,排出装置B中的空气,因此长导管作用之一是辅助排出装置B中的空气,作用之二是平衡压强,防止装置中压强过大,发生危险。
4.利用电解实验可以制得纯净的Fe(OH)2白色沉淀,如图所示,已知两电极的材料分别为石墨和铁。(1)a电极的材料应为____,电极反应式为________________。(2)电解液c可以是______(填字母)。A.纯水 B.NaCl溶液C.NaOH溶液 D.CuCl2溶液
Fe-2e-===Fe2+
(3)d为苯,其作用是___________________________________,在加入苯之前对电解液c应作何简单处理?________________________。(4)若c用Na2SO4溶液,当电解一段时间后看到白色Fe(OH)2沉淀,再反接电源电解,除了电极上看到气泡外,另一明显现象为________________________________________。
隔绝空气,防止生成的Fe(OH)2被氧化
加热煮沸,排出溶解的O2
白色沉淀迅速变为灰绿色,最后变成红褐色
1.下列叙述不正确的是A.浓硝酸与铁在常温下不反应,所以可用铁质容器贮运浓硝酸(2022·浙江6月选考,9C)B.工人将模具干燥后再注入熔融钢水,是因为铁与H2O高温下会反应(2022·广东,6C)C.将废铁屑加入FeCl2溶液中,可用于除去工业废气中的Cl2(2019·天津,3A)D.铁锈的主要成分可表示为Fe2O3·nH2O(2020·浙江1月选考,9B)
2.下列关于铁及其化合物的说法正确的是A.FeS2在沸腾炉中与O2反应主要生成SO3(2020·浙江7月选考,12C)B.Mg加入到过量FeCl3溶液中可得Fe(2020·浙江7月选考,12B)C.钢铁在潮湿空气中生锈主要是发生了电化学腐蚀(2020·浙江7月选考,8D)D.室温下,Fe与浓H2SO4反应生成FeSO4(2020·江苏,6D)
Mg加入到FeCl3溶液中,Mg具有较强的还原性,先与Fe3+反应,生成Mg2+和Fe2+,若Mg过量,Mg与Fe2+继续反应生成Mg2+和Fe,但由于反应中FeCl3过量,所以不会生成Fe,故B错误;钢铁在潮湿的空气中,铁和碳、水膜形成原电池,发生电化学腐蚀,腐蚀速率更快,故C正确;室温下,铁在浓硫酸中发生钝化,故D错误。
1.我国清代《本草纲目拾遗》中叙述了“铁线粉”:“粤中洋行有舶上铁丝,……日久起销,用刀刮其销,……,所刮下之销末,名铁线粉”。这里的“铁线粉”是指A.Fe D.Fe2O3
2.用铁制备较纯净的氧化铁,下列实验方案最好的是A.使铁在潮湿的空气中缓慢氧化B.铁在氯气中燃烧,加水溶解,加入足量NaOH溶液,过滤、洗涤,然后充分加热 分解C.使铁溶解于稀硫酸,然后加入足量NaOH溶液,过滤、洗涤,然后充分加热分解D.使铁与足量稀硝酸反应,然后加入足量NaOH溶液,过滤、洗涤,然后充分加热 分解
铁在潮湿的空气中缓慢氧化最终生成铁锈,铁锈的主要成分为氧化铁水合物,A错误;铁在氯气中燃烧生成氯化铁,加水溶解,加入足量NaOH溶液,反应生成氢氧化铁沉淀,过滤、洗涤,然后充分加热,氢氧化铁分解生成氧化铁,B正确;铁和稀硫酸反应生成硫酸亚铁,硫酸亚铁和氢氧化钠反应生成氢氧化亚铁,氢氧化亚铁在空气中加热部分被氧化生成氢氧化铁,所以分解产物可能为氧化铁和氧化亚铁的混合物,C错误;铁和硝酸反应生成有害气体,污染环境,不属于最佳方案,D错误。
3.下列关于氧化铁、氧化亚铁、四氧化三铁三种氧化物的说法不正确的是A.铁元素的化合价不完全相同B.氧元素的化合价完全相同C.氧化亚铁俗称铁红,为红棕色固体D.铁在氧气中燃烧的产物为黑色固体
铁的三种氧化物中,氧元素的化合价都为-2价;铁元素的化合价不同,氧化铁中铁为+3价,氧化亚铁中铁为+2价,四氧化三铁中铁为+2价和+3价;氧化铁俗称铁红,是一种红棕色粉末;铁在氧气中燃烧生成四氧化三铁,是一种黑色固体。
4.在100 mL 1.00 ml·L-1 H2SO4溶液中加入足量铁屑,生成的气体在标准状况下的体积为A.11.2 L L L L
在100 mL 1.00 ml·L-1 H2SO4溶液中加入足量铁屑,反应中H2SO4完全反应,则生成的H2完全来自于H2SO4,100 mL 1.00 ml·L-1 H2SO4溶液中n(H2SO4)=n(H2)=0.1 L×1.00 ml·L-1=0.1 ml,则生成的气体在标准状况下的体积为0.1 ml×22.4 L·ml-1=2.24 L,D项正确。
5.某同学设计的制备氯化铁溶液的方案中,分别采用下列物品,其中能实现的是A.氢氧化铁和硫酸 B.铁和盐酸C.氧化亚铁和盐酸 D.氧化铁和盐酸
氢氧化铁和硫酸反应生成硫酸铁和水,A项错误;铁和盐酸反应生成氯化亚铁和氢气,B项错误;氧化亚铁和盐酸反应生成氯化亚铁和水,C项错误;氧化铁和盐酸反应生成氯化铁和水,可以制备氯化铁溶液,D项正确。
6.实验过程中不可能产生 Fe(OH)3 的是A.蒸发 FeCl3 溶液B.FeCl3 溶液中滴入氨水C.将水蒸气通过灼热的铁D.FeCl2 溶液中滴入 NaOH 溶液
蒸发 FeCl3 溶液,铁离子水解生成氢氧化铁,故A不符合题意;FeCl3 溶液中滴入氨水生成氢氧化铁和氯化铵,故B不符合题意;将水蒸气通过灼热的铁生成四氧化三铁和氢气,故C符合题意;FeCl2 溶液中滴入NaOH溶液生成氢氧化亚铁和氯化钠,氢氧化亚铁遇到氧气被氧化成氢氧化铁,故D不符合题意。
7.用饱和氯化铁溶液制取氢氧化铁胶体,正确的操作是A.将饱和氯化铁溶液滴入蒸馏水中即可B.将饱和氯化铁溶液滴入热水中,至溶液呈深黄色C.将饱和氯化铁溶液滴入沸水中,继续煮沸至溶液呈红褐色D.将饱和氯化铁溶液滴入沸水中,并继续加热煮沸至生成红褐色沉淀
氯化铁在溶液中水解生成氢氧化铁,加热促进水解,生成氢氧化铁胶体,则实验室制备氢氧化铁胶体的操作为把饱和氯化铁溶液滴入沸水中,继续煮沸至溶液呈红褐色。
8.下列有关铁及其化合物的说法正确的是A.Fe(OH)2易被氧化成Fe(OH)3,说明稳定性:Fe(OH)2<Fe(OH)3B.铁是较活泼的金属,它与卤素单质(X2)反应的生成物均为FeX3C.氢氧化铁与氢碘酸反应:Fe(OH)3+3HI===FeI3+3H2OD.铁与水蒸气在高温下的反应产物为Fe2O3和H2
Fe(OH)2具有还原性,易被氧化生成稳定的Fe(OH)3,说明稳定性:Fe(OH)2<Fe(OH)3,故A正确;碘的氧化性较弱,铁与碘反应生成FeI2,故B错误;Fe3+具有较强的氧化性,可与I-发生氧化还原反应,生成亚铁离子和碘,故C错误;铁与水蒸气在高温下的反应产物为Fe3O4和H2,故D错误。
9.混合下列各组物质使之充分反应,加热蒸干产物并在300 ℃下灼烧至质量不变,最终残留固体不是纯净物的是A.向红褐色的Fe(OH)3固体中加入过量盐酸B.等物质的量浓度、等体积的(NH4)2SO4与BaCl2溶液C.等物质的量的NaHCO3与Na2O2固体溶于水D.向NaBr溶液中通入过量氯气
反应得到的溶液中含有FeCl3和HCl,加热,FeCl3水解得到Fe(OH)3和HCl,HCl易挥发,Fe(OH)3受热分解最终得到的固体是Fe2O3,故A不选;反应生成NH4Cl和BaSO4,NH4Cl受热分解,最终得到BaSO4,故B不选;Na2O2与水反应生成NaOH,NaOH物质的量是Na2O2的2倍,等物质的量的NaHCO3与Na2O2反应最终得到Na2CO3和NaOH的混合物,故C选;向NaBr溶液中通入过量氯气,生成Br2和NaCl,Br2易挥发,最终得到NaCl,故D不选。
10.太阳能是理想的能源,通过Fe3O4和FeO的热化学循环可以利用太阳能,其转化关系如图所示。下列说法错误的是A.过程Ⅰ的化学方程式为2Fe3O4 6FeO +O2↑B.过程Ⅱ中每生成23.2 g Fe3O4转移0.3 ml电子C.利用该过程可以降低环境中CO2的含量D.该过程的总反应为CO2 C+O2
由图知,该过程中Fe3O4和FeO相互转化,而二氧化碳被消耗,生成了碳和氧气,故利用该过程可以降低环境中CO2的含量,C正确;
11.已知:普通铁+水蒸气 铁的氧化物+氢气,铁的氧化物+氢气“引火铁”+水蒸气,“引火铁”为颗粒很细、反应活性很高的铁粉。某实验小组使用普通铁粉、20%的盐酸及其他试剂制备“引火铁”,装置(铁架台、铁夹、铁网、陶土网、加热仪器等略去)如图所示。
关于上述装置和实验,下列分析错误的是A.A、I中加入普通铁粉,G中可加入碱石灰B.A中生成磁性氧化铁,E中生成“引火铁”C.需要加热的仪器只有A、ED.D用于收集氢气
根据两套装置中各仪器的功能,可以判断出A中放置普通铁粉,B中放一定体积的水,持续加热提供水蒸气,C是安全瓶,用于防倒吸,D是利用排水集气法收集氢气。
E中反应物为A中生成的四氧化三铁,I中放置普通铁粉,通过分液漏斗加入一定体积的盐酸制备H2,从I中逸出的气体中含有挥发出的氯化氢,经过G(内有碱石灰)除杂干燥后得到纯净的氢气,氢气进入E中和Fe3O4在一定温度下进行反应,得到“引火铁”,剩余的氢气在F处进行收集或其他处理。
12.黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料,矿区中的黄铁矿暴露在空气中会被缓慢氧化,氧化过程如图所示。下列说法正确的是
A.d步生成的Fe(OH)3可作净水剂、消毒剂B.a步发生反应的离子方程式为2FeS2+7O2+2H2O===2Fe2++ +4H+C.空气中O2约占五分之一,0.1 ml FeS2完全被氧化时消耗标准状况下空气的体积约 为8.4 LD.缓慢氧化过程中对矿区的生态环境没有影响
Fe(OH)3具有吸附性,可作净水剂,但不能作消毒剂,故A错误;
0.1 ml FeS2完全被氧化时,S失去1.4 ml电子变为硫酸,铁由+2价被氧化为+3价,失去0.1 ml电子,失去电子总物质的量为1.5 ml,根据得失电子守恒,消耗氧气的物质的量为 ml=0.375 ml,相当于消耗空气0.375 ml×5×22.4 L·ml-1=42 L,故C错误;由反应可知,缓慢氧化过程中产生大量酸,会破坏矿区的生态环境,故D错误。
13.为探究铁及其化合物的一些化学性质,某实验小组学生设计了以下实验。(1)高温下,让铁粉与水蒸气反应,如图所示。试管中发生反应的化学方程式是______________________________,该反应中氧化剂是______。
H2O中氢元素化合价由+1降低为0,氧化剂是H2O。
①往A溶液中滴入几滴KSCN溶液,溶液的颜色__________。
氧化铁和盐酸反应生成氯化铁,A溶液中含有Fe3+,滴入几滴KSCN溶液,溶液的颜色变为红色。
②写出上述A→B过程中的化学方程式:____________________。③描述将C放置于空气中的现象:___________________________________________,写出该反应的化学方程式: _______________________________。④写出向B中加入氯水发生反应的离子方程式:_________________________。
2FeCl3+Fe===3FeCl2
白色絮状沉淀迅速变为灰绿色,最终变为红褐色
2Fe2++Cl2===2Fe3++2Cl-
B为氯化亚铁溶液,加入氯水生成氯化铁溶液,离子方程式为2Fe2++Cl2===2Fe3++2Cl-。
⑤将A的饱和溶液滴入沸水中并加热,可制得________胶体;当光束通过该胶体时,可看到一条光亮的“通路”,这种现象称为___________。
14.铁、铝、铜等金属及其化合物在日常生活中应用广泛,请根据下列实验回答问题。(1)生铁中含有一种铁碳化合物X(Fe3C)。X在足量的空气中高温煅烧,生成有磁性的固体Y,将Y溶于过量盐酸,所得溶液中大量存在的阳离子是_________________。
Fe2+、Fe3+、H+
有磁性的固体Y是四氧化三铁,所以Y与过量盐酸反应后,溶液中大量存在的阳离子是Fe2+、Fe3+、H+。
(2)某溶液中有Mg2+、Fe2+、Al3+、Cu2+四种离子,向其中加入过量的NaOH溶液后,过滤,将滤渣高温灼烧并将灼烧后的固体投入到过量的稀盐酸中,所得溶液与原溶液相比,溶液中大量减少的阳离子是_______(填字母)。A.Mg2+ B.Fe2+C.Al3+ D.Cu2+
氢氧化钠过量,因此得不到氢氧化铝沉淀。又因为氢氧化亚铁极易被氧化生成氢氧化铁,所以滤渣的成分为氢氧化铁、氢氧化镁和氢氧化铜,灼烧后生成氧化铁、氧化镁和氧化铜,与过量盐酸反应生成氯化铁、氯化镁和氯化铜,因此所得溶液与原溶液相比,溶液中大量减少的阳离子是Fe2+、Al3+。
(3)氧化铁是重要的工业颜料,用废铁屑制备氧化铁的流程如图:
操作Ⅰ的名称是______,操作Ⅱ的名称是______。
(4)有些同学认为用酸性KMnO4溶液滴定也能进行铁元素含量的测定,其反应如下:5Fe2++ +8H+===5Fe3++Mn2++4H2O。a.称取2.85 g绿矾(FeSO4·7H2O)产品,溶解,配制成250 mL一定物质的量浓度的溶液;b.量取25.00 mL待测溶液于锥形瓶中;c.用硫酸酸化的0.010 00 ml·L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00 mL。①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需______________。
②上述样品中FeSO4·7H2O的质量分数为________(保留3位有效数字)。
15.某化学兴趣小组拟用如图装置制备氢氧化亚铁并观察其颜色。提供化学药品:铁粉、稀硫酸、氢氧化钠溶液。(1)稀硫酸应放在_____(填写仪器编号)中。
由于三颈烧瓶是反应装置,故必须用分液漏斗来控制稀硫酸的用量,故稀硫酸盛装在1中。
(2)本实验通过控制A、B、C三个开关,将仪器中的空气排尽后,再关闭开关____、打开开关____,就可观察到氢氧化亚铁的颜色。试分析实验开始时排尽装置中空气的理由:____________________________。
防止生成的氢氧化亚铁被氧化
(3)实验时为防止仪器2中铁粉通过导管进入仪器3中,可采取的措施是____________________________。
(4)在FeSO4溶液中加入(NH4)2SO4固体可制备硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H2O](式量为392),该晶体比一般亚铁盐稳定,不易被氧化,易溶于水,不溶于乙醇。①为洗涤(NH4)2Fe(SO4)2·6H2O粗产品,下列方法中最合适的是_____(填字母)。A.用冷水洗B.先用冷水洗,后用无水乙醇洗C.用30%的乙醇溶液洗D.用90%的乙醇溶液洗
硫酸亚铁铵易溶于水,不溶于乙醇,故可以用浓度较高的乙醇洗涤。
②为了测定产品的纯度,称取a g产品溶于水,配制成500 mL溶液,用浓度为c ml·L-1的酸性KMnO4溶液滴定。每次所取待测液体积均为25.00 mL,实验结果记录如下:
则该产品纯度为_____________。上表中第一次实验中记录数据明显大于后两次,其原因可能是______(填字母)。A.实验结束时俯视刻度线读取滴定终点时酸性高锰酸钾溶液的体积B.滴定前滴定管尖嘴有气泡,滴定结束无气泡C.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗D.该酸性高锰酸钾标准液保存时间过长,有部分变质,浓度降低
(人教版)高考化学一轮复习讲义课件第4章第12讲 铁及其氧化物和氢氧化物(含解析): 这是一份(人教版)高考化学一轮复习讲义课件第4章第12讲 铁及其氧化物和氢氧化物(含解析),共60页。PPT课件主要包含了铁及其氧化物,铁的氢氧化物,练真题明考向,课时精练等内容,欢迎下载使用。
高考化学一轮复习第4章金属及其化合物第14讲铁及其氧化物、氢氧化物课件: 这是一份高考化学一轮复习第4章金属及其化合物第14讲铁及其氧化物、氢氧化物课件,共32页。PPT课件主要包含了磁性氧化铁,红棕色粉末,+2价,+3价,碱性氧化物,2化学性质,Fe3O4,答案FeO,白色固体,红褐色固体等内容,欢迎下载使用。
2025届高考化学一轮总复习第4章金属及其化合物第14讲铁及其氧化物氢氧化物课件: 这是一份2025届高考化学一轮总复习第4章金属及其化合物第14讲铁及其氧化物氢氧化物课件,共32页。PPT课件主要包含了磁性氧化铁,红棕色粉末,+2价,+3价,碱性氧化物,2化学性质,Fe3O4,答案FeO,白色固体,红褐色固体等内容,欢迎下载使用。












