

2025年高考化学精品教案第六章化学反应与能量变化第8讲多池连接及电化学的相关计算
展开考点 多池连接及电化学的相关计算
1.原电池、电解池连接
根据两池电极材料活动性或两池电极上的反应物的还原性强弱判断负极(还原性强的为负极);或根据两池电极上的反应物的氧化性强弱判断正极(氧化性强的为正极)。
2.多个电解池串连
注意 判断多个电解池串联的每个池的阴、阳极时,应找根源上直流电源的正、负极,不要受旁边串联的电解池的影响。还要注意阳极的电极材料是否为活性电极。
3.电化学中有关得失电子守恒的计算
在原电池或电解池电路中转移的电子的物质的量与各电极上转移的电子的物质的量相等。穿过膜的离子所带电荷数也与转移的电子数目相等。
注意 计算溶液质量变化时除了看电极反应外,还要注意穿过膜的离子引起的溶液质量的变化。如果电极上有副反应,计算转移电子总数时要把发生副反应转移的电子数计算在内。
4.电流效率η的计算
η=生成目标产物消耗的电子数转移的电子总数×100%。先根据电极反应式计算出生成目标产物需要的电子的物质的量,再代入该公式进行计算。
5.能量密度E的计算
E=电池输出电能燃料质量,1 kW·h=3.6×106 J,电能公式W=UQ。
1.原电池与电解池串联装置如图所示。
(1)甲池中负极反应式为 H2-2e- 2H+ 。
(2)向乙池U形管中滴入酚酞溶液,现象是 U形管右侧溶液变红 。乙池左侧NaOH溶液中发生反应的离子方程式为 Cl2+2OH- Cl-+ClO-+H2O 。
2.电化学降解硝酸盐中NO3-的原理如图所示。
(1)电源正极为 A (填“A”或“B”),阴极反应式为 2NO3-+6H2O+10e- N2↑+12OH- 。
(2)若电解过程中转移2 ml电子,则阳极室的质量减少 18 g。
3.工业上电解精炼银时,电解液的pH为1.5~2,电流强度为5~10 A,若电解液pH太小,电解精炼过程中在阴极除了Ag+放电,还会发生 2H++2e- H2↑ (写电极反应式),若用10 A的电流电解60 min 后,得到32.4 g Ag,则该电解池的电解效率为 80.4 %。(保留小数点后一位;通过一定电量时阴极上实际沉积的金属质量与通过相同电量时理论上应沉积的金属质量之比叫电解效率;法拉第常数为 96 500 C·ml-1 )
4.二甲醚直接燃料电池具有启动快、效率高等优点,其能量密度高于甲醇直接燃料电池(5.93 kW·h·kg-1)。若电解质为酸性,二甲醚直接燃料电池的负极反应为 CH3OCH3+3H2O-12e- 2CO2↑+12H+ ,1 ml二甲醚分子经过电化学氧化,可以产生 12 ml电子的电量;该电池的理论输出电压为1.20 V,能量密度E= 1.20 V×1 000 g46 g·ml-1×12×96 500 C·ml-1 1 kg×3.6×106J·kW-1·h-1≈8.39 kW·h·kg-1 (列式计算,能量密度=电池输出电能/燃料质量,1 kW·h=3.6×106 J,F=96 500 C·ml-1)。
命题点1 原电池与电解池串联
1.[2022山东]设计如图装置回收金属钴。保持细菌所在环境pH稳定,借助其降解乙酸盐生成CO2,将废旧锂离子电池的正极材料LiCO2(s)转化为C2+,工作时保持厌氧环境,并定时将乙室溶液转移至甲室。已知电极材料均为石墨材质,右侧装置为原电池。下列说法正确的是( B )
A.装置工作时,甲室溶液pH逐渐增大
B.装置工作一段时间后,乙室应补充盐酸
C.乙室电极反应式为LiCO2+2H2O+e- Li++C2++4OH-
D.若甲室C2+减少200 mg,乙室C2+增加300 mg,则此时已进行过溶液转移
解析 根据右侧装置为原电池,乙酸盐降解为二氧化碳,发生氧化反应,LiCO2转化为C2+,发生还原反应,知右侧装置左电极为负极,右电极为正极;左侧装置为电解池,左电极为阳极,乙酸盐转化为CO2气体,右电极为阴极,C2+转化为C单质。
装置工作时,甲室为阴极室,阳极发生反应CH3COO--8e-+2H2O 2CO2↑+7H+,结合阴极反应及电解液呈电中性知,阳极生成的 H+通过阳膜进入阴极室,故甲室溶液pH减小,A项错误;乙室为正极室,正极反应为LiCO2+e-+4H+ Li++C2++2H2O,消耗H+生成H2O,电解质溶液酸性减弱,故工作一段时间后需要补充盐酸,B项正确,C项错误;根据甲室中电极反应C2++2e- C和乙室中电极反应可知,甲室中减少的C2+的质量为乙室中增加的C2+的质量的一半,则甲室C2+减少200 mg,乙室C2+需增加400 mg,而此时乙室C2+增加了 300 mg,故还没有进行过溶液转移,D项错误。
命题点2 根据得失电子守恒计算
2.某甲醇燃料电池的工作原理如图所示,质子交换膜(只有质子能够通过)左右两侧的溶液均为1 L 2 ml·L-1 H2SO4溶液。当电池中有1 ml 电子发生转移时,左右两侧溶液的质量之差为 12 g(假设反应物耗尽,忽略气体的溶解)。
解析 根据电极反应式,结合得失电子守恒和差量法进行计算。该燃料电池中通入甲醇的一极为负极,电极反应式为
CH3OH-6e-+H2O CO2↑+6H+ Δm
6 ml 44 g-32 g=12 g
1 ml 2 g
通入氧气的一极为正极,电极反应式为
O2+4e-+4H+ 2H2O Δm
4 ml 32 g
1 ml 8 g
电路中转移1 ml 电子时,左侧还有1 ml H+通过质子交换膜进入右侧,即左侧减少1 g H+,右侧增加1 g H+,故Δm左=3 g,Δm右=9 g,两侧溶液的质量之差为Δm右+Δm左=9 g+3 g=12 g。
命题点3 电流效率(η)的计算
3.[重庆高考]一定条件下,如图所示装置可实现有机物的电化学储氢(忽略其他有机物)。
(1)导线中电子移动方向为 A→D 。(用A、D表示)
(2)生成目标产物的电极反应式为 C6H6+6H++6e- C6H12 。
(3)该储氢装置的电流效率η= 64.3% 。(η=生成目标产物消耗的电子数转移的电子总数×100%,计算结果保留小数点后1位)
解析 (1)由装置图可知,电解池左边电极D上发生的反应是“苯加氢还原”,则电极D是阴极,故导线中电子移动方向为A→D。(2)该电解池的目的是储氢,故目标产物为环己烷,则生成环己烷的电极反应式为C6H6+6H++6e- C6H12。(3)阳极生成的H+经过高分子电解质膜移动至阴极,一部分H+与苯反应生成环己烷,还有一部分H+得电子生成H2(2H++2e- H2↑,阴极的副反应),左边(阴极区)出来的混合气体为未参与反应的其他气体、未反应的苯(g)、生成的环己烷(g)和H2。设未反应的苯蒸气的物质的量为x ml,生成的H2的物质的量为y ml,阴极生成的气态环己烷的物质的量为(2.4-x) ml,得到电子的物质的量为6×(2.4-x) ml,阴极生成y ml H2得到2y ml电子,阳极(电极E)的电极反应式为2H2O-4e- O2↑+4H+,生成2.8 ml O2失去电子的物质的量为4×2.8 ml=11.2 ml,根据得失电子守恒有6×(2.4-x) ml+2y ml=11.2 ml;阴极出来的混合气体中苯蒸气的物质的量分数为xml10ml+yml=0.1;联立解得x=1.2,电流效率为6×(2.4-1.2)ml11.2ml×100%≈64.3%。
1.[2022辽宁]如图,c管为上端封口的量气管,为测定乙酸溶液浓度,量取10.00 mL待测样品加入b容器中,接通电源,进行实验。下列说法正确的是( A )
A.左侧电极反应:2H2O-4e- O2↑+4H+
B.实验结束时,b中溶液红色恰好褪去
C.若c中收集气体11.20 mL,则样品中乙酸浓度为0.1 ml·L-1
D.把盐桥换为U形铜导线,不影响测定结果
解析 根据题意结合图示知,通过测量b容器中溶液变红色时c管内收集的气体的体积,结合各电极上转移的电子数相等可计算乙酸溶液的浓度,则右侧Pt电极为阴极,CH3COOH放电,电极反应式为2CH3COOH+2e- H2↑+2CH3COO-,左侧Pt电极为阳极,H2O放电,电极反应式为2H2O-4e- O2↑+4H+,A项正确;实验结束时,b中CH3COOH被完全消耗生成CH3COO-,CH3COO-水解使溶液显碱性,故溶液为红色,B项错误;未指明气体所处的状况,不能根据体积计算其物质的量,C项错误;盐桥起传递离子使溶液呈电中性的作用,铜导线不能传递离子,D项错误。
2.[2022河北改编]科学家研制了一种能在较低电压下获得氧气和氢气的电化学装置。工作原理示意图如图。
下列说法正确的是( D )
A.电极b为阳极
B.隔膜为阳离子交换膜
C.生成气体M与N的物质的量之比为2∶1
D.反应器Ⅰ中反应的离子方程式为4[Fe(CN)6]3-+4OH- 催化剂 4[Fe(CN)6]4-+O2↑+2H2O
解析 由电极a上[Fe(CN)6]4-→[Fe(CN)6]3-,发生失去电子的氧化反应可知,电极a为阳极、电极b为阴极,A项错误;由图示知,阴极反应为DHPS+2H2O+2e- DHPS-2H+2OH-,阳极反应为 [Fe(CN)6]4--e- [Fe(CN)6]3-,为维持溶液的电中性,阴极室的OH-应通过阴离子交换膜进入阳极室,B项错误;根据题意,结合氧化还原反应规律可知,反应器Ⅰ中反应为4[Fe(CN)6]3-+4OH- 催化剂 4[Fe(CN)6]4-+O2↑+2H2O,反应器Ⅱ中反应为DHPS-2H 催化剂 DHPS+H2↑,则M是O2、N是H2,根据得失电子守恒,O2与H2的物质的量之比为1∶2,C项错误,D项正确。
1.[2023青岛调研]设计如图装置处理含甲醇的废水并进行粗铜的精炼。下列说法正确的是( D )
A.甲电极增加的质量等于乙电极减少的质量
B.装置工作一段时间后,原电池装置中溶液的pH不变
C.理论上每产生标准状况下1.12 L CO2,甲电极增重6.4 g
D.原电池正极反应式为FeO42-+3e-+8H+ Fe3++4H2O
解析 由题意可知,该装置中左池为原电池,右池为电解池。
甲电极为阴极,发生反应Cu2++2e- Cu,乙电极为阳极,先是锌、铁等杂质放电,后是铜放电,因此甲电极增加的质量不等于乙电极减少的质量,A项错误;原电池装置中总反应为2FeO42-+CH3OH+4H+ 2Fe(OH)3↓+CO2↑+H2O,c(H+)减小,溶液的pH增大,B项错误;根据CH3OH→CO2失6e-,知理论上每产生标准状况下 1.12 L CO2,转移的电子为1.12 L22.4 L·ml-1×6=0.3 ml,根据甲电极反应及各电极上转移电子数相等可知,甲电极析出0.15 ml Cu,增重9.6 g,C项错误。
2.[浓差电池][2024河北衡水二中考试]利用浓差电池电解Na2SO4溶液(a、b电极均为石墨电极),可制得O2、H2、H2SO4和NaOH,反应原理如图所示。下列说法正确的是( B )
A.b电极的电极反应为2H2O+2e- H2↑+2OH-
B.c、d分别为阳离子交换膜和阴离子交换膜
C.浓差电池放电过程中,Cu(1)电极上的电极反应为Cu-2e- Cu2+
D.当阴极产生2.24 L气体时,电路中转移0.2 ml电子
解析 根据题图电子移动方向可知,b电极为电解池的阳极,H2O电离出的OH-失去电子发生氧化反应生成O2,电极反应为 2H2O-4e- O2↑+4H+,A错误;a电极、b电极分别为阴极、阳极,Na+通过离子交换膜c进入阴极室,SO42-通过离子交换膜d进入阳极室,则c、d分别为阳离子交换膜和阴离子交换膜,B正确;Cu(1)为原电池的正极,电极反应为Cu2++2e- Cu,Cu(2)为原电池的负极,电极反应为Cu-2e- Cu2+,C错误;没有说明是否为标准状况,不能计算气体的物质的量,D错误。
3.[电流效率][2024河南安阳调研]如图为一定条件下采用多孔惰性电极的储氢电池充电装置(忽略其他有机物)。已知储氢装置的电流效率η=生成目标产物消耗的电子数转移的电子总数×100%,下列说法错误的是( B )
A.若η=75%,则参加反应的苯为0.8 ml
B.过程中通过C—H键的断裂实现氢的储存
C.采用多孔电极增大了接触面积,可降低电池能量损失
D.生成目标产物的电极反应式为C6H6+6e-+6H+ C6H12
解析 装置右侧反应中C6H6得电子被还原为C6H12,所以装置右侧为阴极,左侧为阳极,阳极的电极反应为2H2O-4e- O2↑+4H+,生成的O2的物质的量n(O2)=1.6 ml,反应转移电子的物质的量n(e-)=1.6 ml×4=6.4 ml,若储氢装置的电流效率为75%,则生成目标产物环己烷消耗的电子数为6.4 ml×75%=4.8 ml,生成C6H12的电极反应为C6H6+6e-+6H+ C6H12,则反应消耗的苯为0.8 ml,A、D正确;苯转化为环己烷的反应是加成反应,反应过程中断裂了苯分子中的大π键,B错误;采用多孔电极增大了物质的接触面积,可提高电解效率,降低电池能量损失,C正确。
4.[2024浙江名校联考]以某锂离子电池、丙烯腈电合成己二腈[NC(CH2)4CN]的装置如图所示(电极均为石墨)。该锂离子电池的总反应是LixCy+Li1-xFePO4放电 充电 Cy+LiFePO4。下列说法不正确的是( B )
A.B为正极,电极反应式为Li1-xFePO4+xe-+xLi+ LiFePO4
B.阴极区的电极反应为2CH2 CHCN+2e-+2H+ NC(CH2)4CN,一段时间后,阴极室溶液的pH增大
C.石墨电极C产生O2,稀硫酸的作用为增强溶液导电性
D.当电路中通过1 ml e-时,阳极室溶液质量减少9 g(不考虑氧气溶解)
解析 根据装置图及该锂离子电池的总反应知,放电时Li+向B极移动,则B为正极,电极反应为Li1-xFePO4+xe-+xLi+ LiFePO4,A项正确;A极为负极,则D极为阴极,电极反应为2CH2 CHCN+2e-+2H+ NC(CH2)4CN,阳极区H+透过质子交换膜进入阴极区,因此阴极室溶液的pH不变,B项错误;C极为阳极,电极反应为2H2O-4e- O2↑+4H+,稀硫酸的作用为增强溶液导电性,C项正确;根据阳极反应2H2O-4e- O2↑+4H+知,当电路中通过1 ml e-时,阳极室析出0.25 ml O2,同时有1 ml H+进入阴极室,相当于减少0.5 ml H2O,因此阳极室溶液质量减少9 g,D项正确。
5.[2024山东滕州测试](1)NH3的燃烧反应可设计成燃料电池,工作原理如图甲所示。电极a为 负极 (填“正极”或“负极”);电极b上的电极反应为 O2+4e-+2H2O 4OH- 。当共消耗1.568 L(标准状况)气体时,通过负载的电子的物质的量为 0.12 ml。
图甲
(2)一种肼(N2H4)燃料电池的工作原理如图乙所示。
图乙
①a极的电极反应式为 N2H4-4e- N2↑+4H+ ;电池中Fe2+→Fe3+的离子方程式为 4Fe2++O2+4H+ 4Fe3++2H2O 。
②若利用该电池给铅酸蓄电池充电,当消耗3.2 g N2H4时,PbO2电极质量 减少 (填“增加”或“减少”) 12.8 g。
解析 (1)NH3失电子生成N2,则电极a为负极;电极b为正极,电极反应为O2+4e-+2H2O 4OH-。共消耗气体的物质的量为1.568 L22.4 L/ml=0.07 ml,结合关系式:4NH3~3O2~12e-,则参加反应的NH3的物质的量为0.04 ml,通过负载的电子的物质的量为0.04ml4×12=0.12 ml。(2)①a极,N2H4(l)失电子生成N2,则电极反应式为N2H4-4e- N2↑+4H+;电池中Fe2+→Fe3+的离子方程式为4Fe2++O2+4H+ 4Fe3++2H2O。②n(N2H4)=3.2 g32 g/ml=0.1 ml,转移电子的物质的量为0.1 ml×4=0.4 ml,给铅酸蓄电池充电,PbO2电极反应为PbSO4+2H2O-2e- PbO2+4H++SO42-,则PbO2电极质量减少(303-239) g/ml×0.4ml2=12.8 g。
6.[结合法拉第常数计算][2023辽宁沈阳二中模拟]室温氟穿梭可充电电池装置如图所示,负极为Ce/CeF3电极,正极为CuF2/Cu电极,氟氢离子液体{含H+和[(FH)nF]-,n=2或3}作电解质,已知放电时正极的电极反应式为CuF2+2e-+4[(FH)3F]- Cu+6[(FH)2F]-,法拉第常数F=96 500 C/ml。下列说法正确的是( D )
A.充电时,[(FH)nF]-移向Ce/CeF3电极
B.用铅酸蓄电池为该电池充电时,每生成1 ml CeF3,Pb极增重9.6 g
C.CuF2/Cu电极每减少3.8 g,该电池输出的电荷量为4 825 C
D.放电时,负极发生的电极反应为Ce+9[(FH)2F]--3e- CeF3+6[(FH)3F]-
解析 放电时负极的电极反应较复杂,但正极反应式已给出,电池总反应很容易书写,则选用“加减法”:
放电时,负极为Ce/CeF3电极,正极为CuF2/Cu电极,则充电时,阴极为Ce/CeF3电极,阳极为CuF2/Cu电极。充电时,阴离子向阳极移动,则[(FH)nF]-移向CuF2/Cu电极,A错误。放电时,Ce/CeF3电极生成CeF3,则充电时Ce/CeF3电极应消耗CeF3,B错误。放电时,CuF2/Cu电极的电极反应式为CuF2+4[(FH)3F]-+2e- Cu+6[(FH)2F]-,该电极每减少3.8 g,转移电子3.8 g38 g/ml×2=0.2 ml,该电池输出的电荷量为96 500 C/ml×0.2 ml=19 300 C,C错误。
7.[2024山东枣庄八中考试改编]利用CH4燃料电池电解制备Ca(H2PO4)2并得到副产物NaOH、H2、Cl2,装置如图所示。下列说法错误的是( D )
A.a极的电极反应式为CH4+4O2--8e- CO2+2H2O
B.A膜和C膜均为阳离子交换膜
C.X室为阳极室
D.b极上消耗2.24 L O2,Y室中Na+增加0.4 ml
解析 甲烷燃料电池中通入甲烷的一极为负极,通入氧气的一极为正极。
由以上分析可知,A项正确;根据各室进出口溶液的浓度变化可知,X室中Ca2+通过A膜进入产品室,原料室中H2PO4-通过B膜进入产品室、Na+通过C膜进入Y室,故B膜是阴离子交换膜,A膜和C膜均为阳离子交换膜,B项正确;X室为阳极室,C项正确;没有指明是否为标准状况,不能计算氧气的物质的量,D项错误。
8.[能量密度][全国Ⅰ高考]二甲醚直接燃料电池具有启动快、效率高等优点,其能量密度高于甲醇直接燃料电池(5.93 kW·h·kg-1)。若电解质为酸性,二甲醚直接燃料电池的负极反应为 CH3OCH3-12e-+3H2O 2CO2↑+12H+ ,一个二甲醚分子经过电化学氧化,可以产生 12 个电子的电荷量;该电池的理论输出电压为1.20 V,能量密度E= 1.20 V×1 000 g46 g·ml-1×12×96 500 C·ml-1 1 kg÷(3.6×106 J·kW-1·h-1)≈8.39 kW·h·kg-1 (列式计算。能量密度=电池输出电能/燃料质量,1 kW·h=3.6×106 J)。
解析 电解质为酸性时,二甲醚在燃料电池的负极上发生氧化反应,生成CO2和H+,CH3OCH3中碳元素的化合价可看作-2,CO2中碳元素的化合价为+4,所以1 ml CH3OCH3失去12 ml 电子,负极反应为CH3OCH3-12e-+3H2O 2CO2↑+12H+。假设燃料二甲醚的质量为1 kg,则只要知道电池的输出电能就能计算出能量密度。1 kg二甲醚的物质的量为1 000 g46 g·ml-1,1 kg二甲醚失去电子的物质的量为 1 000 g46 g·ml-1×12,那么1 kg二甲醚所产生的电荷量为1 000 g46 g·ml-1×12×96 500 C·ml-1。根据电能公式W=UQ计算出电能,再求出能量密度,为1.20 V×1 000 g46 g·ml-1×12×96 500 C·ml-1÷1 kg÷(3.6×106 J·kW-1·h-1)≈8.39 kW·h·kg-1。
9.[模拟工业废水废气处理][2023山东泰安二模改编]NO-空气质子交换膜燃料电池实现了制硝酸、发电、环保一体化,某兴趣小组用该电池模拟工业处理废气和废水的过程,装置如图所示。下列说法错误的是( D )
A.交换膜b为阴离子交换膜
B.乙池中总反应的离子方程式为5SO2+2NO+8H2O+8NH3 电解 10NH4++5SO42-
C.当浓缩室得到4 L 0.6 ml·L-1盐酸时,M室溶液的质量变化为18 g(溶液体积变化忽略不计)
D.若甲池有0.25 ml O2参加反应,则乙池中处理废气(SO2和NO)的总体积为15.68 L(标准状况)
解析 NO-空气质子交换膜燃料电池中通入空气的一极为原电池(甲池)的正极,通入NO的一极为原电池(甲池)的负极。乙池和丙池均为电解池,乙池的左侧电极与电源正极相连,为阳极;丙池的右侧电极与电源负极相连,为阴极。丙池左侧电极为阳极,电极反应式为2H2O-4e- O2↑+4H+,产生的H+通过交换膜a,与通过交换膜b移向浓缩室的Cl-形成HCl,所以交换膜b为阴离子交换膜,A正确。乙池中SO2被氧化为SO42-,NO被还原为NH4+,反应还有NH3参与,由得失电子守恒和原子守恒可得总反应的离子方程式为5SO2+2NO+ 8H2O+8NH3 电解 10NH4++5SO42-,B正确。丙池左侧电极的电极反应式为2H2O-4e- O2↑+4H+,当浓缩室得到4 L 0.6 ml·L-1盐酸时,M室转移至浓缩室的H+的物质的量为4 L×(0.6-0.1) ml·L-1=2 ml,所以M室生成2 ml H+,相当于减少1 ml H2O,则M室溶液的质量变化为18 g,C正确。甲池中O2得电子被还原,则O2~4e-,有0.25 ml O2参与反应时,转移1 ml e-,因为甲池与乙池串联,则乙池中也转移1 ml e-,根据总反应式,有0.5 ml SO2和0.2 ml NO被处理,则处理SO2和NO的体积为0.7 ml×22.4 L·ml-1=15.68 L,D错误。课标要求
核心考点
五年考情
核心素养对接
能分析、解释原电池和电解池的工作原理
多池连接及电化学的相关计算
2022山东,T13;2021北京,T15;2020全国Ⅲ,T12
证据推理与模型认知:能分析、识别复杂的电解装置并进行推理
命题分析预测
1.多池串联主要考查电极类型判断、电极反应式的书写等;原电池和电解池的相关计算主要包括两极产物的定量计算、溶液pH的计算、根据电荷量求产物的量、根据产物的量求电荷量等。
2.预计2025年高考仍会考查电池中利用得失电子守恒计算两极产物的量,另外,电池的电流效率的计算也可能是热点;电化学跨学科命题更能考查考生的综合能力,是高考命题的重要趋势
装置
工作原理
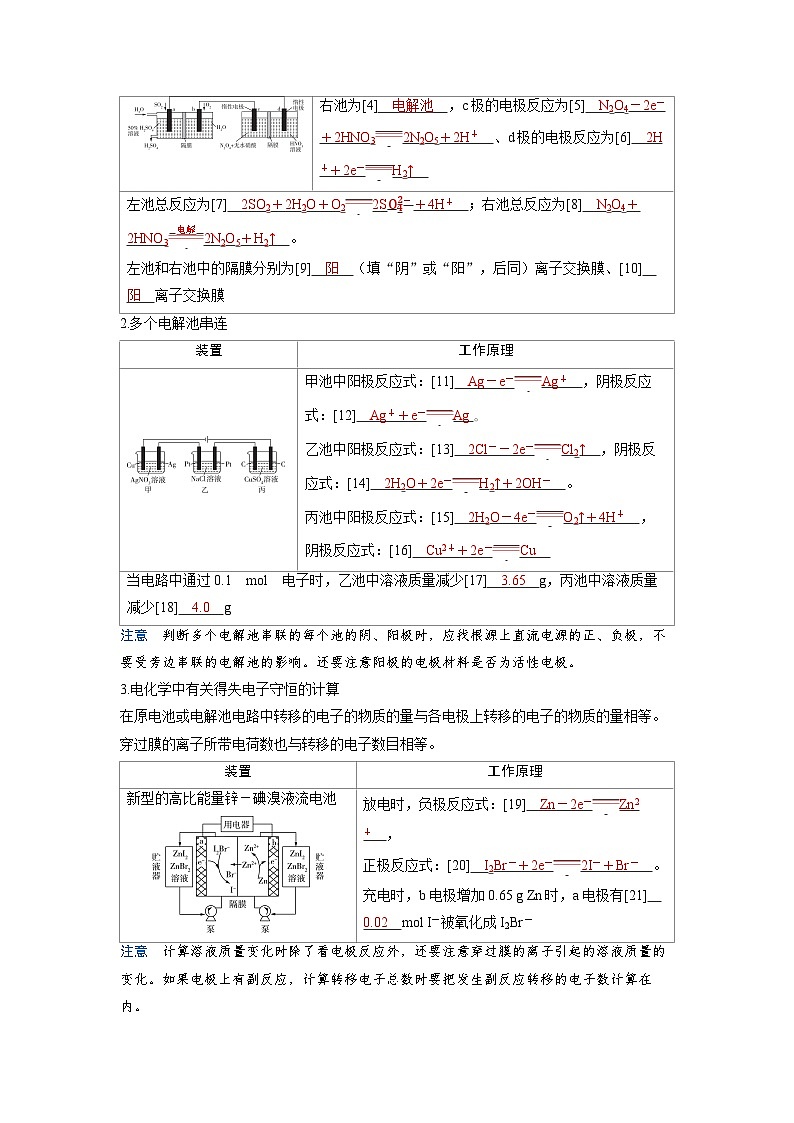
利用膜技术原理和电化学原理制备少量硫酸和绿色硝化剂N2O5,装置如图所示:
左池为[1] 原电池 ,a极的电极反应为[2] SO2-2e-+2H2O SO42-+4H+ 、b极的电极反应为[3] O2+4e-+4H+ 2H2O 。
右池为[4] 电解池 ,c极的电极反应为[5] N2O4-2e-+2HNO3 2N2O5+2H+ 、d极的电极反应为[6] 2H++2e- H2↑
左池总反应为[7] 2SO2+2H2O+O2 2SO42-+4H+ ;右池总反应为[8] N2O4+2HNO3 电解 2N2O5+H2↑ 。
左池和右池中的隔膜分别为[9] 阳 (填“阴”或“阳”,后同)离子交换膜、[10] 阳 离子交换膜
装置
工作原理
甲池中阳极反应式:[11] Ag-e- Ag+ ,阴极反应式:[12] Ag++e- Ag 。
乙池中阳极反应式:[13] 2Cl--2e- Cl2↑ ,阴极反应式:[14] 2H2O+2e- H2↑+2OH- 。
丙池中阳极反应式:[15] 2H2O-4e- O2↑+4H+ ,阴极反应式:[16] Cu2++2e- Cu
当电路中通过0.1 ml 电子时,乙池中溶液质量减少[17] 3.65 g,丙池中溶液质量减少[18] 4.0 g
装置
工作原理
新型的高比能量锌-碘溴液流电池
放电时,负极反应式:[19] Zn-2e- Zn2+ ,
正极反应式:[20] I2Br-+2e- 2I-+Br- 。
充电时,b电极增加0.65 g Zn时,a电极有[21] 0.02 ml I-被氧化成I2Br-
装置
工作原理
燃料电池负极反应式:[22] CH4-8e-+10OH- CO32-+7H2O ;
电解池阴极反应式:[23] Zn2++2e- Zn
燃料电池中负极消耗2.24 L(标准状况)CH4,且能量完全转化为电能,电解池中回收制得19.5 g Zn,则该装置的电流效率η=[24] 75%
2025年高考化学精品教案第六章化学反应与能量变化第1讲化学反应与热能: 这是一份2025年高考化学精品教案第六章化学反应与能量变化第1讲化学反应与热能,共16页。
2025年高考化学精品教案第六章化学反应与能量变化第2讲盖斯定律及其应用: 这是一份2025年高考化学精品教案第六章化学反应与能量变化第2讲盖斯定律及其应用,共15页。
2025年高考化学精品教案第六章化学反应与能量变化第4讲新型电源: 这是一份2025年高考化学精品教案第六章化学反应与能量变化第4讲新型电源,共16页。












