






化学选择性必修1第一节 反应热一等奖教学课件ppt
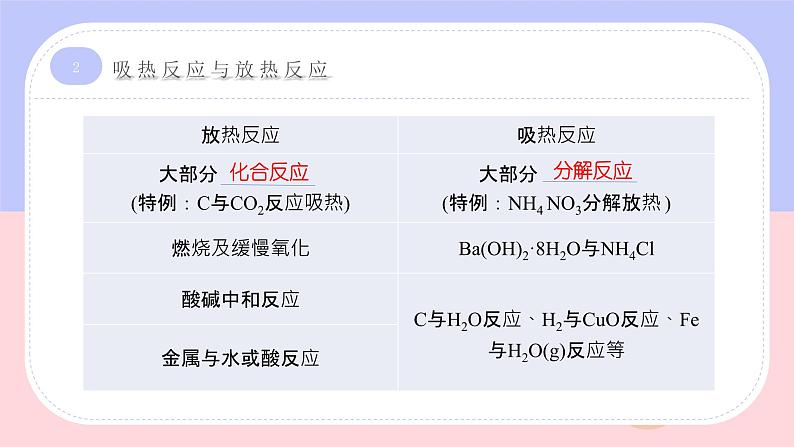
展开化学反应过程中所 或 的热量,称为该反应的热效应,简称反应热。
系统与环境1.敞开系统:系统与环境间即有物质交换,又有 能量交换2.封闭系统:系统与环境间没有物质交换,只有 能量交换3.孤立系统:系统与环境间无物质和能量的交换
计算方法:Q = mCΔt(1)其中 Q : 中和反应放出的热量; m : 反应混合液的质量; C :反应混合液的比热容;△t :反应前后溶液温度差;(2)因为m = V酸 ρ酸+V碱 ρ碱 、V酸=V碱 =50 mL;而酸的浓度是0.50 ml/L 、碱的浓度是0.55 ml/L;且ρ酸=ρ碱=1 g/cm3 、C=4.18 J/(g·℃)。所以 Q = 0.418(t2-t1)kJ。(3)中和热计算公式:
恒压下的焓变 = 反应热
焓增加—吸热(反应)—表示为“ + ”或 ΔH>0
焓减少—放热(反应)—表示为“- ”或 ΔH<0
ΔH = – △E ΔH < 0
ΔH = +△E ΔH>0
微观 化学反应的实质
反应物中旧化学键的断裂和生成物中新化学键的形成。
由图可知:① 1ml H2分子中化学键断裂吸收能量是 。② 1ml Cl2分子中化学键断裂吸收能量是 。③ 2ml HCl分子中化学键形成释放能量是 。④ H2(g) +Cl2(g) = 2HCl(g) 的ΔH为 。
–183 kJ·ml-1
ΔH=E总(断键)-E总(成键)= 243 kJ·ml-1+436 kJ·ml-1 − 862 kJ·ml-1=–183 kJ·ml-1
能表示反应所释放或吸收的热量的化学方程式,叫做热化学方程式。
H2(g)+I2(g)======2HI(g) △H=-14.9kJ/ml
3、 1g 硫粉在氧气中充分燃烧放出 9.36kJ热量,写出硫燃烧的热化学方程式。
4、 44g 气态CO2 与中碳反应生成CO,吸收 33. 6kJ热量,写出该反应的热化学方程式。
H2(g)+Cl2(g)=2HCl(g) ∆H =-184.6 kJ/ml
1、当1ml气态H2与1ml气态Cl2反应生成2ml气态HCl,放出184.6KJ的热量,请写出该反应的热化学方程式。
2、 2mlCu(s)与适量O2(g)反应生成CuO(s),放出314kJ热量。
2Cu(s)+O2(g)=2CuO(s) △H= -314 kJ /ml
S(s)+O2(g)=SO2(g) △H= -299.52 kJ /ml
C(s)+CO2(g)=2CO(g) △H= +33.6 kJ /ml
定义:在25℃、101kPa时,1ml纯物质完全燃烧生成稳定的氧化物时所放出的热量。
深度理解①研究条件: 25℃ ,101 kPa②反应程度:完全燃烧,产物是稳定的氧化物。③燃烧物的物质的量:1 ml④研究内容:放出的热量。(ΔH<0,单位kJ/ml)⑤在未有特别说明的情况下,外界温度,压强一般指25℃,101 kPa。所谓完全燃烧也是完全氧化,它是指物质中的下列元素完全转变成对应的稳定物:C →CO2(g)、H →H2O(l)、S→SO2(g)
[例题]在101 kPa时,1 ml CH4 完全燃烧生成CO2和液态 H2O,放出890.3 kJ的热量,CH4的燃烧热为多少? 1000 L CH4(标准状况)燃烧后所产生的热量为多少?
解析:根据题意,在101 kPa时,1 ml CH4完全燃烧的热化学方程式为:CH4(g)+2O2(g)==CO2(g)+2H2O(l)ΔH=-890.3 kJ/ml即CH4的燃烧热为890.3 kJ/ml。 1000 L CH4(标准状况)的物质的量为: n(CH4)= =44.6 ml
Q放= n(CH4) ⅹ △H = 44.6 ml×890.3 kJ/ml = 3.97×104 kJ
燃烧热与中和热的区别与联系
ΔH<0 , 单位 kJ/ml
1ml反应物完全燃烧时放出的热量;不同的物质燃烧热不同
酸碱中和生成1ml H2O时放出的热量,强酸强碱间的中和反应中和热大致相同,均约为57.3kJ/ml
苏教版 (2019)选择性必修1专题1 化学反应与能量第一单元 化学反应的热效应评课ppt课件: 这是一份苏教版 (2019)选择性必修1<a href="/hx/tb_c4009310_t3/?tag_id=26" target="_blank">专题1 化学反应与能量第一单元 化学反应的热效应评课ppt课件</a>,共60页。PPT课件主要包含了减少热量的散失,简易量热计,环形玻璃搅拌棒,分几步,完全相等,搅拌使溶液充分混合,温度计,测量溶液的温度等内容,欢迎下载使用。
高中化学第1章 化学反应与能量转化第1节 化学反应的热效应教案配套ppt课件: 这是一份高中化学<a href="/hx/tb_c4002573_t3/?tag_id=26" target="_blank">第1章 化学反应与能量转化第1节 化学反应的热效应教案配套ppt课件</a>,共20页。PPT课件主要包含了化学反应的反应热,2符号Q,Q>0Q<0,反应热,反应热的测定,保温作用,反应容器,热容与比热,3计算公式,测定中和反应的反应热等内容,欢迎下载使用。
2020-2021学年第一章 化学反应的热效应第一节 反应热课文课件ppt: 这是一份2020-2021学年第一章 化学反应的热效应第一节 反应热课文课件ppt,共30页。PPT课件主要包含了课程目标,反应热,反应热及其测定,基础•初探,☂名师点拨,课堂•练习等内容,欢迎下载使用。













