






所属成套资源:高中化学人教版(2019)选择性必修1化学反应原理
高中人教版 (2019)第一节 电离平衡优秀教学课件ppt
展开
这是一份高中人教版 (2019)第一节 电离平衡优秀教学课件ppt,共18页。PPT课件主要包含了强电解质和弱电解质,实验3-1,醋酸的对比,弱电解质的电离平衡,影响电离平衡的条件,弱电解质的电离方程式,电离平衡常数等内容,欢迎下载使用。
盐酸常用于卫生洁具的清洁,比如某些洁厕灵有效成分是盐酸。醋酸的腐蚀性比盐酸的小,为什么不用醋酸代替盐酸呢?
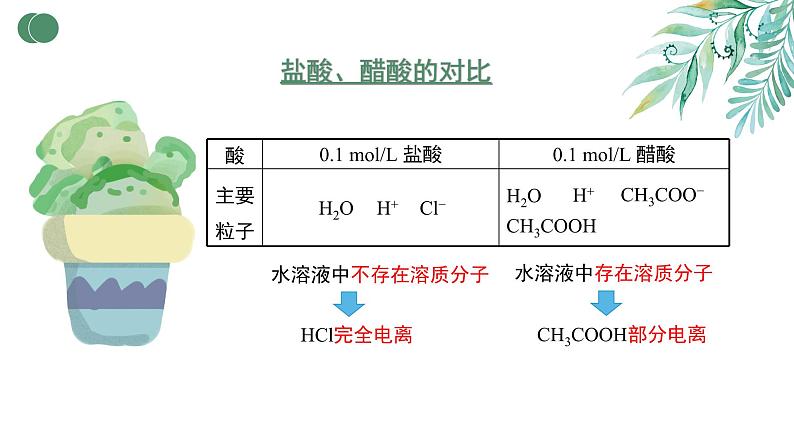
0.1 ml/L 盐酸 pH=1
0.1 ml/L 醋酸 pH=3
c(H+)=0.001 ml/L
c(H+)=0.1 ml/L
CH3COOH部分电离
水溶液中不存在溶质分子
依据电解质电离程度的差异对电解质进行分类
强电解质(在水中全 部电离)
弱电解质(在水中部分电离)
①电解质的强弱与溶液导电能力没有必然联系。电解质溶液的导电能力与离子浓度和离子所带电荷数有关,强电解质溶液的导电能力不一定强。
②电解质的强弱与其溶解度无关。某些难溶盐,虽然溶解度小,但其溶于水的部分完全电离,仍属于强电解质。有少数盐尽管能溶于水,但只有部分电离,属于弱电解质,如(CH3COO)2Pb等。
在一定条件下(如温度和浓度),弱电解质电离成离子的速率和离子结合成分子的速率 时,电离过程达到电离平衡状态。如图所示:
由于电离过程吸热,升高温度,电离平衡向电离的方向移动;降低温度,电离平衡向逆反应方向移动。
电解质溶液的浓度越小,它的电离程度就越大。
加入含有弱电解质离子的强电解质时,电离平衡向逆反应方向移动;加入能与弱电解质离子反应的物质时,电离平衡向正反应方向移动。
外界条件对电离平衡的影响(以CH3COOH CH3COO-+H+为例)
(1)弱电解质的电离方程式的书写用“ ”表示。如NH3·H2O的电离方程式是 ,CH3COOH 的电离方程式为 。
(2)多元弱酸是分步电离的,电离程度逐步减弱,可分步书写电离方程式。如H2CO3的电离方程式是_________________________________________。
(3)多元弱碱的电离也是分步进行的,但是一般按一步电离的形式书写。如Fe(OH)3的电离方程式是 。
CaCO3是卫生洁具常见的污染物之一。去污原理如下:CaCO3 + 2H+ === CO2↑ + H2O + Ca2+相同浓度盐酸比醋酸能够提供更大的c(H+),可以增大去污反应的速率。
含义:在一定条件下,当弱电解质的电离达到平衡时,溶液里各组分的浓度之间存在一定的关系。对一元弱酸或一元弱碱来说,溶液中弱电解质电离所生成的各种离子浓度的乘积,与溶液中未电离分子的浓度之比是一个常数,这个常数叫做电离平衡常数,简称电离常数。
关于电离常数的理解与应用
电离常数的大小由物质本身的性质决定,同一温度下,不同弱电解质的电离常数不同,K值越大,电离程度越大。
同一弱电解质在同一温度下改变浓度时,其电离常数不变。
电离常数K只随温度的变化而变化,升高温度,K值增大。
多元弱酸电离常数:K1>K2>K3,其酸性主要由第一步电离决定,K1值越大,相应酸的酸性越强。
相关课件
这是一份化学选择性必修1第一节 反应热一等奖教学课件ppt,共26页。PPT课件主要包含了CONTENTS,反应热及其测定,怎样计算呢,反应热与焓变,热化学方程式,燃烧热等内容,欢迎下载使用。
这是一份苏教版 (2019)选择性必修1第一单元 弱电解质的电离平衡备课课件ppt,共31页。PPT课件主要包含了×10-14,×10-15等内容,欢迎下载使用。
这是一份化学选择性必修1第一节 电离平衡一等奖ppt课件,文件包含第一节弱电解质的电离ppt、实验3-1盐酸与醋酸的电离程度的比较mp4、实验3-2强酸制弱酸mp4等3份课件配套教学资源,其中PPT共18页, 欢迎下载使用。










