




高中化学人教版 (2019)选择性必修1第三节 盐类的水解优秀教学ppt课件
展开02 影响盐类水解的主要因素
03 盐类水解的应用
Na2CO3是日常生活中常用的盐,俗称纯碱,常在面点加工时用于中和酸,也常用于油污的清洗等。为什么Na2CO3可被当作 “碱”使用呢?用纯碱溶液清洗油污时,加热可以增强其去污力,这是为什么?
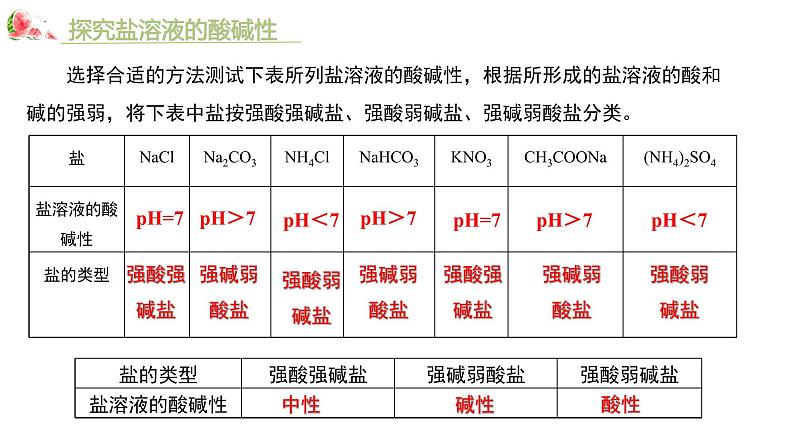
选择合适的方法测试下表所列盐溶液的酸碱性,根据所形成的盐溶液的酸和碱的强弱,将下表中盐按强酸强碱盐、强酸弱碱盐、强碱弱酸盐分类。
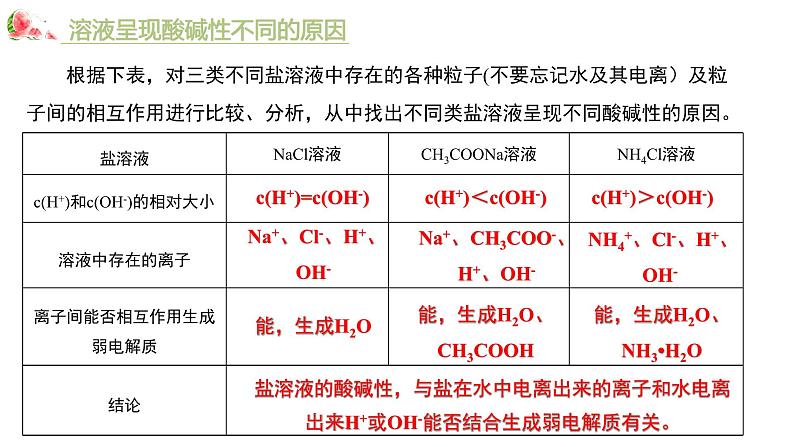
溶液呈现酸碱性不同的原因
根据下表,对三类不同盐溶液中存在的各种粒子(不要忘记水及其电离)及粒子间的相互作用进行比较、分析,从中找出不同类盐溶液呈现不同酸碱性的原因。
Na+、Cl-、H+、OH-
c(H+)=c(OH-)
NH4+、Cl-、H+、OH-
能,生成H2O、NH3•H2O
c(H+)>c(OH-)
Na+、CH3COO-、H+、OH-
能,生成H2O、CH3COOH
c(H+)<c(OH-)
盐溶液的酸碱性,与盐在水中电离出来的离子和水电离出来H+或OH-能否结合生成弱电解质有关。
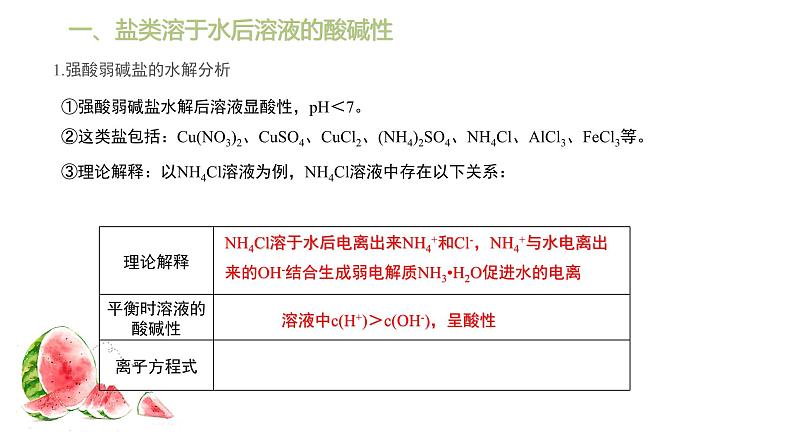
一、盐类溶于水后溶液的酸碱性
1.强酸弱碱盐的水解分析
①强酸弱碱盐水解后溶液显酸性,pH<7。②这类盐包括:Cu(NO3)2、CuSO4、CuCl2、(NH4)2SO4、NH4Cl、AlCl3、FeCl3等。
③理论解释:以NH4Cl溶液为例,NH4Cl溶液中存在以下关系:
NH4Cl溶于水后电离出来NH4+和Cl-,NH4+与水电离出来的OH-结合生成弱电解质NH3•H2O促进水的电离
溶液中c(H+)>c(OH-),呈酸性
2.强碱弱酸盐的水解分析
①强碱弱酸盐水解后溶液显酸性,pH>7。②这类盐包括:K2CO3、Na2S、Na3PO4、NaHCO3、CH3COONa等。
③理论解释:以CH3COONa溶液为例,CH3COONa溶液中存在以下关系:
CH3COONa溶于水后完全电离CH3COO-和Na+,CH3COO-与水电离出来的H+结合生成弱电解质CH3COOH促进水的电离
溶液中c(H+)<c(OH-),呈碱性
①强酸强碱溶液显中性,pH=7。②这类盐包括:KCl、Na2SO4、NaCl、K2SO4等。③理论解释: 。
NaCl 溶于水后电离产生Na+和Cl-,不能与水电离出的OH-、H+结合成难电离的物质,水的电离平衡不发生移动,c(H+)= c(OH-),溶液呈中性。
二、盐类水解的实质、条件及特点
在水溶液中,盐电离出来的离子与水电离出来的H+或OH-结合生成弱电解质的反应,破坏了水的电离平衡,促进了水的电离,使溶液显示酸性、碱性或中性。
条 件
①盐必须溶于水中。②盐中必须有弱酸根阴离子或弱碱阳离子。
特 点
①盐类的水解促进了水的电离,使溶液呈酸性、碱性或中性;②盐类的水解反应是酸碱中和反应的逆反应:③盐类水解一般是微弱的;④盐类水解是吸热反应。
1.内容:有弱才水解,无弱不水解,越弱越水解,都弱都水解,谁强显谁性,同强显中性。2.图示:
【注意】弱碱阳离子:NH4+、Al3+、Fe3+、Cu2+等。弱酸根离子:CO32-、HCO3-、AlO2-、SO32-、S2-、HS-、SiO32-、ClO-、CH3COO-、F-等。
四、盐类水解的离子方程式
一般盐类水解程度很小,水解产物很少,通常不生成沉淀和气体,也不发生分解,因此盐类水解的离子方程式中不标“↓”或“↑”,也不把生成物(如NH3·H2O、H2CO3等)写成其分解产物的形式。
盐类水解是可逆反应,是中和反应的逆反应,而中和反应是趋于完全的反应,所以盐的水解反应是微弱的,盐类水解的离子方程式一般不写“ = ”而写“ ”。
影响盐类水解的主要因素
盐类水解程度的大小,主要是由盐的性质所决定的。对于强碱弱酸盐来说,生成盐的弱酸酸性越弱,即越难电离(电离常数越小),该盐的水解程度越大。同理,对于强酸弱碱盐来说,生成盐的弱碱碱性越弱,该盐的水解程度越大。
盐类的水解是可逆反应,水解平衡也受温度、浓度等反应条件的影响。
探究盐类水解的影响因素
【提出问题】问题一:FeCl3溶液呈酸性还是碱性?写出FeCl3发生水解的离子方程式。问题二:从反应条件考虑,影响FeCl3水解平衡的因素可能有哪些?
【实验探究】实验用品:试管、试管夹、试管架、胶头滴管、pH计、药匙、酒精灯、火柴、0.01 ml/L FeCl3溶液、FeCl3晶体、浓盐酸、浓NaOH溶液
温度升高,平衡向FeCl3水解的方向移动
c(Fe3+)增大,平衡向FeCl3水解的方向移动
加入盐酸,c(H+)增大,平衡向FeCl3水解的逆反应方向移动
加入NaOH溶液,c(H+)减小,平衡向FeCl3水解的方向移动
配制易水解的盐溶液如配制FeCl3溶液时,为防止出现Fe(OH)3;沉淀,常加几滴盐酸来抑制FeCl3;的水解;在实验室盛放Na2CO3、CH3COONa、Na2S 等溶液的试剂瓶不能用磨口玻璃塞,应用橡胶塞。
判断盐溶液蒸干灼烧时所得的产物如AlCl3、FeCl3溶液蒸干后得到Al(OH)3、Fe(OH)3,灼烧后得到Al2O3、Fe2O3、 CuSO4溶液蒸干后得到CuSO4固体。
解释生活中的现象或事实如明矾净水、热纯碱溶液除油污、草木灰不能与铵盐混用、泡沫灭火器原理等。
制备某些无机化合物工业上用TiCl4制备TiO2 分析:TiCl4 +(x+2)H2O TiO2·xH2O + 4HCl,改变条件使上述平衡右移 工业方法:在制备时加入大量的水,同时加热,促使水解趋于完全,所得TiO2·xH2O经焙烧可得TiO2。
盐溶液蒸干灼烧时所得产物类型的判断
1、酸根阴离子易水解的强碱盐,如Na2CO3溶液等蒸干后可得到原物质。
3、盐溶液水解生成难挥发性酸时,蒸干后一般得原物质,如蒸干CuSO4(aq) CuSO4(s);盐溶液水解生成易挥发性酸时,蒸干灼烧后一般得对应的氧化物,如AlCl3(aq) Al(OH)3 Al2O3。
4、还原性盐在蒸干时会被O2氧化,如Na2SO3(aq)→Na2SO4(s)。
2、考虑盐受热时是否分解Ca(HCO3)2、NaHCO3、KMnO4、NH4Cl固体受热易分解,因此蒸干灼烧后分别为Ca(HCO3)2→CaCO3(CaO);NaHCO3→Na2CO3;KMnO4→K2MnO4 + MnO2;NH4Cl→NH3 ↑+HCl↑。
电解质溶液中的三个守恒
电解质溶液中无论存在多少种离子溶液总是呈电中性,即阳离子所带的正电荷总数=阴离子所带的负电荷总数。应用:如Na2CO3,溶液中存在的阳离子有Na+、H+,存在的阴离子有OH-、CO32-、HCO3-。根据电荷守恒有n(Na+) + n(H+)=n(OH-) + n(HCO3-)+2n(CO32-)。或c(Na+) + c(H+)=c(OH-) + c(HCO3-)+2c(CO32-)。
元素质量守恒(物料守恒)
在电解质溶液中,由于某些离子发生水解或电离,离子的存在形式发生了变化。就该离子所含的某种元素来说,其质量在变化前后是守恒的,即元素质量守恒。应用:如Na2CO3溶液中Na+和CO32-的原始浓度之间的关系为c(Na+)=2c(CO32-),由于CO32-发生水解,其在溶液中的存在形式除了CO32,还有HCO3-、H2CO3。根据电荷守恒有c(Na+) =2c(CO32-)+c(HCO3-)+c(H2CO3)。
如纯碱溶液中c(H+)水=c(OH-)水,c(H+)水=c(HCO3-)+2c(H2CO3)+c(H+),所以c(OH-)水=c(HCO3-)+2c(H2CO3)+c(H+)。现分别以Na2CO3和NaHCO3溶液为例,用以下图示帮助我们来理解质子守恒: 所以c(OH-)=c(HCO3-)+2c(H2CO3)+c(H3O+),即c(OH-)=c(HCO3-)+2c(H2CO3)+c(H+);所以c(OH-)+c(CO32-)=c(H2CO3)+c(H+)
高中人教版 (2019)第二节 电解池获奖教学课件ppt: 这是一份高中人教版 (2019)<a href="/hx/tb_c4002435_t3/?tag_id=26" target="_blank">第二节 电解池获奖教学课件ppt</a>,共20页。PPT课件主要包含了情景课堂,黄铜矿,景泰蓝工艺品,浸出液主要成分,电解精炼,电解原理,Cl2,CuCl2溶液,电解池,电解产物的判断方法等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修1第一节 原电池评优课教学课件ppt: 这是一份高中化学人教版 (2019)选择性必修1<a href="/hx/tb_c4002434_t3/?tag_id=26" target="_blank">第一节 原电池评优课教学课件ppt</a>,共18页。PPT课件主要包含了水果可以发电吗,化学能,2构成条件,电解质,自发的氧化还原,氧化反应,还原反应,思考讨论,原电池的设计,闭合回路等内容,欢迎下载使用。
高中人教版 (2019)第一节 电离平衡优秀教学课件ppt: 这是一份高中人教版 (2019)<a href="/hx/tb_c4002426_t3/?tag_id=26" target="_blank">第一节 电离平衡优秀教学课件ppt</a>,共18页。PPT课件主要包含了强电解质和弱电解质,实验3-1,醋酸的对比,弱电解质的电离平衡,影响电离平衡的条件,弱电解质的电离方程式,电离平衡常数等内容,欢迎下载使用。













