


所属成套资源:高中化学人教版(2019)选择性必修1化学反应原理
高中化学人教版 (2019)选择性必修1第一节 原电池评优课教学课件ppt
展开
这是一份高中化学人教版 (2019)选择性必修1第一节 原电池评优课教学课件ppt,共18页。PPT课件主要包含了水果可以发电吗,化学能,2构成条件,电解质,自发的氧化还原,氧化反应,还原反应,思考讨论,原电池的设计,闭合回路等内容,欢迎下载使用。
01.原电池的工作原理
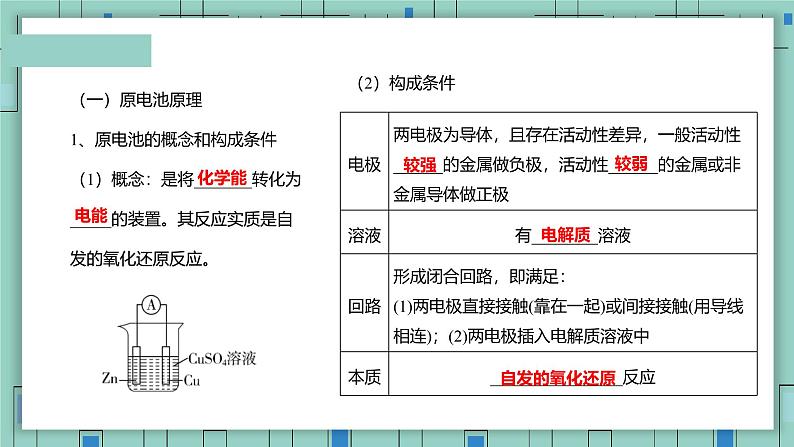
(一)原电池原理1、原电池的概念和构成条件(1)概念:是将_______转化为_____的装置。其反应实质是自发的氧化还原反应。
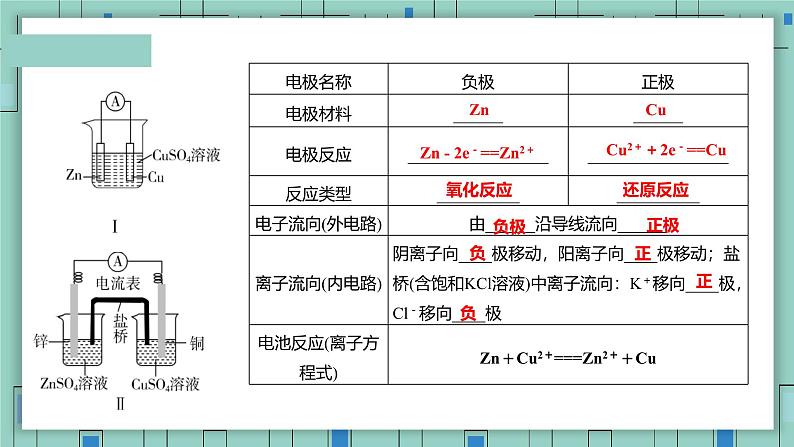
Zn - 2e-==Zn2+
Cu2++2e-==Cu
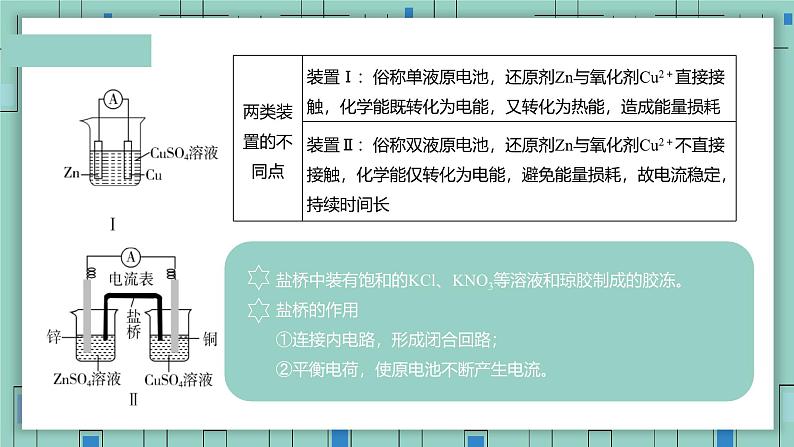
盐桥中装有饱和的KCl、KNO3等溶液和琼胶制成的胶冻。 盐桥的作用 ①连接内电路,形成闭合回路; ②平衡电荷,使原电池不断产生电流。
1.Cu、Ag与稀硫酸能否设计成原电池?
不能。Cu、Ag与稀硫酸都不能自发地发生氧化还原反应。
2.试分析铁、铜作电极,浓硝酸为电解质溶液构成原电池的正、负极及得失电子的情况,并写出两极的电极反应。
铁、铜及浓硝酸可构成原电池,由于常温下,铁在浓硝酸中发生钝化,铜会溶解,发生反应Cu+4HNO3(浓) == Cu(NO3)2+2NO2↑+2H2O,反应中铜失去电子,作负极;NO3-得到电子,铁作正极。负极反应为Cu-2e- == Cu2+,正极反应为4H++2NO3-+2e- == 2NO2↑+2H2O。
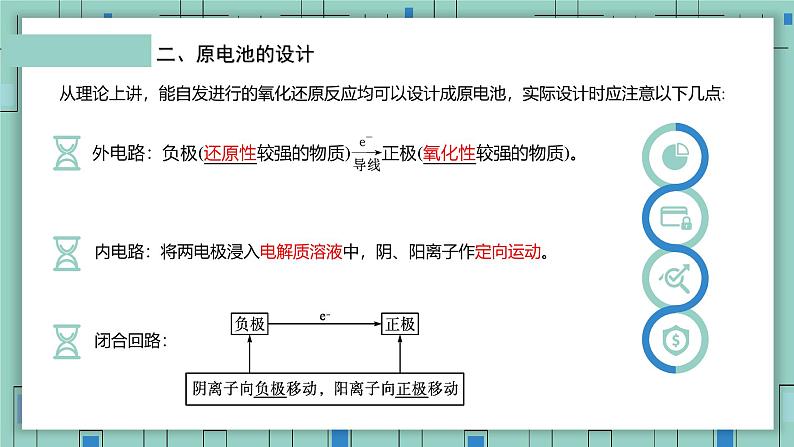
从理论上讲,能自发进行的氧化还原反应均可以设计成原电池,实际设计时应注意以下几点:
内电路:将两电极浸入电解质溶液中,阴、阳离子作定向运动。
(1)增大氧化还原反应速率 如实验室用Zn和稀硫酸反应制H2,常用粗锌,它产生H2的速率大。原因是粗锌中的杂质和锌、稀硫酸形成原电池,增大了锌与稀硫酸的反应速率,使产生H2的速率增大。
(2)比较金属的活动性强弱原电池中,负极一般为活动性较强的金属,正极一般为活动性较弱的金属或能导电的非金属。
(3)设计原电池①首先将氧化还原反应分成两个半反应②根据原电池的反应特点,结合两个半反应找出正、负极材料和电解质溶液
1、分类一次电池(干电池): 电池消耗到一定程度,就不能使用;二次电池(充电电池或蓄电池): 放电后可以再充电重新使用;燃料电池: 一种将燃料和氧化剂的化学能直接转换成电能的化学电池。
1、 普通锌锰电池(碱性)
(1)组成: 正极:MnO2 负极:Zn 电解质:KOH(2)工作原理: 负极反应:Zn+2OH--2e- === Zn(OH)2; 正极反应:2MnO2+2e-+2H2O === 2MnO(OH)+2OH-; 总反应:Zn+2MnO2+2H2O === 2MnO(OH)+Zn(OH)2。
2、二次电池 (以铅酸蓄电池为例)
(1)组成: 负极:Pb 正极:PbO2 电解质:H2SO4溶液
(2)工作原理: 铅酸蓄电池是最常见的二次电池,其电极反应分为放电和充电两个过程。①放电过程的电极反应、总反应:
负极:Pb(s)+SO42-(aq)-2e- = PbSO4(s);正极:PbO2(s)+4H+(aq)+SO42-(aq)+2e- = PbSO4(s)+2H2O;总反应:Pb(s)+PbO2(s)+2H2SO4(aq) = 2PbSO4(s)+2H2O(l)。
②铅酸蓄电池的充、放电过程:
3、燃料电池(以酸性氢氧燃料电池为例)
(1)组成: 负极:H2 正极:O2 电解质:酸溶液或碱溶液
(2)氢氧燃料电池在不同介质中的电极反应式
怎样书写燃料电池的电极反应式和总反应式?
(1)写出燃烧反应,根据电解液改写燃料电池总反应;(2)写出正极的电极反应式(一般较简单);(3)由燃料电池总反应减去正极的电极反应式得负极的电极反应式。(4)正极反应一般为 ①酸性介质O2 + 4H+ + 4e-=2H2O ②碱性介质O2+2H2O+4e-=4OH-
CH4燃料电池(1)碱性介质燃烧总化学反应:CH4+2O2 = CO2+2H2O燃料电池总反应: CH4+2OH-+2O2 = CO3 2 -+3H2O正极:2O2+4H2O+8e-= 8OH-负极:CH4+10OH--8e-= CO32-+7H2O
(2)酸性介质燃料电池总反应:CH4+2O2=CO2+2H2O ①正极反应:O2+4H++4e-=2H2O ②负极反应:①-②×2,得:CH4-8e-+2H2O=CO2+8H+
甲醇燃料电池(1)酸性介质 总反应: 2CH4O + 3O2 === 2CO2 + 4H2O 正极的电极反应式为:3O2+12e-+12H+ === 6H2O 负极的电极反应式为:2CH4O-12e-+2H2O == 12H++ 2CO2(2)碱性介质 总反应式:2CH4O + 3O2 +4KOH == 2K2CO3 + 6H2O 正极的电极反应式为:3O2+12e- + 6H2O==12OH- 负极的电极反应式为:2CH4O -12e-+16OH- == 2CO32- + 12H2O
相关课件
这是一份高中人教版 (2019)第一节 电离平衡优秀教学课件ppt,共18页。PPT课件主要包含了强电解质和弱电解质,实验3-1,醋酸的对比,弱电解质的电离平衡,影响电离平衡的条件,弱电解质的电离方程式,电离平衡常数等内容,欢迎下载使用。
这是一份化学选择性必修1第四节 化学反应的调控评优课教学课件ppt,共13页。PPT课件主要包含了合成氨反应的特点,想一想,从化学平衡分析,从化学反应速率分析,综合分析,课堂小结等内容,欢迎下载使用。
这是一份化学选择性必修1第三节 化学反应的方向试讲课教学ppt课件,共15页。PPT课件主要包含了深入理解,化学反应方向的焓判据,想一想,化学反应方向的熵判据,熵判据,复合判据等内容,欢迎下载使用。









