



所属成套资源:高中化学人教版(2019)选择性必修1化学反应原理
选择性必修1第四章 化学反应与电能第三节 金属的腐蚀与防护优秀教学课件ppt
展开
这是一份选择性必修1第四章 化学反应与电能第三节 金属的腐蚀与防护优秀教学课件ppt,共14页。PPT课件主要包含了情景课堂,金属的腐蚀,钢铁的电化学腐蚀,金属的防护,答案D等内容,欢迎下载使用。
1、金属腐蚀(1)定义:金属或合金与周围的气体或液体发生氧化还原反应而引起损耗的过程。(2)本质:金属原子 电子变为 ,发生 反应。
2、金属的化学腐蚀(1)定义:金属与其表面接触的一些物质(如O2、Cl2、SO2等)直接反应而引起的腐蚀。(2)特点:反应简单、金属与氧化剂之间的氧化还原反应。
3、电化学腐蚀:不纯的金属与电解质溶液接触,会发生原电池反应,比较活泼的金属发生氧化反应而被腐蚀。
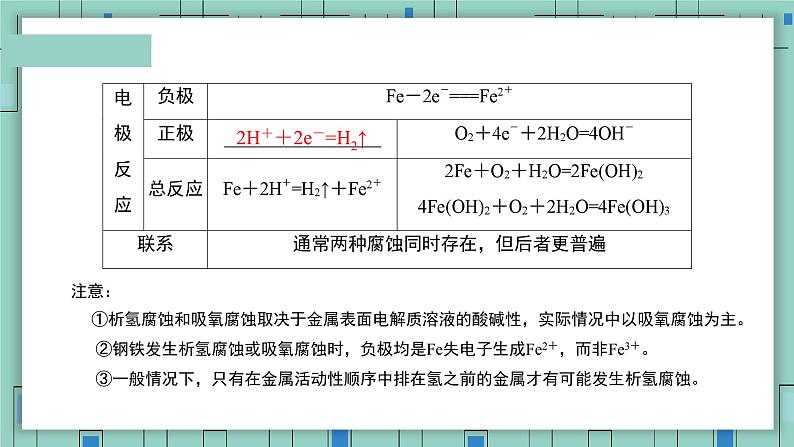
2H++2e-=H2↑
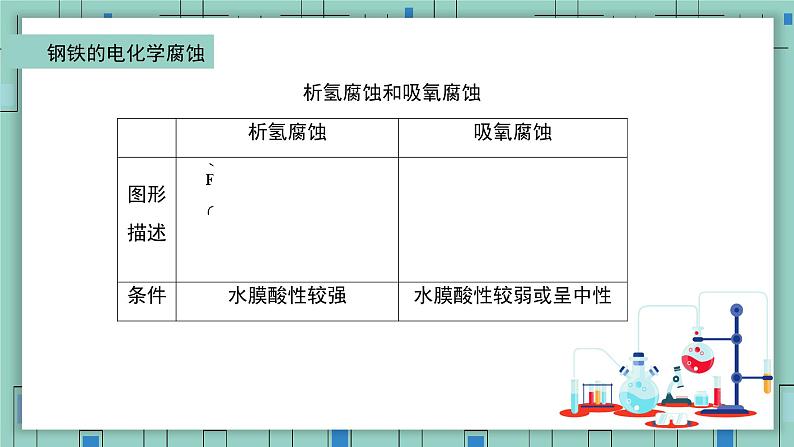
注意: ①析氢腐蚀和吸氧腐蚀取决于金属表面电解质溶液的酸碱性,实际情况中以吸氧腐蚀为主。 ②钢铁发生析氢腐蚀或吸氧腐蚀时,负极均是Fe失电子生成Fe2+,而非Fe3+。 ③一般情况下,只有在金属活动性顺序中排在氢之前的金属才有可能发生析氢腐蚀。
不同条件下金属腐蚀快慢的判断
(1)各种腐蚀的程度:电解原理引起的腐蚀(即电解池的阳极)>原电池原理 引起的腐蚀(即原电池的负极)>化学腐蚀>有防护措施的腐蚀(即电解 池的阴极、原电池的正极及加有镀层的金属等)。(2)活动性不同的两金属,活动性越强,腐蚀得越快。(3)对同一种金属来说,腐蚀快慢的规律如下: 强电解质溶液>弱电解质溶液>非电解质溶液。
1、金属防护的原理 金属防护就是防止 ,要解决的主要问题是使金属不被氧化,应从金属腐蚀的 、腐蚀的类型等方面来确定金属防护的具体方法。
2、金属防护方法(1)改变金属材料的组成 如把铬、镍等加入普通钢里制成不锈钢,就大大增加了钢铁对侵蚀的抵抗力。(2)在金属表面覆盖保护层 a.在钢铁表面涂矿物性油脂、油漆或覆盖搪瓷、塑料等物质。 b.用电镀的方法,在钢铁制品表面镀上一层不易被腐蚀的金属,如锌、锡、铬、镍等。 c.工业上常利用一些溶液的氧化作用,在机器零件、精密仪器、枪炮等钢铁制件的表面上形成一层致密的黑色的四氧化三铁薄膜。
(3)电化学保护法 ①牺牲阳极的阴极保护法:利用_______原理,让被保护 金属作___极,另找一种活泼性较强的金属作___极。如图所示:
②外加电池的阴极保护法:利用______原理,把被保护的钢铁设备作为___极,用惰性电极作为辅助___极,在电解质溶液里,接外加_________。如图所示。
1.为探究钢铁的吸氧腐蚀原理设计了如图所示装置,下列有关说法中错误的是 ( )A.正极的电极反应式为O2+2H2O+4e- = 4OH-B.将石墨电极改成Mg电极,难以观察到铁锈生成C.若向自来水中加入少量NaCl(s),可较快地看到铁锈D.分别向铁、石墨电极附近吹入O2,前者铁锈出现得快
2.为保护地下钢管不受腐蚀,下列属于牺牲阳极的阴极保护法的是( ) A.与石墨棒相连 B.与铜板相连 C.埋在潮湿、疏松的土壤 D.与锌板相连
D [A项,石墨棒与铁构成原电池,铁活泼失电子作负极,被腐蚀;B项,铜板与铁构成原电池,铁比铜活泼,失电子作负极,被腐蚀;C项,在潮湿、疏松的土壤中,铁与水、空气构成原电池,氧气得电子,铁失电子,被腐蚀;D项,锌板与铁构成原电池,锌比铁活泼,锌失电子作负极,锌被腐蚀,铁被保护。]
相关课件
这是一份高中人教版 (2019)第二节 电解池获奖教学课件ppt,共20页。PPT课件主要包含了情景课堂,黄铜矿,景泰蓝工艺品,浸出液主要成分,电解精炼,电解原理,Cl2,CuCl2溶液,电解池,电解产物的判断方法等内容,欢迎下载使用。
这是一份高中化学人教版 (2019)选择性必修1第一节 原电池评优课教学课件ppt,共18页。PPT课件主要包含了水果可以发电吗,化学能,2构成条件,电解质,自发的氧化还原,氧化反应,还原反应,思考讨论,原电池的设计,闭合回路等内容,欢迎下载使用。
这是一份高中人教版 (2019)第一节 电离平衡优秀教学课件ppt,共18页。PPT课件主要包含了强电解质和弱电解质,实验3-1,醋酸的对比,弱电解质的电离平衡,影响电离平衡的条件,弱电解质的电离方程式,电离平衡常数等内容,欢迎下载使用。










