



所属成套资源:新高考化学一轮复习讲与练 (2份打包,原卷版+解析版)
新高考化学一轮复习讲与练 第17讲 电解池 金属的腐蚀与防护(讲)(2份打包,原卷版+解析版)
展开
这是一份新高考化学一轮复习讲与练 第17讲 电解池 金属的腐蚀与防护(讲)(2份打包,原卷版+解析版),文件包含新高考化学一轮复习讲与练第17讲电解池金属的腐蚀与防护讲原卷版doc、新高考化学一轮复习讲与练第17讲电解池金属的腐蚀与防护讲解析版doc等2份试卷配套教学资源,其中试卷共34页, 欢迎下载使用。
变化观念与平衡思想:认识化学变化的本质是有新物质生成,并伴有能量的转化;能多角度、动态地分析电解池中发生的反应,并运用电解原理解决实际问题。
证据推理与模型认知:利用电解池装置,分析电解原理,建立解答电解池问题的思维模型,并利用模型揭示其本质及规律。
科学态度与社会责任:肯定电解原理对社会发展的重大贫献,具有可持续发展意识和绿色化学观念,能对与电解有关的社会热点问题做出正确的价值判断。
【必备知识解读】
一、电解的原理
1.电解和电解池
(1)电解:在电流作用下,电解质在两个电极上分别发生氧化反应和还原反应的过程。
(2)电解池:电能转化为化学能的装置。
(3)电解池的构成
①有与电源相连的两个电极。
②电解质溶液(或熔融电解质)。
③形成闭合回路。
2.电解池的工作原理
(1)电极名称及电极反应式(电解CuCl2溶液为例)
总反应式:CuCl2eq \(=====,\s\up7(电解))Cu+Cl2↑
(2)电子和离子的移动方向
①电子:从电源负极流出后,流向电解池阴极;从电解池的阳极流出后流向电源的正极。
②离子:阳离子移向电解池的阴极,阴离子移向电解池的阳极。
3.阴阳两极上放电顺序
(1)阴极:(与电极材料无关)。氧化性强的先放电,放电顺序:
(2)阳极:若是活性电极作阳极,则活性电极首先失电子,发生氧化反应。
若是惰性电极作阳极,放电顺序为
【特别提醒】①阴极不管是什么材料,电极本身都不反应,一定是溶液(或熔融电解质)中的阳离子放电。②最常用、最重要的放电顺序为阳极:Cl->OH-;阴极:Ag+>Cu2+>H+。③电解水溶液时,K+~Al3+不可能在阴极放电,即不可能用电解水溶液的方法得到K、Ca、Na、Mg、Al等金属。
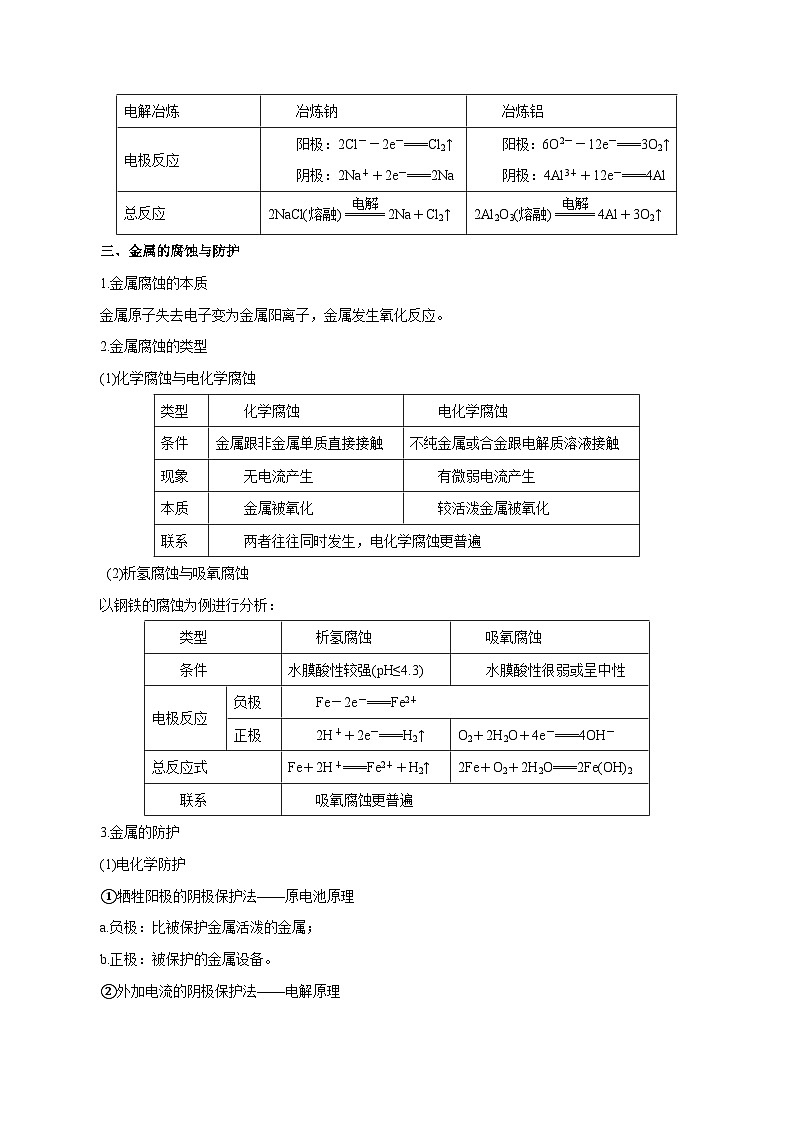
二、电解原理的应用
1.氯碱工业
阳极反应式:2Cl--2e-===Cl2↑(氧化反应)
阴极反应式:2H++2e-===H2↑(还原反应)
总反应方程式:
2NaCl+2H2Oeq \(=====,\s\up7(电解))2NaOH+H2↑+Cl2↑
2.电镀与电解精炼
3.电冶金
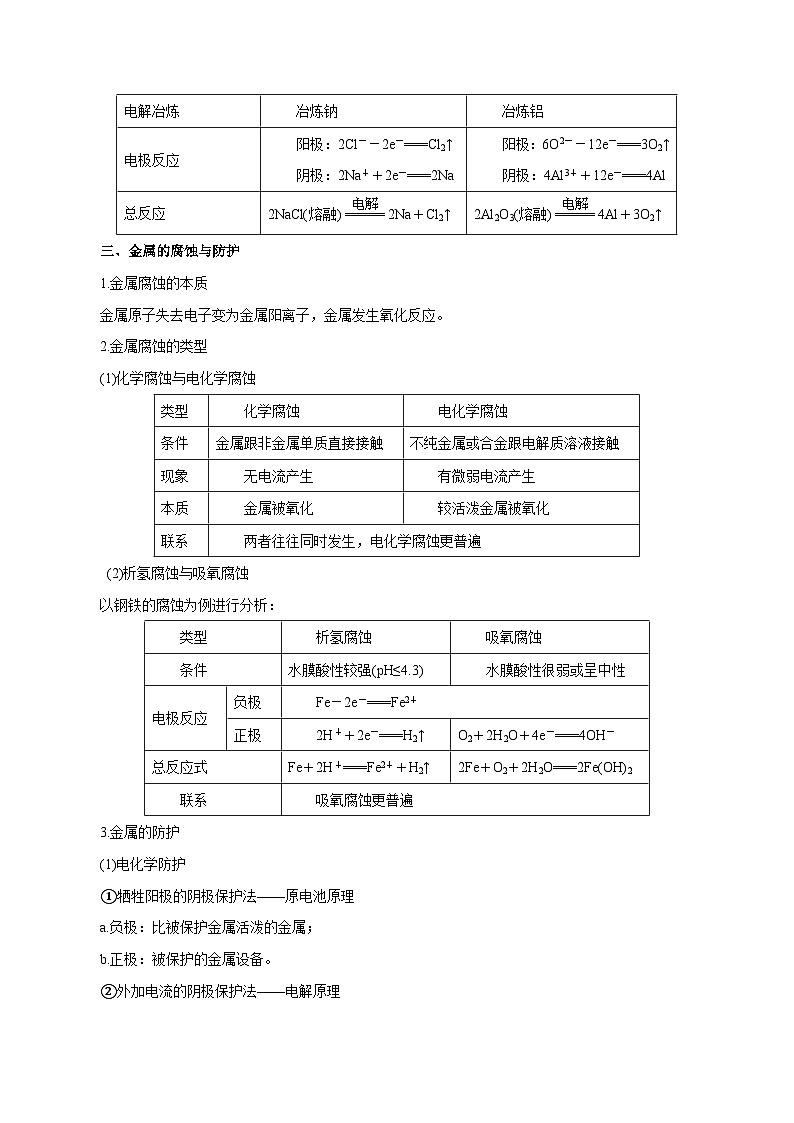
三、金属的腐蚀与防护
1.金属腐蚀的本质
金属原子失去电子变为金属阳离子,金属发生氧化反应。
2.金属腐蚀的类型
(1)化学腐蚀与电化学腐蚀
(2)析氢腐蚀与吸氧腐蚀
以钢铁的腐蚀为例进行分析:
3.金属的防护
(1)电化学防护
①牺牲阳极的阴极保护法——原电池原理
a.负极:比被保护金属活泼的金属;
b.正极:被保护的金属设备。
②外加电流的阴极保护法——电解原理
a.阴极:被保护的金属设备;
b.阳极:惰性金属或石墨。
(2)改变金属的内部结构,如制成合金、不锈钢等。
(3)加防护层,如在金属表面喷油漆、涂油脂、电镀、喷镀或表面钝化等方法。
【关键能力拓展】
1.电解池与原电池的比较
2.电解规律
(1)阳极放电规律
①活性电极(除Au、Pt以外的金属材料作电极),电极材料失电子,生成金属阳离子。
②惰性电极(Pt、Au、石墨),要依据阴离子的放电顺序加以判断。
阴离子的放电顺序:S2->I->Br->Cl->OH->含氧酸根离子。
S2-、I-、Br-、Cl-放电,产物分别是S、I2、Br2、Cl2;若OH-放电,则得到H2O和O2。
(2)阴极产物的判断
直接根据阳离子放电顺序进行判断。
阳离子放电顺序:Ag+>Fe3+>Cu2+>H+(酸)>Fe2+>Zn2+>H+(水)>Al3+>Mg2+。
注意 电解水溶液时,Al3+、Mg2+、Na+、K+不可能在阴极放电。
(3)用惰性电极电解不同类型电解质溶液
①电解水型
②电解电解质型
③电解质和水均参与电解型
3.金属腐蚀快慢的规律
三、电解计算中常用的方法
(1)根据总反应式计算
先写出电极反应式,再写出总反应式,最后根据总反应式列出比例式计算。
(2)根据得失电子守恒计算
①用于串联电路中阴阳两极产物、正负两极产物、相同电量等类型的计算,其依据是电路中转移的电子数相等。
②用于混合溶液中电解的分阶段计算。
③根据得失电子守恒定律建立起已知量与未知量之间的桥梁,构建计算所需的关系式。
如以通过4 ml e-为桥梁可构建如下关系式:
该关系式具有总揽电化学计算的作用和价值,熟记电极反应式,灵活运用关系式便能快速解答常见的电化学计算问题。
四、隔膜电解池在工业生产中的应用
1.常见的隔膜
隔膜又叫离子交换膜,由高分子特殊材料制成。离子交换膜分三类:
(1)阳离子交换膜,简称阳膜,只允许阳离子通过,不允许阴离子通过。
(2)阴离子交换膜,简称阴膜,只允许阴离子通过,不允许阳离子通过。
(3)质子交换膜,只允许H+通过,不允许其他阳离子和阴离子通过。
2.隔膜的作用
(1)能将两极区隔离,阻止两极区产生的物质接触,防止发生化学反应。
(2)能选择性的通过离子,起到平衡电荷、形成闭合回路的作用。
3.“隔膜”电解池的解题步骤
第一步,分清隔膜类型。即交换膜属于阳膜、阴膜或质子膜中的哪一种,判断允许哪种离子通过隔膜。
第二步,写出电极反应式,判断交换膜两侧离子变化,推断电荷变化,根据电荷平衡判断离子迁移方向。
第三步,分析隔膜作用。在产品制备中,隔膜作用主要是提高产品纯度,避免产物之间发生反应,或避免产物因发生反应而造成危险。
【核心题型例解】
高频考点一 电解原理
例1.(2023·浙江选考1月第11题)在熔融盐体系中,通过电解TiO2和SiO2获得电池材料(TiSi),电解装置如图,下列说法正确的是( )
A. 石墨电极为阴极,发生氧化反应
B. 电极A的电极反应:
C. 该体系中,石墨优先于Cl-参与反应
D. 电解时,阳离子向石墨电极移动
【变式探究】(2022·广东卷)以熔融盐为电解液,以含和等的铝合金废料为阳极进行电解,实现的再生。该过程中
A. 阴极发生的反应为B. 阴极上被氧化
C. 在电解槽底部产生含的阳极泥D. 阳极和阴极的质量变化相等
【变式探究】电解食盐水间接氧化法去除工业废水中氨氮的原理如图所示,通过电解氨氮溶液(含有少量的NaCl),将转化为(无逸出),下列说法正确的是
A.M为负极B.N极附近pH值不变化
C.D.电解后上升
【举一反三】采用如图装置可除去化石燃料开采、加工过程产生的H2S废气,已知电解池中的两个电极均为情性电极。下列说法正确的是
A.电极a与电源的负极相连
B.交换膜可以是阳离子交换膜
C.反应池中H2S被Fe3+还原为S单质
D.随着电解的进行,电极b处溶液的碱性增强
高频考点二 电极反应式的书写与判断
例2.(2023·湖北卷第10题)我国科学家设计如图所示的电解池,实现了海水直接制备氢气技术的绿色化。该装置工作时阳极无生成且KOH溶液的浓度不变,电解生成氢气的速率为。下列说法错误的是( )
A. b电极反应式为
B. 离子交换膜为阴离子交换膜
C. 电解时海水中动能高的水分子可穿过PTFE膜
D. 海水为电解池补水的速率为
【变式探究】(2022·浙江卷)通过电解废旧锂电池中的可获得难溶性的和,电解示意图如下(其中滤布的作用是阻挡固体颗粒,但离子可自由通过。电解过程中溶液的体积变化忽略不计)。下列说法不正确的是
A.电极A为阴极,发生还原反应
B.电极B的电极发应:
C.电解一段时间后溶液中浓度保持不变
D.电解结束,可通过调节除去,再加入溶液以获得
【方法技巧】①书写电解池的电极反应式时,可以用实际放电的离子表示,但书写电解池的总反应时,弱电解质要写成分子式。
如用惰性电极电解食盐水时,阴极反应式为2H++2e-===H2↑(或2H2O+2e-===H2↑+2OH-);总反应离子方程式为2Cl-+2H2Oeq \(=====,\s\up7(电解))2OH-+H2↑+Cl2↑。
②电解水溶液时,应注意放电顺序,位于H+、OH-之后的离子一般不参与放电。
③Fe3+在阴极上放电时生成Fe2+而不是得到单质Fe。
【变式探究】利用光伏电池与膜电解法制备Ce(SO4)2溶液的装置如下图所示,下列说法不正确的是
A.电解池中阴极的电极反应式为
B.该离子交换膜为阴离子交换膜, 由左池向右池迁移
C.该光伏电池的N电极为负极
D.电路中有0.1ml电子通过时,阳极室生成33.2g Ce(SO4)2
高频考点三 电子守恒在电化学计算中的应用
例3.(2023·全国甲卷第6题)用可再生能源电还原时,采用高浓度的抑制酸性电解液中的析氢反应来提高多碳产物(乙烯、乙醇等)的生成率,装置如下图所示。下列说法正确的是
A. 析氢反应发生在电极上
B. 从电极迁移到电极
C. 阴极发生的反应有:
D. 每转移电子,阳极生成气体(标准状况)
【变式探究】(2022·山东卷)设计如图装置回收金属钴。保持细菌所在环境pH稳定,借助其降解乙酸盐生成,将废旧锂离子电池的正极材料转化为,工作时保持厌氧环境,并定时将乙室溶液转移至甲室。已知电极材料均为石墨材质,右侧装置为原电池。下列说法正确的是
A. 装置工作时,甲室溶液pH逐渐增大
B. 装置工作一段时间后,乙室应补充盐酸
C. 乙室电极反应式为
D. 若甲室减少,乙室增加,则此时已进行过溶液转移
【方法技巧】电化学综合计算的三种常用方法
(1)根据总反应式计算
先写出电极反应式,再写出总反应式,最后根据总反应式列出比例式计算。
(2)根据电子守恒计算
①用于串联电路中阴阳两极产物、正负两极产物、相同电量等类型的计算,其依据是电路中转移的电子数相等。
②用于混合溶液中电解的分阶段计算。
(3)根据关系式计算
根据得失电子守恒定律建立起已知量与未知量之间的桥梁,构建计算所需的关系式。
【变式探究】CO2资源化利用是实现碳中和的一种有效途径,如图是CO2在电催化下产生合成气(CO和H2)的一种方法(不考虑CO2的溶解)。下列说法正确的是电源
A.电极a与电源的正极相连
B.每消耗22.4L(标况下),个透过离子交换膜进入b极区
C.a极区中逐渐增大,b极区逐渐增大
D.外电路转移1ml电子,阳极区溶液质量增加48g
高频考点四 电解原理的应用
例4.(2023·辽宁卷第7题)某无隔膜流动海水电解法制H2的装置如下图所示,其中高选择性催化剂可抑制产生。下列说法正确的是( )
A. b端电势高于a端电势 B. 理论上转移生成
C. 电解后海水下降 D. 阳极发生:
【变式探究】(2022·北京,13)利用下图装置进行铁上电镀铜的实验探究。
下列说法不正确的是( )
A.①中气体减少,推测是由于溶液中c(H+)减少,且Cu覆盖铁电极,阻碍H+与铁接触
B.①中检测到Fe2+,推测可能发生反应:Fe+2H+===Fe2++H2↑、Fe+Cu2+===Fe2++Cu
C.随阴极析出Cu,推测②中溶液c(Cu2+)减少,Cu2++4NH3[Cu(NH3)4]2+平衡逆移
D.②中Cu2+生成[Cu(NH3)4]2+,使得c(Cu2+)比①中溶液的小,Cu缓慢析出,镀层更致密
【举一反三】(2023·浙江卷6月第13题)氯碱工业能耗大,通过如图改进的设计可大幅度降低能耗,下列说法不正确的是
A. 电极A接电源正极,发生氧化反应
B. 电极B的电极反应式为:
C. 应选用阳离子交换膜,在右室获得浓度较高的NaOH溶液
D. 改进设计中通过提高电极B上反应物的氧化性来降低电解电压,减少能耗
高频考点五 金属腐蚀与防护
例5.(2022·广东卷)为检验牺牲阳极的阴极保护法对钢铁防腐的效果,将镀层有破损的镀锌铁片放入酸化的溶液中。一段时间后,取溶液分别实验,能说明铁片没有被腐蚀的是
A. 加入溶液产生沉淀 B. 加入淀粉碘化钾溶液无蓝色出现
C. 加入溶液无红色出现 D. 加入溶液无蓝色沉淀生成
【方法技巧】判断金属腐蚀快慢的规律
(1)对同一电解质溶液来说,腐蚀速率的快慢:电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防护措施的腐蚀。
(2)对同一金属来说,在不同溶液中腐蚀速率的快慢:强电解质溶液中>弱电解质溶液中>非电解质溶液中。
(3)活动性不同的两种金属,活动性差别越大,腐蚀速率越快。
(4)对同一种电解质溶液来说,电解质浓度越大,金属腐蚀越快。
【变式探究】“北溪”天然气管道至少泄漏8万吨天然气,近20年间甲烷的温室效应率是的84倍。已知管道接口处有钢铁材料等,海水的pH约为8.0。设为阿伏伽德罗常数的值。下列有关叙述不正确的是
A.损坏的钢铁材料在海水中主要发生吸氧腐蚀
B.制造管道时表面涂层能起到抗腐蚀作用
C.铁在海水中完全发生电化学腐蚀时转移电子数一定为
D.修复管道时在钢管表面镶嵌锌块,这种方法叫牺牲阳极法
【举一反三】支撑海港码头基础的防腐技术,工作原理如图所示,其中高硅铸铁为惰性辅助阳极。下列有关表述正确的是
A.高硅铸铁作用为传递电流和损耗阳极材料
B.通电后外电路电子被强制从钢管桩流向高硅铸铁
C.通入保护电流使钢管桩表面腐蚀电流接近于零
D.该防腐技术为牺牲阳极的阴极保护法
电镀
电解精炼铜
示意图
电极反应
阳极
Cu-2e-===Cu2+
Zn-2e-===Zn2+,Cu-2e-===Cu2+
阴极
Cu2++2e-===Cu
Cu2++2e-===Cu
电解质溶液的浓度变化
CuSO4溶液的浓度不变
CuSO4溶液的浓度变小
电解冶炼
冶炼钠
冶炼铝
电极反应
阳极:2Cl--2e-===Cl2↑
阴极:2Na++2e-===2Na
阳极:6O2--12e-===3O2↑
阴极:4Al3++12e-===4Al
总反应
2NaCl(熔融)eq \(=====,\s\up7(电解))2Na+Cl2↑
2Al2O3(熔融)eq \(=====,\s\up7(电解))4Al+3O2↑
类型
化学腐蚀
电化学腐蚀
条件
金属跟非金属单质直接接触
不纯金属或合金跟电解质溶液接触
现象
无电流产生
有微弱电流产生
本质
金属被氧化
较活泼金属被氧化
联系
两者往往同时发生,电化学腐蚀更普遍
类型
析氢腐蚀
吸氧腐蚀
条件
水膜酸性较强(pH≤4.3)
水膜酸性很弱或呈中性
电极反应
负极
Fe-2e-===Fe2+
正极
2H++2e-===H2↑
O2+2H2O+4e-===4OH-
总反应式
Fe+2H+===Fe2++H2↑
2Fe+O2+2H2O===2Fe(OH)2
联系
吸氧腐蚀更普遍
电解池
原电池
能否自发
使“不能”变为“能”或使“能”变为“易”
能自发进行
能量转化
电能转化为化学能
化学能转化为电能
装置
有外加电源
无外加电源
电极
由外加电源决定:
阳极:连电源的正极;
阴极:连电源的负极
由电极或反应物性质决定,称为正极或负极
反应
类型
阳极:氧化反应;
阴极:还原反应
负极:氧化反应;
正极:还原反应
离子移动
阳离子移向阴极;
阴离子移向阳极
阳离子移向正极;
阴离子移向负极
相同点
都是电极上的氧化还原反应,都必须有离子导体
实例
电极反应式及总反应式
电解质溶液浓度
复原方法
H2SO4
阴极:2H++2e-===H2↑
阳极:2H2O-4e-===4H++O2↑
总反应式:2H2Oeq \(=====,\s\up7(通电))2H2↑+O2↑
增大
加水
实例
电极反应式及总反应式
电解质溶液浓度
复原方法
HCl
阴极:2H++2e-===H2↑
阳极:2Cl--2e-===Cl2↑
总反应式:2HCleq \(=====,\s\up7(通电))H2↑+Cl2↑
减小
通入HCl
CuCl2
阴极:Cu2++2e-===Cu
阳极:2Cl--2e-===Cl2↑
总反应式:CuCl2eq \(=====,\s\up7(通电))Cu+Cl2↑
加CuCl2固体
实例
电极反应式及总反应式
电解质溶液浓度
复原方法
NaCl、KCl(放H2生碱)
阳极:2Cl--2e-===Cl2↑
阴极:2H2O+2e-===H2↑+2OH-
总反应式:2Cl-+2H2Oeq \(=====,\s\up7(通电))Cl2↑+H2↑+2OH-
减小并生成新电解质
通入
HCl气体
CuSO4、
Cu(NO3)2
(放O2
生酸)
阳极:2H2O-4e-===4H++O2↑
阴极:Cu2++2e-===Cu
总反应式:2Cu2++2H2Oeq \(=====,\s\up7(通电))2Cu+O2↑+4H+
减小并生成新电解质
加CuO
对同一电解质溶液来说,腐蚀速率的快慢
电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防护措施的腐蚀;外界条件相同时,电解质浓度越大,金属腐蚀越快
对同一金属来说,在不同溶液中腐蚀速率的快慢
强电解质溶液中>弱电解质溶液中>非电解质溶液中;活动性不同的两种金属,活动性差别越大,腐蚀速率越快
装置示意图
序号
电解质溶液
实验现象
①
0.1 ml·L-1 CuSO4+少量H2SO4
阴极表面有无色气体,一段时间后阴极表面有红色固体,气体减少。经检验电解液中有Fe2+
②
0.1 ml·L-1 CuSO4+过量氨水
阴极表面未观察到气体,一段时间后阴极表面有致密红色固体。经检验电解液中无Fe元素
相关试卷
这是一份新高考化学一轮复习讲与练 第08讲 金属材料(讲)(2份打包,原卷版+解析版),文件包含新高考化学一轮复习讲与练第08讲金属材料讲原卷版doc、新高考化学一轮复习讲与练第08讲金属材料讲解析版doc等2份试卷配套教学资源,其中试卷共32页, 欢迎下载使用。
这是一份人教版高考化学一轮复习讲义第10章第42讲 电解池 金属的腐蚀与防护(2份打包,原卷版+教师版),文件包含人教版高考化学一轮复习讲义第10章第42讲电解池金属的腐蚀与防护原卷版doc、人教版高考化学一轮复习讲义第10章第42讲电解池金属的腐蚀与防护教师版doc等2份试卷配套教学资源,其中试卷共38页, 欢迎下载使用。
这是一份高考化学一轮复习讲练测第17讲电解池金属的腐蚀与防护(练)原卷版+解析,共24页。








