

- 人教版(2024)2024-2025学年九年级化学上册提升讲义2.3.3第二单元空气和氧气(单元复习学案)(学生版+解析) 学案 3 次下载
- 人教版(2024)2024-2025学年九年级化学上册提升讲义3.1分子和原子(学生版+解析) 学案 2 次下载
- 人教版(2024)2024-2025学年九年级化学上册提升讲义3.2.2原子结构(下)(学生版+解析) 学案 2 次下载
- 人教版(2024)2024-2025学年九年级化学上册提升讲义3.3元素(学生版+解析) 学案 2 次下载
- 人教版(2024)2024-2025学年九年级化学上册提升讲义3.4第三单元物质构成的奥秘(单元复习学案)(学生版+解析) 学案 2 次下载
初中化学人教版(2024)九年级上册(2024)课题2 原子结构学案设计
展开第1课时 原子的构成及核外电子排布
板块导航
01/学习目标 明确内容要求,落实学习任务
02/思维导图 构建知识体系,加强学习记忆
03/知识导学 梳理教材内容,掌握基础知识
04/效果检测 课堂自我检测,发现知识盲点
05/问题探究 探究重点难点,突破学习任务
06/分层训练 课后训练巩固,提升能力素养
一、原子的构成
1.原子结构:原子是由居于其中心的 和 构成,原子核一般由 和 构成。每个质子带 ,每个电子带 ,电子 。
2.原子不显电性的原因:原子核内 。
3.比较以下几种原子的构成,找出规律:
(1) 在原子中, = =
(2) 不同种类的原子 不同
(3) 原子中质子数 等于中子数
(4) 并不是所有原子的原子核中都有 。例如:氢原子核中无中子
【名师拓展】卢瑟福α粒子散射实验的解释
用一束带正电的α粒子轰击金箔:
(1)大多数α粒子穿透金箔——原子内有相对较大的空间,且电子质量很小 。
(2)小部分α粒子路径偏转——α粒子受到正电荷的排斥,发生偏转,说明原子核体积很小,带正电。
(3)极少数的α粒子反弹——α粒子撞到原子核被反弹,说明原子中心的原子核体积较小,但质量相对较大。
二、原子核外电子的排布
1.原子核外电子的排布
(1)电子层:电子运动没有固定的轨道,但在原子核外一定的区域内运动,这些区域成为“电子层”。
(2)在多电子原子中,核外电子有不同的运动状态,离核近的电子能量 ,离核越远电子能量 。
(3)离核最近的电子层为 ,次之为第二层,以此类推,最多为 ,最少1层。
(4)核外电子排布的规律:
= 1 \* GB3 ①核外电子总是尽量排在能量最低的电子层里,第一层排满才能排第二层,第二层排满才能排第三层,以此类推。
= 2 \* GB3 ②第一层最多容纳 电子;第二层最多容纳 电子;(每个电子层最多容纳2n2个电子,n为电子层数)
= 3 \* GB3 ③最外层电子数不超过 电子(若第一层为最外层时,不超过 电子)
2.原子结构示意图:
①圆圈内的数字:表示原子核内的
②+:表示原子核带
③弧线:表示电子层
④弧线上的数字:表示该电子层上的电子数
【易错提醒】圆圈内的数字等于 (核内 =核外 )
3.原子结构排布规律:
(1)每一横行: ; ;
(2)除稀有气体外,每一纵列: ; 。
4.原子结构与物质性质的关系
【易错提醒】最外层电子数为8(若第一层为最外层时,电子数为2)的结构叫相对稳定结构
5.原子的化学性质与结构的关系
原子的化学性质主要由 决定;原子最外层电子数 ,化学性质一般相似。
【易错提醒】氦原子最外层2个电子,但属于相对稳定结构,与最外层8个电子的稀有气体原子化学性质相似,与最外层2个电子的其他原子化学性质不相似。
1.判断题
(1)原子是由原子核和核外电子构成的( )
(2)任何原子都是由质子、中子和核外电子构成的( )
(3)决定原子种类的是中子数( )
(4)原子不显电性是因为原子中没有带电的微粒( )
(5)在原子中,质子数一定等于中子数( )
(6)在原子中,质子数一定等于核外电子数( )
(7)核外电子数决定原子的种类( )
(8)金属原子的最外层电子数一般少于4个( )
(9)原子中原子核与核外电子的电量相等、电性相反,因而原子不显电性( )
(10)原子核内质子数等于中子数。( )
(11)原子核都是由质子和中子构成( )
(12)由于原子内质子数等于中子数,所以原子不显电性。( )
(13)原子的核电荷数与核外电子数相等( )
(14)并不是所有的原子都有中子。如:氢原子没有中子。( )
(15)日本政府宣布将福岛核废水排放入海,引发全世界关注,核废水中含有氚、锶、铯等放射性元素。已知氚的质子数为1,中子数为3,则它原子核外的电子数为1( )
(16)卢瑟福在测定原子构成时做了如下实验:用粒子(带正电荷的氦核)轰击一张极薄的金箔,结果发现绝大多数粒子通过了金箔,极少数粒子发生偏转或被弹回。根据上述现象得出金原子带正电性( )
(17)离核近的电子能量高,离核越远,电子的能量越低。( )
(18)稀有气体可作保护气,是因为原子核外电子达到相对稳定结构( )
(19)原子核外电子绕核做高速运动,最外层电子数决定了原子的化学性质。( )
(20)氦原子和镁原子最外层电子数相同,化学性质相似( )
(21)原子核外的电子在核外空间做高速运动。( )
2.在分子、原子、原子核、质子、中子、电子这几种粒子中,找出符合下列条件的粒子填在相应横线上:
(1)能直接构成纯净物的是________;
(2)能保持物质化学性质的是________;
(3)化学变化中最小的粒子是________;
(4)带正电荷的是________;
(5)带负电荷的是________;
(6)不显电性的是________;
3.几种原子的结构
从上表可以得到如下结论:
①不同种类的原子, 不同;
②同一个原子中, 不一定等于 ;
③不是所有的原子都有中子,比如氢原子核内只有一个质子;
④ 决定原子种类。
4.碘是一种人体必需的微量元素,如图是碘离子的结构示意图。回答下列问题:
(1)图1中x= 。
(2)碘原子的核内质子数为 。
(3)图2表示的粒子中,其元素的化学性质与碘元素化学性质相似的是 (填标号)。
(4)图中表示的粒子中具有稳定结构的原子是 (填序号)。
5.氯原子结构示意图 还可以画为: 据此回答:
(1)氯原子有 层电子,原子核内有 个质子。
(2)图为: 的分子所表示的物质类别是 。(填“单质”或“化合物” )。
►问题一 原子结构
【典例1】下列关于原子的构成说法错误的是
A.原子由居于中心的原子核和核外电子构成
B.电子在原子核外一定空间内做高速运动
C.原子核的质量和电子的质量相差不大
D.原子核的体积与整个原子的体积相比要小很多
【解题必备】
1.原子是由居于其中心的原子核和电子构成,原子核一般由质子和中子构成。每个质子带一个单位正电荷,每个电子带一个单位负电荷,电子不带电荷。
2.在原子中,核电荷数=核内质子数=核外电子数。
3.不同种类的原子质子数不同,原子中质子数不一定等于中子数
【变式1-1】日本不顾国际社会的强烈反对,将核污水排放入海洋。所排核污水中有大量的氚,氚是指核内有1个质子和2个中子的氢原子,下列示意图能正确表示氚原子结构的是
A.B.C.D.
【变式1-2】如图为某原子的结构模型示意图,其中a、b、c是构成该原子的三种不同粒子,下列说法错误的是
A.决定该原子种类的是a
B.原子不带电的原因是a和c的个数相等,电性相反
C.原子中a、b、c的个数一定相等
D.原子的质量主要集中在a和b上
►问题二 原子结构示意图含义及应用
【典例2】卢瑟福的α粒子轰击金箔实验对人们认识原子结构有重要意义。金原子结构示意图如图所示,下列说法不正确的是
A.金的原子核带负电
B.金原子的质子数为79
C.金原子的核外电子数为79
D.原子由原子核与核外电子构成
【解题必备】圆圈内的数字表示原子核的质子数;“+”表示原子核带正电性;“弧线”表示电子层;
弧线上的数字表示该电子层上的电子数。圆圈内数字等于弧线上数字之和(核内质子数等于核外电子数)。
【变式2-1】铟是一种银白色金属,有毒。它的原子结构示意图如图所示,请据图回答下列问题。
(1)X= ,原子核外电子层数为 ,在化学反应中易 (填“得到”或“失去”)电子。
(2)在10-18号元素的原子中找出与铟化学性质相似的原子,并画出其原子结构示意图 。
【变式2-2】如图为氦和镁的原子结构示意图,下列说法正确的是
A.镁的原子序数为12B.镁原子第一层的2个电子能量最高
C.镁原子此时已达到相对稳定结构D.镁原子的化学性质和氦原子相似
►问题三 核外电子的排布规律及应用
【典例3】医疗上用放射性钴治疗肿瘤,钴原子的结构示意图如图所示,以下关于钴原子的说法中,正确的是
A.化学反应中易失电子B.共有5个电子层
C.带有27个正电D.各层均为相对稳定结构
【解题必备】
1.原子核外第一层最多容纳2个电子;第二层最多容纳8个电子;
2.最外层电子数不超过8个电子(若第一层为最外层时,不超过2个电子)
3.稀有气体原子最外层电子数为8(He为2),是相对稳定结构,不易得失电子。
金属原子最外层电子数一般<4 ,化学反应中较易失去电子。
非金属原子最外层电子数一般≥4 ,化学反应中容易得电子。
4.元素的化学性质主要由原子的最外层电子数决定
【变式3-1】如图所示是硫原子的原子结构示意图,下列对硫原子的叙述正确的是
A.硫原子第一电子层有6个电子
B.硫原子核内有16个质子
C.硫原子最外层电子的能量低于第二层电子的能量
D.硫原子达到了相对稳定的结构
【变式3-2】下图为几种原子的结构示意图:
(1)图中具有相对稳定结构的原子是 (填字母序号)。
(2)B原子在化学反应中容易 (填“得到”或“失去”)电子。
(3)C中x的值是 。
1.下列关于原子的叙述中,不正确的是
A.原子可以构成分子
B.原子是化学反应中的最小微粒
C.原子是由原子核和核外电子构成的
D.原子不带电是因为原子中不存在带电的粒子
2.嫦娥五号带回的月壤中含有大量安全无污染的核聚变原料He﹣3,其原子结构如图所示。下列说法正确的是
A.它是一种新元素
B.原子核外有3个电子
C.原子中的质子数等于电子数
D.原子核中有3个质子,没有中子
3.下列粒子中容易失电子的是
A.B.C.D.
4.如图为某原子的结构示意图,下列说法正确的是
A.该原子的质子数为16
B.该原子的最外层有2个电子
C.该原子易失去电子
D.该原子核外有6个电子层
5.卢瑟福在测定原子构成时做了如下实验:用粒子(带正电荷的氦核)轰击一张极薄的金箔,发现绝大多数粒子通过了金箔,极少数粒子发生偏转或被弹回。根据上述现象得出以下结论,其中正确的是
A.金原子核带负电荷B.金原子是实心球体,紧密排列
C.金原子核的质量比粒子的质量大得多D.金原子质量与氦核质量相当
6.我国在砷化镓太阳能电池研究方面国际领先。镓的原子结构示意图如下,下列说法正确的是
A.镓原子由31个质子和电子构成B.镓原子带31个单位的正电荷
C.原子核外的电子分5层排布D.镓原子在反应中趋于失去电子
7.下列有关氢原子的说法不正确的是
A.氢原子核外只有一个电子B.氢原子的原子核里只有一个质子
C.氢原子原子核都是由质子和中子构成D.氢原子失去电子后,剩下的只是原子核
8.如图为氦和镁的原子结构示意图,下列说法正确的是
A.镁的原子序数为12B.镁原子第一层的2个电子能量最高
C.镁原子此时已达到相对稳定结构D.镁元素的化学性质和氦元素相似
9.在①分子、②原子、③原子核、④质子、⑤中子、⑥电子六种粒子中,将符合下列条件的粒子序号填写在横线上(每题只有一个正确选项).
(1)能直接构成纯净物的是①和 ;
(2)能保持物质水的化学性质的是水 ;
(3)化学变化中的最小粒子是 ;
(4)带正电荷的是③和 ;
(5)带负电荷的是 ;
(6)不显电性的是①②和 ;
(7)质量最小的是 ;
(8)在同一原子中数目相等的是⑥和 。
10.如图为某粒子的结构示意图,回答以下问题。
(1)写出该微粒的符号 ;
(2)下图中与该元素的原子具有相似化学性质的是___________。
A.B.C.D.
11.人类对微观世界的探究永无止境。
(1)道尔顿提出的原子学说认为原子是不可再分的实心球体。这个观点现在看来是 (填“正确”或“错误”)的。
(2)卢瑟福用a粒子轰击金箔后产生散射现象(如图1),在分析实验结果的基础上,他提出了原子结构模型(如图2)。卢瑟福这一研究是 (填字母)的过程。
a.建立模型 b.得出结论 c.提出问题 d.验证证据
(3)卢瑟福在a粒子(a粒子带正电荷)散射实验中,推断原子中绝大部分空间是空的,他的依据是 。
(4)卢瑟福的原子结构模型:原子是由原子核和核外电子构成的,原子核带 电荷。
1.下列有关原子构成的叙述不正确的是
A.原子的质量主要集中在原子核上
B.相对于原子的体积来说,原子核的体积小到几乎可以忽略不计
C.原子核是不可分割的实心球体
D.原子中原子核与核外电子的电量相等、电性相反,因而原子不显电性
2.下列对原子性质和构成的叙述:①原子是化学变化中的最小粒子;②原子在不停地运动;③物质都是由原子构成的;④原子核都是由质子和中子构成的;⑤原子不显电性。其中不正确的是
A.①②B.③④C.③⑤D.只有④
3.如图为某原子结构模型示意图,其中a、b、c是构成该原子的三种不同粒子。下列说法正确的是
A.决定该原子种类的粒子是b
B.所有原子的原子核均由a、b、c三种粒子构成
C.原子中a与c的数目一定相同
D.原子的质量主要集中在a和c上
4.北斗卫星天线主要成分有高纯度钼,钼的相关信息如图所示,下列说法错误的是
A.钼原子的质子数为42B.钼的化学性质和Mg相似
C.钼原子在反应中容易得到电子D.钼原子核外电子排布图中x为12
5.如图是四种粒子的结构示意图,下列有关说法正确的是( )
A.④表示的粒子属于金属元素
B.①表示的粒子在化学反应中易失电子
C.①②③④表示四种不同元素
D.②④所表示的粒子化学性质相似
6.根据下列各组元素的粒子结构示意图分析:具有相似化学性质的一组是
A.①②B.①③C.②③D.①④
7.据科学家预测,月球的土壤中吸附着百万吨的氦(He﹣3),其原子核中质子数为2、中子数为1,每百吨氦(He﹣3)核聚变所释放出的能量相当于目前人类一年消耗的能量。下列关于氦(He﹣3)元素的说法正确的是( )
A.原子核外电子数为3B.相对原子质量为2
C.原子结构示意图为D.原子结构示意图为
8.将下列有关选项的序号填入以下各项的空格内:
①质子数 ②中子数 ③最外层电子数 ④原子核
(1)原子的核电荷数取决于原子结构中的 ;
(2)原子的相对原子质量取决于原子结构中的 ;
(3)原子的质量主要集中在原子结构中的 ;
(4)元素的化学性质主要取决于原子结构中的 .
9.用锶(Sr)等材料制成的原子钟精准度极高,常被用于卫星的精准计时。图1是锶原子的结构示意图。图2是几种粒子的结构示意图。
(1)图1中x= ;
(2)图2中与锶原子化学性质相似的原子是 (填化学符号);
(3)已知原子的核外电子层数越多,原子半径越大,当核外电子层数相等时,核电荷数越多,原子半径越小。B~D中半径最大的原子是 (填字母)。
10.探秘原子结构
人类探索原子结构的奥秘,经历了漫长的过程。
(1)1897年,汤姆森发现了 提出原子是可分的,并提出原子模型如图所示。
(2)1911年,物理学家卢瑟福用一束带正电的、质量比电子大得多的高速粒子轰击金箔,预期这些粒子会毫不费力地击穿金原子,到达对面的探测板上,结果发现:绝大多数粒子穿过金箔后仍保持原来的运动方向,少数粒子发生了较大角度的偏转,极少数粒子被反弹回来。
①当粒子轰击金箔时,下图四条运动轨迹中不可能出现的是(填序号) 。
②卢瑟福根据实验现象推测:原子中心有一个结构(原子核),它具有如下特点 。
(3)用高能粒子轰击原子核是研究微观粒子的一种常用方法。
1938年,德国科学家哈恩用中子轰击铀235原子(质子数为92,相对原子质量是235,元素符号为U),得到了质子数为56的钡原子,并用下图模型定义该变化。
①原子中,中子数是 。
②上述变化是不是化学变化 ,理由是 。
11.阅读下面科普短文并回答问题。
研究发现,同种元素的原子核中,中子数不一定相同,如氢元素的原子核(如下表)。
为了更好地区别同种元素的不同原子,常用原子符号来表示质量数为A,质子数为z的X原子,其中质量数=质子数+中子数。如上述氕、氘、氚3种不同的氢原子就可以依次表示为.质子数相同而中子教不同的同一元素的不同原子互称为同位素。如互为同位素。同位素在生活、生产和科学研究中有着重要用途。例如考古时利用 测定一些文物的年代;通过测定和,分析古代人类的食物结构:追踪 发出的射线,确定磷在植物中的作用部位等。
(1)测定相对原子质量时,要使用含有6个质子和6个中子的一种碳原子质量的1/12作标准。该碳原子的原子符号为 .
(2)在中, 互为同位素的是 和 .
(3)的原子核内中子数是 .
(4)下列说法正确的是 (填字母)。
A 原子的结构示意图为
B 氘原子与氚原子的相对原子质量不同
C 由和 组成的1个水分子中含11个中子
D 氕、氘、氚3种氢原子最多可以组成6种不同的氢分子
12.1910年英国科学家卢瑟福进行了著名的α粒子轰击金箔实验。实验做法如图所示:
①放射源−−放射性物质放出α粒子(带正电荷),质量是电子质量的7000倍。
②金箔−−作为靶子,厚度1μm,重叠了3000层左右的原子。
③荧光屏−−α粒子打在上面发出闪光。
④显微镜−−通过显微镜观察闪光,且通过360度转动可观察不同角度α粒子的到达情况。
【收集证据】绝大多数α粒子穿过金箔后仍沿原来的方向前进,但是有少数α粒子却发生了较大的偏转,并且有极少数α粒子的偏转超过90∘,有的甚至几乎达到180∘,像是被金箔弹了回来。
【猜想与假设】α粒子遇到电子后,就像飞行的子弹碰到灰尘一样运动方向不会发生明显的改变,而结果却出乎意料,除非原子的大部分质量集中到了一个很小的结构上,否则大角度的散射是不可能的。
【解释与结论】
(1)已知金的原子核带79个单位的正电荷,金原子的相对原子质量是197,则金原子核内含有的粒子及个数分别是 。
(2)卢瑟福所说的“除非原子的大部分质量集中到了一个很小的结构上”中的“很小的结构”指的是 。
(3)1μm金箔包含了3000层金原子,绝大多数α粒子穿过后方向不变,说明_______。
A.原子是实心的B.原子内部绝大部分空间是空的
C.原子的质量是均匀分布的D.原子中心有一个很大的核
1.了解原子的构成及构成粒子之间的关系。
2.了解原子结构模型的发展历程,体会模型方法在微观世界研究中的作用。
3.了解原子核外的电子的排布特点,知道原子结构示意图的表示方法,并了解结构与性质的关系。
重点:
构成原子的粒子及相互之间的关系
难点:
核外电子的分层排布和原子结构示意图的意义
原子种类
最外层电子数
化学性质
稀有气体原子
相对 ,不易得失电子
金属原子
一般
易 ,形成阳离子,化学性质比较活泼
非金属原子
一般
易 ,形成阴离子,化学性质比较活泼
原子种类
质子数
中子数
核外电子数
氢
1
0
1
碳
6
6
6
氧
8
8
8
钠
11
12
11
镁
12
12
12
氯
17
18
17
氧元素的原子核
原子名称
质子数(Z)
中子数(N)
1
0
氕
1
1
氘
1
2
氚
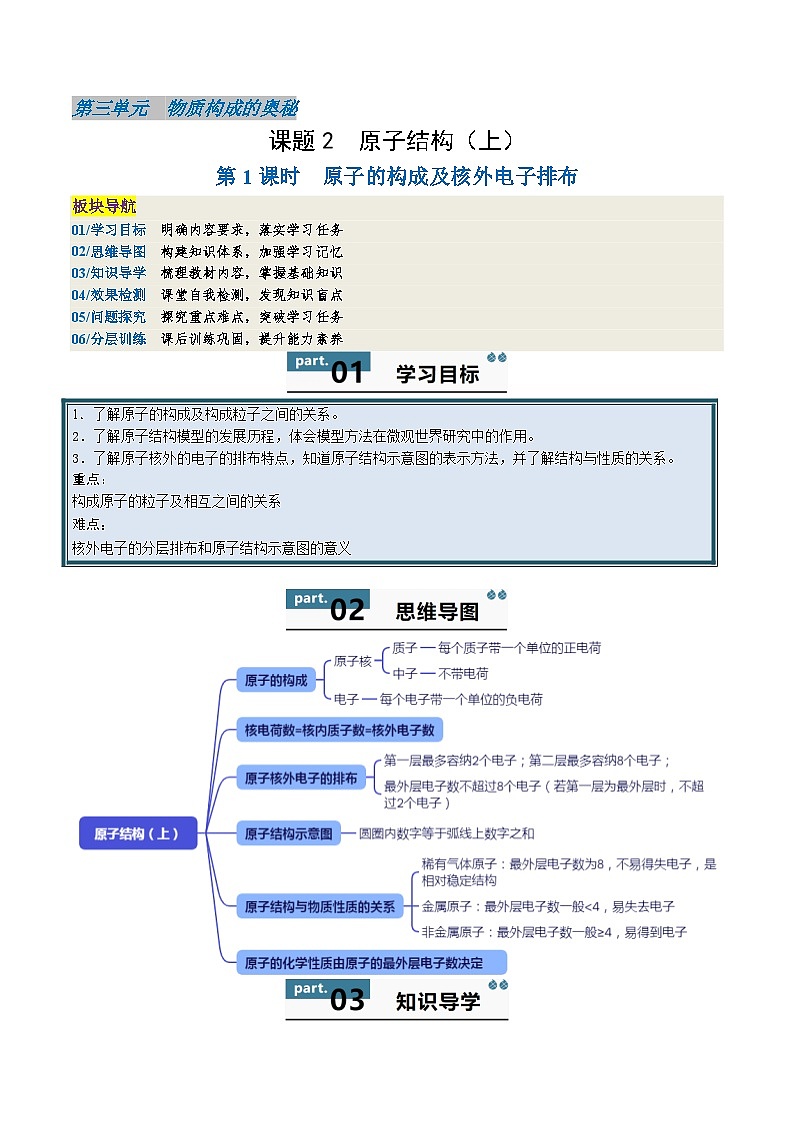
第三单元 物质构成的奥秘
课题2 原子结构(上)
第1课时 原子的构成及核外电子排布
板块导航
01/学习目标 明确内容要求,落实学习任务
02/思维导图 构建知识体系,加强学习记忆
03/知识导学 梳理教材内容,掌握基础知识
04/效果检测 课堂自我检测,发现知识盲点
05/问题探究 探究重点难点,突破学习任务
06/分层训练 课后训练巩固,提升能力素养
一、原子的构成
1.原子结构:原子是由居于其中心的原子核和电子构成,原子核一般由质子和中子构成。每个质子带一个单位正电荷,每个电子带一个单位负电荷,电子不带电荷。
2.原子不显电性的原因:原子核内质子所带正电荷与核外电子所带负电荷数数量相等,电性相反。
3.比较以下几种原子的构成,找出规律:
(1) 在原子中,核电荷数=核内质子数=核外电子数
(2) 不同种类的原子质子数不同
(3) 原子中质子数不一定等于中子数
(4) 并不是所有原子的原子核中都有中子。
【名师拓展】卢瑟福α粒子散射实验的解释
用一束带正电的α粒子轰击金箔:
(1)大多数α粒子穿透金箔——原子内有相对较大的空间,且电子质量很小 。
(2)小部分α粒子路径偏转——α粒子受到正电荷的排斥,发生偏转,说明原子核体积很小,带正电。
(3)极少数的α粒子反弹——α粒子撞到原子核被反弹,说明原子中心的原子核体积较小,但质量相对较大。
二、原子核外电子的排布
1.原子核外电子的排布
(1)电子层:电子运动没有固定的轨道,但在原子核外一定的区域内运动,这些区域成为“电子层”。
(2)在多电子原子中,核外电子有不同的运动状态,离核近的电子能量低,离核越远电子能量越高。
(3)离核最近的电子层为第一层,次之为第二层,以此类推,最多为7层,最少1层。
(4)核外电子排布的规律:
= 1 \* GB3 ①核外电子总是尽量排在能量最低的电子层里,第一层排满才能排第二层,第二层排满才能排第三层,以此类推。
= 2 \* GB3 ②第一层最多容纳2个电子;第二层最多容纳8个电子;(每个电子层最多容纳2n2个电子,n为电子层数)
= 3 \* GB3 ③最外层电子数不超过8个电子(若第一层为最外层时,不超过2个电子)
2.原子结构示意图:
①圆圈内的数字:表示原子核内的质子数
②+:表示原子核带正电
③弧线:表示电子层
④弧线上的数字:表示该电子层上的电子数
【易错提醒】圆圈内的数字等于弧线上的数字之和(核内质子数=核外电子数)
3.1~18号原子结构示意图:
排列规律:
(1)每一横行:电子层数相同;最外层电子数从左到右依次递增;
(2)除稀有气体原子外,每一纵列:最外层电子数相同;电子层数从上到下依次递增。
4.原子结构与物质性质的关系
【易错提醒】最外层电子数为8(若第一层为最外层时,电子数为2)的结构叫相对稳定结构
5.原子的化学性质与结构的关系
原子的化学性质主要由原子的最外层电子数决定;原子最外层电子数相同,化学性质一般相似。
【易错提醒】氦原子最外层2个电子,但属于相对稳定结构,与最外层8个电子的稀有气体原子化学性质相似,与最外层2个电子的其他原子化学性质不相似。
1.判断题
(1)原子是由原子核和核外电子构成的( )
(2)任何原子都是由质子、中子和核外电子构成的( )
(3)决定原子种类的是中子数( )
(4)原子不显电性是因为原子中没有带电的微粒( )
(5)在原子中,质子数一定等于中子数( )
(6)在原子中,质子数一定等于核外电子数( )
(7)核外电子数决定原子的种类( )
(8)金属原子的最外层电子数一般少于4个( )
(9)原子中原子核与核外电子的电量相等、电性相反,因而原子不显电性( )
(10)原子核内质子数等于中子数。( )
(11)原子核都是由质子和中子构成( )
(12)由于原子内质子数等于中子数,所以原子不显电性。( )
(13)原子的核电荷数与核外电子数相等( )
(14)并不是所有的原子都有中子。如:氢原子没有中子。( )
(15)日本政府宣布将福岛核废水排放入海,引发全世界关注,核废水中含有氚、锶、铯等放射性元素。已知氚的质子数为1,中子数为3,则它原子核外的电子数为1( )
(16)卢瑟福在测定原子构成时做了如下实验:用粒子(带正电荷的氦核)轰击一张极薄的金箔,结果发现绝大多数粒子通过了金箔,极少数粒子发生偏转或被弹回。根据上述现象得出金原子带正电性( )
(17)离核近的电子能量高,离核越远,电子的能量越低。( )
(18)稀有气体可作保护气,是因为原子核外电子达到相对稳定结构( )
(19)原子核外电子绕核做高速运动,最外层电子数决定了原子的化学性质。( )
(20)氦原子和镁原子最外层电子数相同,化学性质相似( )
(21)原子核外的电子在核外空间做高速运动。( )
【答案】(1)√ (2) × (3) × (4) × (5) × (6) √ (7)× (8) √ (9) √ (10) × (11) × (12)× (13) √ (14) √ (15)√ (16) × (17) × (18) √ (19)√ (20) × (21) √
2.在分子、原子、原子核、质子、中子、电子这几种粒子中,找出符合下列条件的粒子填在相应横线上:
(1)能直接构成纯净物的是________;
(2)能保持物质化学性质的是________;
(3)化学变化中最小的粒子是________;
(4)带正电荷的是________;
(5)带负电荷的是________;
(6)不显电性的是________;
【答案】(1)分子、原子
(2)分子、原子
(3)原子
(4)原子核、质子
(5)电子
(6)分子、原子、中子
【详解】(1)分子原子都可以直接构成物质,如氧气是由氧分子构成的,汞是由汞原子构成的,故填分子、原子;
(2)由分子构成的物质分子保持其化学性质,由原子构成的物质中原子保持其化学性质,故填:分子、原子;
(3)原子在化学变化中不可分,故原子是化学变化中的最小粒子,故填:原子;
(4)带正电的粒子有质子和原子核,故填:原子核、质子;
(5)带负电的是电子,故填:电子;
(6)中子不带电;质子所带的正电荷总数等于电子所带的负电荷总数,所以原子不带电,分子是由原子构成的,故分子也不带电,故填:分子、原子、中子。
3.几种原子的结构
从上表可以得到如下结论:
①不同种类的原子, 不同;
②同一个原子中, 不一定等于 ;
③不是所有的原子都有中子,比如氢原子核内只有一个质子;
④ 决定原子种类。
【答案】 质子数 质子数 中子数 质子数
【详解】①质子数决定原子的种类,所以不同种类的原子,质子数不同;
②原子核内一定含有质子,不一定含有中子,且质子数不一定等于中子数,例如氢原子核中就不含有中子;
④质子数决定原子的种类。
4.碘是一种人体必需的微量元素,如图是碘离子的结构示意图。回答下列问题:
(1)图1中x= 。
(2)碘原子的核内质子数为 。
(3)图2表示的粒子中,其元素的化学性质与碘元素化学性质相似的是 (填标号)。
(4)图中表示的粒子中具有稳定结构的原子是 (填序号)。
【答案】(1)18
(2)53
(3)BE
(4)AF
【详解】(1)碘离子(I-)是由碘原子得到一个电子形成的,所以碘原子的最外层的电子数是7,在原子中质子数等于电子数,所以x=53-2-8-18-7=18;
(2)原子结构示意图中,圆圈内的数字表示质子数,则碘原子的核内质子数为53;
(3)最外层电子数相同的原子具有相似的化学性质,在图2表示的粒子中,B(氟离子,氟原子最外层有7个电子)、E与碘元素的原子的最外层电子数相同,元素的化学性质相似;
(4)在A中第一层也是最外层,电子数是2,属于稳定结构;F的最外层电子数是8,属于稳定结构,在AF中质子数等于电子数,属于原子,所以,图中表示的粒子中具有稳定结构的原子是AF。
5.氯原子结构示意图 还可以画为: 据此回答:
(1)氯原子有 层电子,原子核内有 个质子。
(2)图为: 的分子所表示的物质类别是 。(填“单质”或“化合物” )。
【答案】3 17 单质
【详解】(1)根据氯原子结构示意图,可知氯原子有3层电子,原子核内有17个质子,核外有17个电子。
(2)据图所示,分子中仅含有一种原子,则属于物质类别里的单质。
【点睛】单质的微观解释:物质由同种分子构成,分子由同种原子构成。
►问题一 原子结构
【典例1】下列关于原子的构成说法错误的是
A.原子由居于中心的原子核和核外电子构成
B.电子在原子核外一定空间内做高速运动
C.原子核的质量和电子的质量相差不大
D.原子核的体积与整个原子的体积相比要小很多
【答案】C
【详解】A、原子由原子核和核外电子构成,故A说法正确;
B、核外电子是分层排布的,核外电子在离核远近不同的区域中运动,故B说法正确;
C、电子的质量很小可以忽略不计,原子的质量主要集中在原子核上,故C说法错误;
D、原子核的体积很小,原子核的体积与整个原子的体积相比要小很多,故D说法正确。
故选:C。
【解题必备】
1.原子是由居于其中心的原子核和电子构成,原子核一般由质子和中子构成。每个质子带一个单位正电荷,每个电子带一个单位负电荷,电子不带电荷。
2.在原子中,核电荷数=核内质子数=核外电子数。
3.不同种类的原子质子数不同,原子中质子数不一定等于中子数
【变式1-1】日本不顾国际社会的强烈反对,将核污水排放入海洋。所排核污水中有大量的氚,氚是指核内有1个质子和2个中子的氢原子,下列示意图能正确表示氚原子结构的是
A.B.C.D.
【答案】C
【详解】原子是由原子核和核外电子构成,原子核是由质子和中子构成,且原子的质子数=核外电子数,则氚原子的原子核内有1个质子和2个中子,核外有1个电子,故选C。
【变式1-2】如图为某原子的结构模型示意图,其中a、b、c是构成该原子的三种不同粒子,下列说法错误的是
A.决定该原子种类的是a
B.原子不带电的原因是a和c的个数相等,电性相反
C.原子中a、b、c的个数一定相等
D.原子的质量主要集中在a和b上
【答案】C
【详解】A、图中a为质子,b为中子,c为电子,原子中质子数决定原子种类,故A正确;
B、在原子中,原子核内的质子所带电荷与核外电子的电荷数量相等,电性相反,因此原子不显电性,故B正确;
C、质子数一定等于核外电子数,而中子数不一定和质子数相等,故C错误;
D、原子的质量主要集中在原子核上,原子核是由质子和中子构成,故集中在a和c上,故D正确。
故选C。
►问题二 原子结构示意图含义及应用
【典例2】卢瑟福的α粒子轰击金箔实验对人们认识原子结构有重要意义。金原子结构示意图如图所示,下列说法不正确的是
A.金的原子核带负电
B.金原子的质子数为79
C.金原子的核外电子数为79
D.原子由原子核与核外电子构成
【答案】A
【详解】A. 原子核是由带正电荷的质子和不显电性的中子构成的,所以金的原子核带正电,此选项错误;
B. 原子中核电荷数=质子数,由题中信息可知,金原子的质子数为79,此选项正确;
C. 原子中核电荷数=质子数=核外电子数,金原子的核外电子数为79,此选项正确;
D. 原子由原子核与核外电子构成,此选项正确。
故选A。
【解题必备】圆圈内的数字表示原子核的质子数;“+”表示原子核带正电性;“弧线”表示电子层;
弧线上的数字表示该电子层上的电子数。圆圈内数字等于弧线上数字之和(核内质子数等于核外电子数)。
【变式2-1】铟是一种银白色金属,有毒。它的原子结构示意图如图所示,请据图回答下列问题。
(1)X= ,原子核外电子层数为 ,在化学反应中易 (填“得到”或“失去”)电子。
(2)在10-18号元素的原子中找出与铟化学性质相似的原子,并画出其原子结构示意图 。
【答案】(1) 49 5 失去
(2)
【详解】(1)根据所学知识,原子结构示意图是表示原子核电荷数和电子层排布的图示形式。小圈和圈内的数字表示原子核和核内质子数,弧线表示电子层,弧线上的数字表示该层的电子数。在原子中,核内质子数=核电荷数=原子序数=核外电子数。所以X=2+8+18+18+3=49,核内质子数为49,原子核外电子层数为5,该原子的最外层电子数为3,小于4,所以在化学反应中易失去电子。
(2)最外层电子数决定化学性质,所以最外层电子数相同的原子化学性质相似,铟原子最外层电子数为3,10-18号元素最外层电子数为3的元素是铝元素,铝元素原子结构示意图为。
【变式2-2】如图为氦和镁的原子结构示意图,下列说法正确的是
A.镁的原子序数为12B.镁原子第一层的2个电子能量最高
C.镁原子此时已达到相对稳定结构D.镁原子的化学性质和氦原子相似
【答案】A
【详解】A、由图可知该镁原子的核电荷数为12,因为原子序数等于核电荷数粒子,故镁的原子序数为12,A正确;
B、该粒子最外层的2个电子能量最高,B错误;
C、该粒子最外层有两个电子,小于四,易失去两个电子,没有达到相对稳定结构,C错误;
D、镁原子易失去电子,氦原子化学性质稳定,该原子的化学性质和氦原子不相似,D错误。
故选A。
►问题三 核外电子的排布规律及应用
【典例3】医疗上用放射性钴治疗肿瘤,钴原子的结构示意图如图所示,以下关于钴原子的说法中,正确的是
A.化学反应中易失电子B.共有5个电子层
C.带有27个正电D.各层均为相对稳定结构
【答案】A
【详解】A、钴原子的最外层上电子数是2,小于4,在反应中易失去电子,正确;
B、由原子的结构示意图可知,有四个电子层,错误;
C、原子结构中,圆圈内的数字为质子数,质子带正电,一个钴原子含有27个质子,错误;
D、在原子结构中,第一层电子最多可达2个,第二层最多8个,当电子层数超过三层时,倒数第二层电子数不超过18个,最外层电子数不超过8个,由原子结构可知,第三层为15个电子,最外层为2个电子,都没有达到稳定结构,错误。
故选:A。
【解题必备】
1.原子核外第一层最多容纳2个电子;第二层最多容纳8个电子;
2.最外层电子数不超过8个电子(若第一层为最外层时,不超过2个电子)
3.稀有气体原子最外层电子数为8(He为2),是相对稳定结构,不易得失电子。
金属原子最外层电子数一般<4 ,化学反应中较易失去电子。
非金属原子最外层电子数一般≥4 ,化学反应中容易得电子。
4.元素的化学性质主要由原子的最外层电子数决定
【变式3-1】如图所示是硫原子的原子结构示意图,下列对硫原子的叙述正确的是
A.硫原子第一电子层有6个电子
B.硫原子核内有16个质子
C.硫原子最外层电子的能量低于第二层电子的能量
D.硫原子达到了相对稳定的结构
【答案】B
【详解】A、离核最近的为第一层,则硫原子电子层有2个电子,错误;
B.圆圈内的数字表示原子的质子数,则硫原子核内有16个质子,正确;
C.原子核外电子的能量由里向外依次增大,故硫原子最外层电子的能量高于第二层电子的能量,错误;
D.硫原子最外层电子数为6,没有达到相对稳定的结构,错误。
故选B。
【变式3-2】下图为几种原子的结构示意图:
(1)图中具有相对稳定结构的原子是 (填字母序号)。
(2)B原子在化学反应中容易 (填“得到”或“失去”)电子。
(3)C中x的值是 。
【答案】(1)A
(2)失去
(3)6
【分析】原子的质子数等于核外电子数,对于C来说,16=2+8+x,x=6。
【详解】(1)最外层电子数为8(只有一层的时候为2)属于相对稳定结构,图中A最外层电子数为8,具有相对稳定结构,B最外层电子数为1,C最外层电子数为6,都不是相对稳定结构,故填:A。
(2)B原子的最外层电子数为1,小于4,在化学反应中容易失去电子,成为阳离子。
(3)根据分析,x的值是6。
1.下列关于原子的叙述中,不正确的是
A.原子可以构成分子
B.原子是化学反应中的最小微粒
C.原子是由原子核和核外电子构成的
D.原子不带电是因为原子中不存在带电的粒子
【答案】D
【详解】A、原子可以结合成分子,叙述正确,不符合题意;
B、原子在化学变化中是最小的粒子,不能再分,叙述正确,不符合题意;
C、所有的原子都是由原子核与核外电子构成,叙述正确,不符合题意;
D、原子不带电是因为原子核所带的正电荷和核外电子所带的负电荷数目相等电性相反,所以对外不显电性,叙述错误,符合题意。
故选:D。
2.嫦娥五号带回的月壤中含有大量安全无污染的核聚变原料He﹣3,其原子结构如图所示。下列说法正确的是
A.它是一种新元素
B.原子核外有3个电子
C.原子中的质子数等于电子数
D.原子核中有3个质子,没有中子
【答案】C
【详解】A、He-3属于氦元素,不属于新元素,故说法错误;
B、在原子中,质子数=核外电子数,He-3原子中含有2个质子,2个电子,故说法错误;
C、在原子中,质子数=核外电子数,故说法正确;
D、He-3原子中含有2个质子,中子为3-2=1,故说法错误。
故选C。
3.下列粒子中容易失电子的是
A.B.C.D.
【答案】B
【分析】多个电子层的,最外层电子数少于4个,易失去电子
【详解】A、最外层电子数是8,已达到相对稳定结构,故不易失电子;
B、最外层1个电子,易失电子;
C、最外层电子数是6,大于4,故不易失电子;
D、只有一个电子层,最外层电子数是2,已经达到相对稳定结构,故不易失电子;
故选B。
4.如图为某原子的结构示意图,下列说法正确的是
A.该原子的质子数为16
B.该原子的最外层有2个电子
C.该原子易失去电子
D.该原子核外有6个电子层
【答案】A
【详解】A、圆圈内的数字表示质子数,则该原子的质子数为16,故A说法正确;
B、离核最远的为最外层电子数,则该原子的最外层电子数为6,故B说法不正确;
C、该原子最外层电子数为6,大于4,在化学变化中易得到电子,故C说法不正确;
D、由图可知,该原子核外有3个电子层,故D说法不正确;
故选:A。
5.卢瑟福在测定原子构成时做了如下实验:用粒子(带正电荷的氦核)轰击一张极薄的金箔,发现绝大多数粒子通过了金箔,极少数粒子发生偏转或被弹回。根据上述现象得出以下结论,其中正确的是
A.金原子核带负电荷B.金原子是实心球体,紧密排列
C.金原子核的质量比粒子的质量大得多D.金原子质量与氦核质量相当
【答案】C
【详解】A、任何原子的原子核都是带正电的,结合题中信息有部分α粒子发生了偏转,也说明了金原子的原子核带的是正电,故A错误;
B、原子是由带正电的原子核和核外电子构成的,由绝大多数a粒子通过了金箔,故金原子不是实心球体,故B错误;
C、由题中极少数α粒子被弹回说明α粒子碰到了金的原子核,根据α粒子被弹回说明金原子核比α粒子质量大得多,故C正确;D、由题中极少数α粒子被弹回说明α粒子碰到了金的原子核,根据α粒子被弹回说明金原子核比α粒子质量大得多,金原子质量比氦核质量大很多,故D错误。
故选:C。
6.我国在砷化镓太阳能电池研究方面国际领先。镓的原子结构示意图如下,下列说法正确的是
A.镓原子由31个质子和电子构成B.镓原子带31个单位的正电荷
C.原子核外的电子分5层排布D.镓原子在反应中趋于失去电子
【答案】D
【详解】A、由镓的原子结构示意图可知,镓原子有31个质子和31个电子,但是原子是由原子核与核外电子构成的,原子核是由质子和中子构成的,故镓原子中除了质子和电子还有中子,故A错误,不符合题意;
B、原子中每一个质子带一个单位的正电荷,每一个电子带一个单位的负电荷,原子中核内质子数=核外电子数,故原子不显电性,故镓原子不带电,故B错误,不符合题意;
C、原子结构示意图中,弧线表示电子层,故由镓的原子结构示意图可知,镓原子原子核外的电子分4层排布,故C错误,不符合题意;
D、由镓的原子结构示意图可知,镓原子最外层电子数为3,小于4,在化学反应中易失去电子形成阳离子,故镓原子在反应中趋于失去电子,故D正确,符合题意。
故选:D。
7.下列有关氢原子的说法不正确的是
A.氢原子核外只有一个电子B.氢原子的原子核里只有一个质子
C.氢原子原子核都是由质子和中子构成D.氢原子失去电子后,剩下的只是原子核
【答案】C
【分析】根据氢原子由一个质子和一个核外电子构成进行分析。
【详解】A、氢原子核外只有一个电子,故选项说法正确;
B、氢原子的原子核里只有一个质子,故选项说法正确;
C、氢原子的原子核里只有一个质子,没有中子,故选项说法错误;
D、氢原子由1个质子和一个核外电子构成,氢原子失去电子后,剩下的只是原子核,故选项说法正确。
故选:C。
8.如图为氦和镁的原子结构示意图,下列说法正确的是
A.镁的原子序数为12B.镁原子第一层的2个电子能量最高
C.镁原子此时已达到相对稳定结构D.镁元素的化学性质和氦元素相似
【答案】A
【详解】A、由图可知该镁原子的核电荷数为12,因为原子序数等于核电荷数粒子,故镁的原子序数为12,A正确;
B、该粒子最外层的2个电子能量最高,B错误;
C、该粒子最外层有两个电子,小于四,易失去两个电子,没有达到相对稳定结构,C错误;
D、镁元素易失去电子,氦元素化学性质稳定,该元素的化学性质和氦元素不相似,D错误。
故选A。
9.在①分子、②原子、③原子核、④质子、⑤中子、⑥电子六种粒子中,将符合下列条件的粒子序号填写在横线上(每题只有一个正确选项).
(1)能直接构成纯净物的是①和 ;
(2)能保持物质水的化学性质的是水 ;
(3)化学变化中的最小粒子是 ;
(4)带正电荷的是③和 ;
(5)带负电荷的是 ;
(6)不显电性的是①②和 ;
(7)质量最小的是 ;
(8)在同一原子中数目相等的是⑥和 。
【答案】(1)②
(2)①
(3)②
(4)④
(5)⑥
(6)⑤
(7)⑥
(8)④
【详解】(1)分子和原子可以直接构成物质,故选②;
(2)由分子构成的物质,分子是保持物质化学性质的最小粒子,水是由水分子构成的,所以能保持物质水的化学性质的是水分子,故选①;
(3)化学变化中分子可分,原子不可分,原子是化学变化中的最小粒子,故选②;
(4)质子带正电,中子不带电,原子核由质子和中子组成,所以原子核也带正电,故原子核和质子是带正电的微粒,故选④;
(5)电子带负电,故选⑥;
(6)分子和原子不显电性,中子也不显电性,故选⑤;
(7)电子是质量最小的微粒,故选⑥;
(8)在同一原子中,质子数=核外电子数,故选④。
10.如图为某粒子的结构示意图,回答以下问题。
(1)写出该微粒的符号 ;
(2)下图中与该元素的原子具有相似化学性质的是___________。
A.B.C.D.
【答案】(1)F-
(2)B
【详解】(1)据图可知,该微粒质子数=9,核外电子数=10,所以为为带一个代为负电荷的负离子,符号为:F-;
(2)原子的最外层电子数决定了元素的主要化学性质,氟原子的最外层有7个电子,因此与氟原子具有相似化学性质的是B。
11.人类对微观世界的探究永无止境。
(1)道尔顿提出的原子学说认为原子是不可再分的实心球体。这个观点现在看来是 (填“正确”或“错误”)的。
(2)卢瑟福用a粒子轰击金箔后产生散射现象(如图1),在分析实验结果的基础上,他提出了原子结构模型(如图2)。卢瑟福这一研究是 (填字母)的过程。
a.建立模型 b.得出结论 c.提出问题 d.验证证据
(3)卢瑟福在a粒子(a粒子带正电荷)散射实验中,推断原子中绝大部分空间是空的,他的依据是 。
(4)卢瑟福的原子结构模型:原子是由原子核和核外电子构成的,原子核带 电荷。
【答案】(1)错误
(2)a
(3)绝大多数a粒子通过金箔并按原来方向运动
(4)正
【详解】(1)原子由居于原子中心的原子核及核外电子构成,原子核外是一个空旷的区域。道尔顿提出的原子学说认为原子是不可再分的实心球体,所以这个观点现在看来是错误的。
(2)卢瑟福用a粒子轰击金箔后产生散射现象(如图-1),在分析实验结果的基础上,他提出了原子结构模型(如图-2),是建立了模型。卢瑟福这一研究是建立模型的过程,故选a。
(3)卢瑟福在α粒子(α粒子带正电荷)散射实验中,推断原子中绝大部分空间是空的,他的依据是:绝大多数a粒子通过金箔并按原来方向运动,说明绝大多数α粒子未受到影响,则,推断原子中绝大部分空间是空的。
(4)卢瑟福的原子结构模型:原子是由原子核和核外电子构成的,原子核带正电荷,电子带负电荷。
1.下列有关原子构成的叙述不正确的是
A.原子的质量主要集中在原子核上
B.相对于原子的体积来说,原子核的体积小到几乎可以忽略不计
C.原子核是不可分割的实心球体
D.原子中原子核与核外电子的电量相等、电性相反,因而原子不显电性
【答案】C
【详解】A、原子的质量主要集中在原子核上,电子的质量很小,故选项说法正确;
B、相对于原子来说,原子核的体积小到几乎可以忽略不计,故选项说法正确;
C、原子核可以分为质子和中子,故选项说法错误;
D、原子由原子核和核外电子构成,原子核由质子和中子构成,质子带正电,核外电子带负电,且质子与核外电子所带的电荷数相同,故原子不显电性,故选项说法正确;
故选:C。
2.下列对原子性质和构成的叙述:①原子是化学变化中的最小粒子;②原子在不停地运动;③物质都是由原子构成的;④原子核都是由质子和中子构成的;⑤原子不显电性。其中不正确的是
A.①②B.③④C.③⑤D.只有④
【答案】B
【详解】①化学反应中分子分成原子,原子再重新组合成新的分子,所以原子是化学变化中的最小粒子,①正确;
②任何物质都在不断运动,②正确;
③物质可以由原子、分子、离子构成,③错误;
④原子核一般由质子和中子构成,但氢原子的原子核中不含中子,④错误;
⑤原子由带正电的原子核以及带负电的核外电子构成,二者电量相等,电性相反,所以原子不带电,⑤正确。
故选:B。
3.如图为某原子结构模型示意图,其中a、b、c是构成该原子的三种不同粒子。下列说法正确的是
A.决定该原子种类的粒子是b
B.所有原子的原子核均由a、b、c三种粒子构成
C.原子中a与c的数目一定相同
D.原子的质量主要集中在a和c上
【答案】D
【分析】根据模型图可知,a为质子,b为电子,c为中子;
【详解】A、质子数决定元素的种类,决定该原子种类的粒子是a,故A错误;
B、氢原子内只含有质子和电子,没有中子,即只含有a质子、c中子两种粒子,故B错误;
C、质子数和中子数不一定相等,原子中a与c的数目不一定相同,故C错误;
D、原子的质量主要集中在原子核上,原子核是由质子和中子构成,故集中在a和c上,故D正确。
故选D。
4.北斗卫星天线主要成分有高纯度钼,钼的相关信息如图所示,下列说法错误的是
A.钼原子的质子数为42B.钼的化学性质和Mg相似
C.钼原子在反应中容易得到电子D.钼原子核外电子排布图中x为12
【答案】C
【详解】A、在原子结构示意图中圆圈内数值为质子数,故钼原子的质子数为42,选项说法正确;
B、元素的化学性质与原子的核外电子尤其是最外层电子数密切相关,镁原子最外层电子数为2与钼原子的最外层的电子数相同,故两者的化学性质相似,该选项说法正确;
C、钼原子最外层电子数为2,小于4,容易失去电子而形成阳离子,该选项说法错误;
D、原子中,质子数=核外电子数,42=2+8+18+x+2,x=12,故选项说法正确。
故选C。
5.如图是四种粒子的结构示意图,下列有关说法正确的是( )
A.④表示的粒子属于金属元素
B.①表示的粒子在化学反应中易失电子
C.①②③④表示四种不同元素
D.②④所表示的粒子化学性质相似
【答案】A
【分析】根据质子数判断元素及类别。根据最外层电子数是8(氦是2),属于稳定结构进行;最外层电子数大于4个,易得到电子;元素的种类由质子数决定;元素原子的最外层电子数相同的元素的化学性质相似,进行解答;
【详解】A、④是11号是钠元素,最外层电子数是1小于4,属于金属元素,选项说法正确;故符合题意;
B、①中最外层电子数为6,大于4个,易得到1个电子,形成阴离子,选项说法错误;故不符合题意;
C、④和②的质子数相同,所以④和②是同种元素。图中共有三中元素,选项说法错误;故不符合题意;
D、②属于稳定结构,④的最外层电子数为2,易失去最外层电子,所以化学性质不相似,选项说法错误;故不符合题意;
故选A。
【点睛】本题主要考查了离子结构示意图的有关知识,并应用知识进行分析解题的能力。
6.根据下列各组元素的粒子结构示意图分析:具有相似化学性质的一组是
A.①②B.①③C.②③D.①④
【答案】D
【详解】元素的化学性质与原子的最外层电子数关系密切。对于原子而言,最外层电子数相等的原子化学性质相似(氢、氦除外)。
A、①的原子最外层电子数为6,②的原子最外层电子数为1,最外层电子数不相等,化学性质不相似,故A错误;
B、①的原子最外层电子数为6,③的原子最外层电子数为2,最外层电子数不相等,化学性质不相似,故B错误;
C、②的原子最外层电子数为1,③的原子最外层电子数为2,最外层电子数不相等,化学性质不相似,故B错误;
D、①的原子最外层电子数为6,④的原子最外层电子数为6,,最外层电子数相等,化学性质相似,故D正确。
7.据科学家预测,月球的土壤中吸附着百万吨的氦(He﹣3),其原子核中质子数为2、中子数为1,每百吨氦(He﹣3)核聚变所释放出的能量相当于目前人类一年消耗的能量。下列关于氦(He﹣3)元素的说法正确的是( )
A.原子核外电子数为3B.相对原子质量为2
C.原子结构示意图为D.原子结构示意图为
【答案】D
【详解】A、在原子中,质子数=核外电子数,氦原子中质子数为2,则核外电子数为2,该选项说法不正确;
B、由于相对原子质量≈质子数+中子数=2+1=3,该选项说法不正确;
C、氦原子的质子数为2,核外电子数为2,原子结构示意图为 ,该选项说法不正确;
D、氦原子结构示意图为,该选项说法正确。
故选D。
8.将下列有关选项的序号填入以下各项的空格内:
①质子数 ②中子数 ③最外层电子数 ④原子核
(1)原子的核电荷数取决于原子结构中的 ;
(2)原子的相对原子质量取决于原子结构中的 ;
(3)原子的质量主要集中在原子结构中的 ;
(4)元素的化学性质主要取决于原子结构中的 .
【答案】 ① ①② ④ ③
【详解】(1)原子是由原子核和核外电子构成的,其中核电荷数是由核内质 子数决定的,所以原子的核电荷数取决于原子结构中的质子数;
(2)原子的相对原子质量等于质子数加中子数,所以原子的相对原子质量取决于原子结构中的质子数和中子数;
(3)一个质子的质量约等于一个中子质量约等于一个电子质量的 1836 倍,原子 核包括质子和中子,所以原子的质量主要集中在原子核上;
(4)最外层电子数大于或等于 4 易得电子,最外层电子数少于 4,易失去电子, 所以决定元素化学性质的是最外层电子数.
故答案为:(1)①;(2)①②;(3)④;(4)③.
9.用锶(Sr)等材料制成的原子钟精准度极高,常被用于卫星的精准计时。图1是锶原子的结构示意图。图2是几种粒子的结构示意图。
(1)图1中x= ;
(2)图2中与锶原子化学性质相似的原子是 (填化学符号);
(3)已知原子的核外电子层数越多,原子半径越大,当核外电子层数相等时,核电荷数越多,原子半径越小。B~D中半径最大的原子是 (填字母)。
【答案】(1)18
(2)Mg
(3)C
【详解】(1)图1是锶原子的结构示意图,在原子中,质子数=核外电子数,即38=2+8+x+8+2,解得x=18;
(2)原子的最外层电子数相同,元素的化学性质相似,锶原子最外层有2个电子,所以图2中与锶原子化学性质相似的是C,C中质子数=核外电子数=12,是镁原子,其微粒化学符号是Mg;
(3)已知原子的核外电子层数越多,原子半径越大,当核外电子层数相等时,核电荷数越多,原子半径越小。B~D中半径最大的原子是C。
10.探秘原子结构
人类探索原子结构的奥秘,经历了漫长的过程。
(1)1897年,汤姆森发现了 提出原子是可分的,并提出原子模型如图所示。
(2)1911年,物理学家卢瑟福用一束带正电的、质量比电子大得多的高速粒子轰击金箔,预期这些粒子会毫不费力地击穿金原子,到达对面的探测板上,结果发现:绝大多数粒子穿过金箔后仍保持原来的运动方向,少数粒子发生了较大角度的偏转,极少数粒子被反弹回来。
①当粒子轰击金箔时,下图四条运动轨迹中不可能出现的是(填序号) 。
②卢瑟福根据实验现象推测:原子中心有一个结构(原子核),它具有如下特点 。
(3)用高能粒子轰击原子核是研究微观粒子的一种常用方法。
1938年,德国科学家哈恩用中子轰击铀235原子(质子数为92,相对原子质量是235,元素符号为U),得到了质子数为56的钡原子,并用下图模型定义该变化。
①原子中,中子数是 。
②上述变化是不是化学变化 ,理由是 。
【答案】(1)电子
(2) C 质量大,体积小,带正电
(3) 143 不是 原子的种类发生了改变
【详解】(1)1897年,汤姆森发现了电子,提出原子是可分的;
(2)①当a粒子轰击金箔时,右图中四条运动轨迹不可能出现的是C,因为原子核和α粒子都带正电,同种电荷相互排斥,不可能出现偏向原子核方向的轨迹;
②多数a粒子穿过金箔后仍保持原来的运动方向,说明原子核体积很小,少数a粒子发生了较大角度的偏转,说明原子核带正电,极少数a粒子被反弹,说明原子核的质量很大;
(3)①235U原子中,中子数=相对原子质量-质子数=235-92=143;
②上述变化不是化学变化,因为化学变化中原子种类不变,而该变化中原子种类发生了改变;
11.阅读下面科普短文并回答问题。
研究发现,同种元素的原子核中,中子数不一定相同,如氢元素的原子核(如下表)。
为了更好地区别同种元素的不同原子,常用原子符号来表示质量数为A,质子数为z的X原子,其中质量数=质子数+中子数。如上述氕、氘、氚3种不同的氢原子就可以依次表示为.质子数相同而中子教不同的同一元素的不同原子互称为同位素。如互为同位素。同位素在生活、生产和科学研究中有着重要用途。例如考古时利用 测定一些文物的年代;通过测定和,分析古代人类的食物结构:追踪 发出的射线,确定磷在植物中的作用部位等。
(1)测定相对原子质量时,要使用含有6个质子和6个中子的一种碳原子质量的1/12作标准。该碳原子的原子符号为 .
(2)在中, 互为同位素的是 和 .
(3)的原子核内中子数是 .
(4)下列说法正确的是 (填字母)。
A 原子的结构示意图为
B 氘原子与氚原子的相对原子质量不同
C 由和 组成的1个水分子中含11个中子
D 氕、氘、氚3种氢原子最多可以组成6种不同的氢分子
【答案】 20 BD
【详解】(1)质量数=质子数+中子数,含有6个质子和6个中子的碳原子的质量数等于12。该碳原子的原子符号为。
(2)质子数相同而中子教不同的同一元素的不同原子互称为同位素,在中, 互为同位素的是和。
(3)的原子核内中子数是:35-15=20。
(4)A、的质子数为8,故原子结构示意图为:,故A错误;
B、氘原子与氚原子的质子数相同,中子数不同,相对原子质量不同,故B正确;
C、由和 组成的1个水分子中含12个中子,故C错误;
D、氕、氘、氚3种氢原子最多可以组成6种不同的氢分子H2 、D2 、T2 、HD、HT、DT,故D正确。
故选BD。
12.1910年英国科学家卢瑟福进行了著名的α粒子轰击金箔实验。实验做法如图所示:
①放射源−−放射性物质放出α粒子(带正电荷),质量是电子质量的7000倍。
②金箔−−作为靶子,厚度1μm,重叠了3000层左右的原子。
③荧光屏−−α粒子打在上面发出闪光。
④显微镜−−通过显微镜观察闪光,且通过360度转动可观察不同角度α粒子的到达情况。
【收集证据】绝大多数α粒子穿过金箔后仍沿原来的方向前进,但是有少数α粒子却发生了较大的偏转,并且有极少数α粒子的偏转超过90∘,有的甚至几乎达到180∘,像是被金箔弹了回来。
【猜想与假设】α粒子遇到电子后,就像飞行的子弹碰到灰尘一样运动方向不会发生明显的改变,而结果却出乎意料,除非原子的大部分质量集中到了一个很小的结构上,否则大角度的散射是不可能的。
【解释与结论】
(1)已知金的原子核带79个单位的正电荷,金原子的相对原子质量是197,则金原子核内含有的粒子及个数分别是 。
(2)卢瑟福所说的“除非原子的大部分质量集中到了一个很小的结构上”中的“很小的结构”指的是 。
(3)1μm金箔包含了3000层金原子,绝大多数α粒子穿过后方向不变,说明_______。
A.原子是实心的B.原子内部绝大部分空间是空的
C.原子的质量是均匀分布的D.原子中心有一个很大的核
【答案】(1)质子79个、中子118个
(2)原子核
(3)B
【详解】(1)在原子中,核电荷数=质子数=核外电子数,金原子的核电荷数为79,即金原子的核内有79个质子,核外有79个电子,又因为相对原子质量=质子数+中子数,所以金原子核内的中子数为:197-79=118个,即金原子中由79个质子和118个中子构成原子核;
(2)原子的质量主要集中在原子核上,卢瑟福提出“除非原子的大部分质量集中到了一个很小的结构上”,这里的“很小的结构”是指原子中的结构就是原子核;
(3)1μm金箔包含了3000层金原子,绝大多数α粒子穿过后方向不变,这是由于它们穿过了原子内部的空间,这也说明原子内部绝大部分空间是空的;故选B。
1.了解原子的构成及构成粒子之间的关系。
2.了解原子结构模型的发展历程,体会模型方法在微观世界研究中的作用。
3.了解原子核外的电子的排布特点,知道原子结构示意图的表示方法,并了解结构与性质的关系。
重点:
构成原子的粒子及相互之间的关系
难点:
核外电子的分层排布和原子结构示意图的意义
原子种类
最外层电子数
化学性质
稀有气体原子
=8(He为2)
相对稳定结构,不易得失电子
金属原子
一般<4
易失电子,形成阳离子,化学性质比较活泼
非金属原子
一般≥4
易得电子,形成阴离子,化学性质比较活泼
原子种类
质子数
中子数
核外电子数
氢
1
0
1
碳
6
6
6
氧
8
8
8
钠
11
12
11
镁
12
12
12
氯
17
18
17
氧元素的原子核
原子名称
质子数(Z)
中子数(N)
1
0
氕
1
1
氘
1
2
氚
初中化学人教版(2024)九年级上册(2024)课题1 分子和原子学案: 这是一份初中化学人教版(2024)九年级上册(2024)<a href="/hx/tb_c4049533_t4/?tag_id=42" target="_blank">课题1 分子和原子学案</a>,共51页。学案主要包含了物质由微观粒子构成,微粒的性质,探究分子运动现象的实验,分子可以分为原子,原子等内容,欢迎下载使用。
初中化学人教版(2024)九年级上册(2024)课题3 制取氧气导学案及答案: 这是一份初中化学人教版(2024)九年级上册(2024)<a href="/hx/tb_c4049528_t4/?tag_id=42" target="_blank">课题3 制取氧气导学案及答案</a>,共48页。学案主要包含了过氧化氢分解制取氧气,催化剂与催化作用,分解反应等内容,欢迎下载使用。
初中化学人教版(2024)九年级上册(2024)第二单元 空气和氧气课题3 制取氧气学案: 这是一份初中化学人教版(2024)九年级上册(2024)<a href="/hx/tb_c4049528_t4/?tag_id=42" target="_blank">第二单元 空气和氧气课题3 制取氧气学案</a>,共36页。学案主要包含了氧气的工业制法,氧气的实验室制法,加热高锰酸钾制氧气等内容,欢迎下载使用。













