
- 人教版(2024)2024-2025学年九年级化学上册提升讲义3.1分子和原子(学生版+解析) 学案 0 次下载
- 人教版(2024)2024-2025学年九年级化学上册提升讲义3.2.1原子结构(上)(学生版+解析) 学案 0 次下载
- 人教版(2024)2024-2025学年九年级化学上册提升讲义3.3元素(学生版+解析) 学案 0 次下载
- 人教版(2024)2024-2025学年九年级化学上册提升讲义3.4第三单元物质构成的奥秘(单元复习学案)(学生版+解析) 学案 0 次下载
- 人教版(2024)2024-2025学年九年级化学上册提升讲义3.5第三单元物质构成的奥秘(单元专项训练)(学生版+解析) 试卷 0 次下载
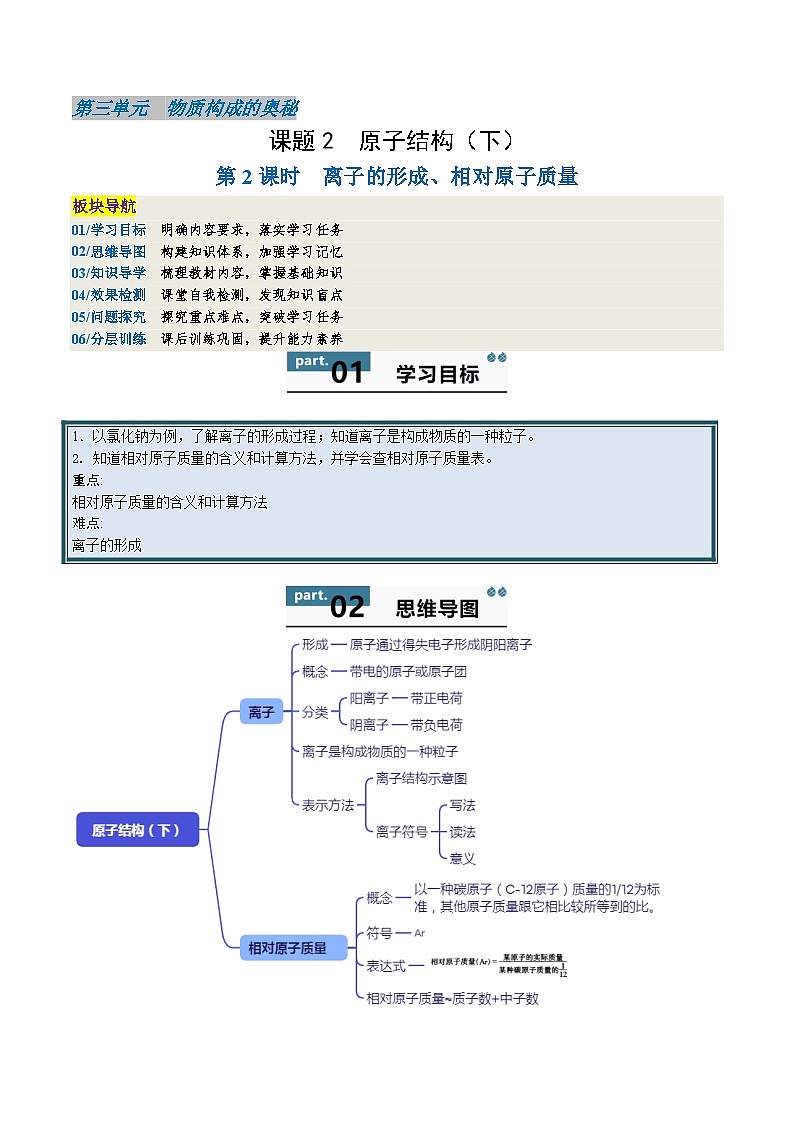
初中化学人教版(2024)九年级上册(2024)课题2 原子结构导学案
展开第2课时 离子的形成、相对原子质量
板块导航
01/学习目标 明确内容要求,落实学习任务
02/思维导图 构建知识体系,加强学习记忆
03/知识导学 梳理教材内容,掌握基础知识
04/效果检测 课堂自我检测,发现知识盲点
05/问题探究 探究重点难点,突破学习任务
06/分层训练 课后训练巩固,提升能力素养
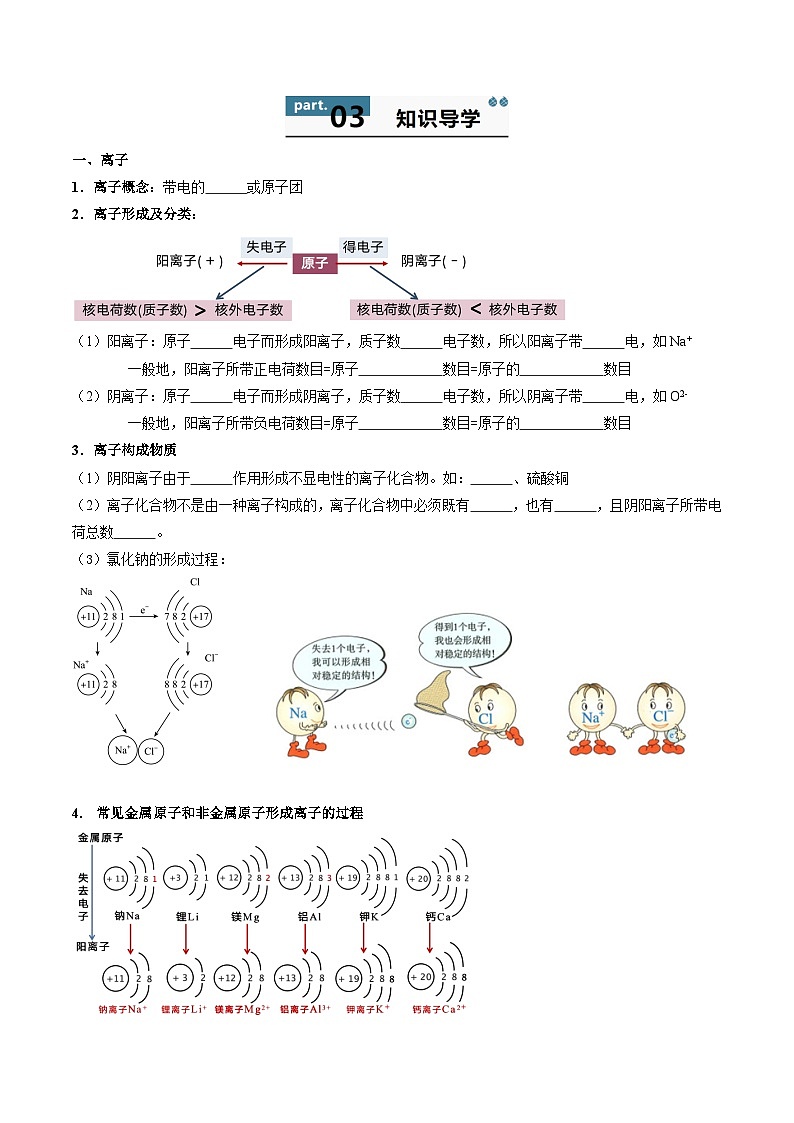
一、离子
1.离子概念:带电的 或原子团
2.离子形成及分类:
(1)阳离子:原子 电子而形成阳离子,质子数 电子数,所以阳离子带 电,如Na+
一般地,阳离子所带正电荷数目=原子 数目=原子的 数目
(2)阴离子:原子 电子而形成阴离子,质子数 电子数,所以阴离子带 电,如O2-
一般地,阳离子所带负电荷数目=原子 数目=原子的 数目
3.离子构成物质
(1)阴阳离子由于 作用形成不显电性的离子化合物。如: 、硫酸铜
(2)离子化合物不是由一种离子构成的,离子化合物中必须既有 ,也有 ,且阴阳离子所带电荷总数 。
(3)氯化钠的形成过程:
4. 常见金属原子和非金属原子形成离子的过程
(1)金属原子失去最外层电子形成阳离子,电子层数 ;
(2)非金属原子得到电子形成阴离子,电子层数 。
(3)离子形成过程中,原子质子数 ,所以原子的种类 ;核外电子数 ,最外层电子数 ,化学性质 。
5.离子表示方法
(1)离子结构示意图
离子所带电荷数 = 核内 - 核外 ,数值为 ,是 ;数值为 ,是
【易错提醒】
在结构示意图中:离子所带电荷数 = 数字 - 数字之和
(2)离子符号
= 1 \* GB3 ①离子符号写法:在元素符号右上角标明离子的 和 (用+、-表示), 在前,“ ”在后。若数字为1时,可省略不写。
例如:钠离子Na+;硫离子S2-。
= 2 \* GB3 ②离子符号读法:“××离子”或“带×个单位×电荷的×离子”
例如S2-读作“硫离子”或“带两个单位负电荷的硫离子”
Al3+读作“铝离子”或“带两个单位正电荷的铝离子”
= 3 \* GB3 ③离子符号表示的意义:表示 ;表示 。
例如:Fe3+ 表示一个铁离子;表示带3个单位正电荷的铁离子
= 4 \* GB3 ④离子符号右上角的数字的含义:表示 。
例如:Fe3+:3表示一个铁离子带3个单位的正电荷
= 5 \* GB3 ⑤离子符号前面的数字表示 。例如:2个钠离子:2Na+
6. 原子与离子的区别与联系
二、相对原子质量:
1.概念:以 为标准,
其他原子质量跟它相比较所等到的比。
2.符号:Ar
3.相对原子质量的表达式:
4.质子、中子的质量大约 (相对质量都约等于1),电子的质量 ,可忽略不计,故原子的质量主要集中在 上。相对原子质量≈ +
5.相对原子质量不是实际质量,实际质量之比等于 。
6.中国科学院院士 教授为相对原子质量的测定作出了卓越贡献。
1.判断题
(1)原子通过得失电子形成离子,但离于不能转化为原子。( )
(2)同种元素的原子和离子(如钠原子和钠离子)核外电子数相等( )
(3)钙原子失去两个电子形成的钙离子用 Ca2+ 表示。( )
(4)带电的微粒都是离子( )
(5)粒子得到或失去电子都能变成离子( )
(6)离子是带电荷的粒子,则带电荷的粒子一定是离子( )
(7)构成物质的微粒有分子、原子和离子。例如:水是由水分子构成的;铁是由铁原子构成的;氯化钠是由钠离子和氯离子构成的。( )
(8)2O2-表示2个氧离子( )
(9)卢瑟福在测定原子构成时做了如下实验:用粒子(带正电荷的氦核)轰击一张极薄的金箔,结果发现绝大多数粒子通过了金箔,极少数粒子发生偏转或被弹回。根据上述现象得出金原子带正电性( )
(10)质子数相同的两种粒子其核外电子数一定相等( )
(11)某种粒子的核电荷数少于核外电子数,这种粒子是分子( )
(12)科学家通过测定古生物遗骸的碳14含量,确认重庆市九龙波区冬笋坝遗址是我国最早的巴文化遗址。碳14原子的核电荷数为6,相对原子质量为14。关于碳14原子,它的质子数为6( )
(13)某种粒子的核电荷数少于核外电子数,这种粒子是阴离子( )
(14)原子内质子和中子的相对质量均约等于1。( )
(15)氮元素的相对原子质量为14g( )
(16)相对原子质量是原子质量跟一种碳原子质量的比值。( )
(17)相对原子质量就是原子质量。( )
(18)相对原子质量:以碳12原子质量的 作为标准,其他原子的质量跟它的比值。相对原子质量的单位是g。( )
(19)原子的质量主要集中在原子核上,相对原子质量的近似值为质子数和中子数之和。( )
(20)科学家通过测定古生物遗骸的碳14含量,确认重庆市九龙波区冬笋坝遗址是我国最早的巴文化遗址。碳14原子的核电荷数为6,相对原子质量为14。关于碳14原子,它的相对原子质量为14( )
(21)在相对原子质量测定方面做出卓越贡献的我国的科学家是屠呦呦( )
2.根据钠原子和氯原子的原子结构示意图和它们在元素周期表中所在的周期和族,判断这两种原子得失电子的情况。
钠原子的原子结构示意图;氯原子的原子结构示意图
(1)钠原子容易 电子,钠离子的符号是 ,像这种带正电的离子称为 离子;氯原子容易 电子,氯离子的符号 ,像这种带负电的离子称为 离子。
(2)规律总结:一般情况下,金属原子容易 电子变成 离子,带 电荷。非金属原子容易 电子变成 离子,带 电荷。 元素的原子既不易失电子也不易得电子。
3.如图是A、B、C、D四种粒子的结构示意图,请回答下列问题:
(1)图中四种粒子中属于同种元素的是 (填字母)。
(2)D 中x= 。
(3)A、B、C、D四种粒子中具有稳定结构的原子是 (填字母)。
(4)表示阳离子的是 ,表示阴离子的是 。
4.下列数据中属于原子质量的 属于原子的相对原子质量的 。
A.18g B.21 C.1.6×10-26 D.3.2×10-26 kg
5.已知氧的相对原子质量为16,硫的相对原子质量为32,则氧原子的实际质量与硫原子的实际质量之比为 。
►问题一 离子的概念及形成
【典例1】如图表示氯化钠微观形成过程。该过程说明原子通过 电子形成离子,其中阴离子是 离子(写出离子符号),最终形成的物质不显电性,原因是 。
【解题必备】
能金属原子最外层电子数一般小于4,在化学反应中容易失去最外层电子成为相对稳定结构,形成阳离子,带正电荷。
非金属原子最外层电子数一般大于4,在化学反应中容易得到电子成为相对稳定结构,形成阴离子,带负电荷。
【变式1-1】微粒a在一定条件下可转化为微粒b,过程如下图所示,变化前后保持不变的是
A.核电荷数B.化学性质C.核外电子数D.最外层电子数
【变式1-2】如图是某粒子的结构示意图,请回答下列问题。
(1)若x=18,则该粒子是 (填“原子”“阳离子”或“阴离子”)。
(2)若x=17,则该粒子的符号为 。
(3)若该粒子符号为X2+,则该粒子的核电荷数为 。
►问题二 离子中各类微粒之间的关系
【典例2】某元素原子A的质子数为z,已知B3-和A2+具有相同的核外电子数,则B元素的质子数为
A.z-2+3B.z-2-3C.z+2+3D.z+2-3
【解题必备】
阳离子比形成它的原子少一个电子层,所带电荷数等于失去的电子数。
阴离子离子与形成它的原子电子层数相同,所带电荷数等于得到的电子数。
离子所带电荷数的简单计算方法:用核内质子数减去核外电子数,所得数值为正,是阳离子;数值为负,是阴离子。
相对原子质量约等于质子数加中子数
【变式2-1】已知一种氧原子的原子核内含有8个质子和9个中子,则一个该种氧原子形成的阴离子(O2-)的核外电子数为
A.8B.9C.10D.17
【变式2-2】某阳离子A3+的核外有10个电子,核内有14个不带电的粒子,则A原子的质子数和相对原子质量分别是
A.10、24B.13、26C.13、27D.7、21
►问题三 离子符号的含义及书写
【典例3】请写出符合题目要求的化学符号或指定数字表示的意义:
(1)钠离子 ;铝离子 ;氯离子 ;氧离子 。
(2) 5个氯离子: ;2个铝离子: 。
(3)Ca2+中数字“2”的意义: 。
【解题必备】
1.常见的离子符号:H+;Na+;Mg2+;Al3+; F-; Cl-;O2-;S2-
2.离子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略。
3.离子符号右上角的数字表示离子所带电荷数;
4.离子符号前面的数字表示离子的个数
【变式3-1】爆炸性的高能N5+阳离子(氮元素的原子序数为7)被美国加州爱得华空军基地研究高能材料的化学家合成。关于N5+的说法正确的是 。
A.该粒子的电子数为34
B.该粒子的质子数为34
C.该粒子由5个氮分子构成
D.它是一种由5个氮原子构成的单质分子
【变式3-2】如图所示,用粒子结构示意图表示粒子,按要求填空:
(1)当X>10时,粒子表示 (填“原子”、“阳离子”“阴离子”);
(2)当粒子带2个单位正电荷时,X= ,离子符号为 。
(3)当粒子带1个单位负电荷时,X= ,离子符号为 。
►问题四 原子与离子的比较
【典例4】下列关于Mg、Mg2+两种粒子的判断中,正确的是
①核电荷数相同②核外电子数相同③电子层结构相同④质量几乎相等⑤质子数相等⑥Mg比Mg2+稳定
A.①④⑤B.①③⑤⑥C.①④⑤⑥D.②③④
【解题必备】
1.原子不带电荷,阳离子带正电荷,阴离子带负电荷;
2.原子中:质子数=电子数;阳离子中:质子数>电子数;阴离子中:质子数<电子数
3.原子变成阳离子,质子数不变,核外电子总数减少,最外层电子数改变,电子层减少一层;
原子变成阴离子,质子数不变,核外电子总数增加,最外层电子数改变,电子层数不变;
4.电子质量很小,看忽略不计,故原子变成离子后,质量基本不变,相对原子质量也不变。
【变式4-1】如图是五种微粒的结构示意图。下列说法错误的是
A.图中表示原子的是a、c、d
B.图中表示阴离子的是c、e
C.图中b微粒的化学符号为Mg2+
D.图中d微粒在化学反应中易失去电子
【变式4-2】根据下列粒子结构示意图,回答问题。
(1)A、B、C、E所示粒子中属于阳离子的是 ,若D为原子,m= 。
(2)E所示粒子在化学反应中容易 (填“得到”或“失去”)电子形成离子。其离子符号是 。
(3)A、B、C、E中具有相对稳定结构的是 。
►问题五 相对原子质量
【典例5】下列关于相对原子质量的说法,正确的是
A.采用相对原子质量后,就增大了原子的质量
B.碳原子的相对原子质量是
C.相对原子质量约等于质子数和电子数之和
D.两种原子的质量之比等于它们的相对原子质量之比
【解题必备】
1.相对原子质量是比值,没有质量单位;
2.两种原子的实际质量之比等于它们的相对原子质量之比;
3.相对原子质量约等于质子数加中子数。
【变式5-1】已知铝、镁、铜、铁的相对原子质量分别为:27、24、64、56,等质量的这四种 金属中所含原子个数最多的是
A.铝B.镁C.铜D.铁
【变式5-2】甲原子是碳--12原子质量的m倍,甲原子是乙原子质量的n倍,则乙原子的相对原子质量为
A. B. C. D.
1.某矿泉水成分表中列出了所含的主要离子,其中表示钠离子的是
A.B.C.D.
2.如图表示了氯化钠的形成过程,下列叙述中错误的是
A.在该反应中,电子起到了重要作用B.氯离子与氯原子的质子数相同
C.氯化钠是由钠原子和氯原子构成的D.反应中,钠原子的电子层数发生改变
3.回忆镁原子和硫原子结构示意图,下列说法错误的是
A.镁离子(Mg2+)核内有12个质子
B.硫离子可以通过失去电子变成硫原子
C.在化学反应中,硫原子容易失去2电子
D.镁离子与硫离子的最外层电子数相等
4.K+的核外电子排布与氩原子相同,已知钾的相对原子质量是39,则其原子核内中子数为
A.18B.19C.20D.39
5.下列关于Al和Al3+两种粒子的判断中,正确的是:
①核电荷数相等 ②核外电子数相等③质量几乎相等 ④质子数相等⑤化学性质相同 ⑥电子层数相等
A.①③④B.①④⑤C.②④⑥D.全部
6.已知M2+核外有x个电子,其相对原子质量为a,则该粒子含有的中子数为
A.a-x-2B.x+2C.a+x-2D.x-2
7.下列四种微粒的结构示意图中,说法正确的是( )
A.②和④两种粒子的化学性质相似
B.②表示的原子在化学反应中易得到电子
C.③④均表示的是阳离子
D.①表示的微粒符号是O-2
8.下列微观粒子结构示意图的相关叙述正确的是
A.②易得电子,④易失电子B.①带正电,②带负电
C.只有①③具有相对稳定结构D.①②③的原子的电子层数相同
9.已知一个硫原子的质量为m g,其相对原子质量为32,则一个相对原子质量为152的铕(Eu)原子的质量为
A.B.C.D.
10.硒被国内外医药界称为“长寿元素”和“心脏守护神”,硒的原子结构示意图如图1所示,硒的元素符号是Se,图2是一些常见原子的结构示意图。
(1)图1中x= ,硒在反应中易 (选填“得到”或“失去”)电子,形成的离子的符号是 。
(2)图2中具有相对稳定结构的是 ,与硒的化学性质相似的是 。(填序号)
11.在A、B、C、D是四种粒子的结构示意图。
根据以上信息回答:
(1)A、B、C、D中属于原子的是 (填序号);
(2)C元素形成离子时容易 电子,该离子的符号为 。
(3)A的化学性质与B、C、D中哪一种原子的化学性质相似 (填序号)。
(4)A、B、C、D中处于稳定结构的粒子是 (填序号)。
12.已知作为相对原子质量标准的一种碳原子的质量为1.993×10-26kg。
(1)若一个铝原子的质量为4.482×10-26kg,则铝原子的相对原子质量?
(2)若氧原子的相对原子质量为16,则一个氧原子的质量?
1.物质是直接或间接由原子构成的,原子又由电子、质子与中子等更微小的粒子所构成。若以○、●和分别代表电子、质子与中子,则下列各示意图中表示阳离子的是
A.B.C.D.
2.某阳离子A3+的核外有10个电子,核内有14个不带电的粒子,则A原子的核电荷数和相对原子质量分别是
A.10、24B.13、26C.13、27D.7、21
3.如图模型可以用来表示金属钠在氧气中燃烧形成氯化钠的是
A.B.
C.D.
4.下列关于Fe、Fe2+、Fe3+的说法正确的是
A.它们的质子数和中子数都不相同B.它们的最外层电子数相同
C.它们的性质完全相同D.它们的质量几乎相等
5.元素X的核电荷数为a,它的阴离子Xm﹣与元素Y的阳离子Yn+的电子层结构相同,则元素Y的核内质子数是
A.a+m+nB.a﹣m﹣nC.a﹣m+nD.a+m﹣n
6.下列是几种粒子的结构示意图,有关说法正确的是
A.①②是离子,③④是原子B.②③④对应的元素化学性质相似
C.③表示阳离子D.只有②③具有相对稳定结构
7.已知有有x个电子,其相对原子质量为M(M为整数),则这种元素的原子中含有的中子数为
A.B.C.D.
8.甲原子与乙原子的质量比为a:b,而乙原子质量是碳12原子质量的5倍,则甲原子的相对原子质量为
A.5a/12bB.60a/bC.5b/12aD.122a/5b
9.硒被国内外医药界称为“长寿元素”和“心脏守护神”,硒的原子结构示意图如图1所示,硒的元素符号是Se,图2是一些常见原子的结构示意图。
(1)图1中x= ,硒在反应中易 (选填“得到”或“失去”)电子,形成的离子的符号是 。
(2)图2中具有相对稳定结构的是 ,与硒的化学性质相似的是 。(填序号)
10.“见著知微,见微知著”是化学思维方法。
(1)微粒A、B、C、D、E中,对应原子结构化学性质最稳定的是 。(填序号)
(2)其中表示阳离子结构示意图的有 。表示的是金属原子结构示意图的有 。(填序号)
(3)如图是原子Sr形成的粒子结构示意图。原子Sr属于 (填“金属”或“非金属”)原子。下面所表示的粒子的化学符号是 。与Sr化学性质相似的是 (填序号)。
11.如图是六种粒子的结构示意图。请根据图回答下列问题:
(1)如图1,具有相对稳定结构的粒子是 (填字母,下同):属于金属原子的是 。
(2)图2是溴的原子结构示意图,x= ;溴的化学性质与图2中 (填字母序号)的化学性质相似。溴的符号为Br,请写出溴离子的化学符号 。
(3)如图是某粒子的结构示意图。试回答:
①当m-n>10时,该粒子为 (填“原子”、“阳离子”或“阴离子”)
②当n=8时,若该粒子带有1个单位的负电荷,则该粒子的符号为 ,若该粒子不显电性,则该粒子的符号为 ;若该粒子带有2个单位的正电荷,则该粒子的符号为 。
12.从镍氢电池到锂电池,再到钠电池、钾电池,科学家在不断提升电池的性能。
(1)金属失去电子后形成 离子,锂、钠、钾等原子很容易失去电子变成离子,所以常被用作电池材料。
(2)研究表明,半径越大的离子越容易在电池正负极之间移动,充电速度越快。如图是锂、钠、钾三种金属的离子半径大小,电池容量相同的这三种电池,充满电的时间最短的是 电池。
1.以氯化钠为例,了解离子的形成过程;知道离子是构成物质的一种粒子。
2. 知道相对原子质量的含义和计算方法,并学会查相对原子质量表。
重点:
相对原子质量的含义和计算方法
难点:
离子的形成
粒子种类
原子
离子
阳离子
阴离子
区别
粒子结构
质子数 电子数
质子数 电子数
质子数 电子数
粒子电性
不带电荷
带 电荷
带 电荷
是否达到稳定结构
最外层未达到稳定结构(稀有气体原子除外)
最外层达到稳定结构
最外层达到稳定结构
联系
原子质量
相对原子质量
来源与性质
实际测出来的,绝对的
比较得出的,相对的
数值
非常小,10-26~10-27级
大于或等于1
单位
有单位,如“g”“kg”等
有单位,为“1”,省略不写
第三单元 物质构成的奥秘
课题2 原子结构(下)
第2课时 离子的形成、相对原子质量
板块导航
01/学习目标 明确内容要求,落实学习任务
02/思维导图 构建知识体系,加强学习记忆
03/知识导学 梳理教材内容,掌握基础知识
04/效果检测 课堂自我检测,发现知识盲点
05/问题探究 探究重点难点,突破学习任务
06/分层训练 课后训练巩固,提升能力素养
一、离子
1.离子概念:带电的原子或原子团
2.离子形成及分类:
(1)阳离子:原子失去电子而形成阳离子,质子数>电子数,所以阳离子带正电,如Na+
一般地,阳离子所带正电荷数目=原子失去的电子数目=原子的最外层电子数目
(2)阴离子:原子得到电子而形成阴离子,质子数<电子数,所以阴离子带负电,如O2-
一般地,阳离子所带负电荷数目=原子得到的电子数目=原子的最外层电子数目
3.离子构成物质
(1)阴阳离子由于静电作用形成不显电性的离子化合物。如:氯化钠、硫酸铜
(2)离子化合物不是由一种离子构成的,离子化合物中必须既有阳离子,也有阴离子,且阴阳离子所带电荷总数相等。
(3)氯化钠的形成过程:
4.常见金属原子和非金属原子形成离子的过程
(1)金属原子失去最外层电子形成阳离子,电子层数减少1层;
(2)非金属原子得到电子形成阴离子,电子层数不改变。
(3)离子形成过程中,原子质子数不变,所以原子的种类不变;核外电子数改变,最外层电子数改变,化学性质改变。
5.离子表示方法
(1)离子结构示意图
离子所带电荷数 = 核内质子数 - 核外电子数,数值为正,是阳离子;数值为负,是阴离子
【易错提醒】
在结构示意图中:离子所带电荷数 = 圆圈内数字 - 弧线上数字之和
(2)离子符号
= 1 \* GB3 ①离子符号写法:在元素符号右上角标明离子的电荷数和电性(用+、-表示),数字在前,“+、-”在后。若数字为1时,可省略不写。
例如:钠离子Na+;硫离子S2-。
= 2 \* GB3 ②离子符号读法:“××离子”或“带×个单位×电荷的×离子”
例如S2-读作“硫离子”或“带两个单位负电荷的硫离子”
Al3+读作“铝离子”或“带两个单位正电荷的铝离子”
= 3 \* GB3 ③离子符号表示的意义:表示一个离子;表示带n个单位电荷的离子。
例如:Fe3+ 表示一个铁离子;表示带3个单位正电荷的铁离子
= 4 \* GB3 ④离子符号右上角的数字的含义:表示一个离子所带的电荷数。
例如:Fe3+:3表示一个铁离子带3个单位的正电荷
= 5 \* GB3 ⑤离子符号前面的数字表示离子个数。例如:2个钠离子:2Na+
6.原子与离子的区别与联系
二、相对原子质量:
1.概念:以一种碳原子(C-12原子)质量的1/12为标准,
其他原子质量跟它相比较所等到的比。
2.符号:Ar
3.相对原子质量的表达式:
4.相对原子质量不是实际质量,实际质量之比等于相对原子质量之比。
5.质子、中子的质量大约相等(相对质量都约等于1),电子的质量很小,可忽略不计,故原子的质量主要集中在原子核上。相对原子质量≈质子数+中子数
6.中国科学院院士张青莲教授为相对原子质量的测定作出了卓越贡献。
1.判断题
(1)原子通过得失电子形成离子,但离于不能转化为原子。( )
(2)同种元素的原子和离子(如钠原子和钠离子)核外电子数相等( )
(3)钙原子失去两个电子形成的钙离子用 Ca2+ 表示。( )
(4)带电的微粒都是离子( )
(5)粒子得到或失去电子都能变成离子( )
(6)离子是带电荷的粒子,则带电荷的粒子一定是离子( )
(7)构成物质的微粒有分子、原子和离子。例如:水是由水分子构成的;铁是由铁原子构成的;氯化钠是由钠离子和氯离子构成的。( )
(8)2O2-表示2个氧离子( )
(9)卢瑟福在测定原子构成时做了如下实验:用粒子(带正电荷的氦核)轰击一张极薄的金箔,结果发现绝大多数粒子通过了金箔,极少数粒子发生偏转或被弹回。根据上述现象得出金原子带正电性( )
(10)质子数相同的两种粒子其核外电子数一定相等( )
(11)某种粒子的核电荷数少于核外电子数,这种粒子是分子( )
(12)科学家通过测定古生物遗骸的碳14含量,确认重庆市九龙波区冬笋坝遗址是我国最早的巴文化遗址。碳14原子的核电荷数为6,相对原子质量为14。关于碳14原子,它的质子数为6( )
(13)某种粒子的核电荷数少于核外电子数,这种粒子是阴离子( )
(14)原子内质子和中子的相对质量均约等于1。( )
(15)氮元素的相对原子质量为14g( )
(16)相对原子质量是原子质量跟一种碳原子质量的比值。( )
(17)相对原子质量就是原子质量。( )
(18)相对原子质量:以碳12原子质量的 作为标准,其他原子的质量跟它的比值。相对原子质量的单位是g。( )
(19)原子的质量主要集中在原子核上,相对原子质量的近似值为质子数和中子数之和。( )
(20)科学家通过测定古生物遗骸的碳14含量,确认重庆市九龙波区冬笋坝遗址是我国最早的巴文化遗址。碳14原子的核电荷数为6,相对原子质量为14。关于碳14原子,它的相对原子质量为14( )
(21)在相对原子质量测定方面做出卓越贡献的我国的科学家是屠呦呦( )
【答案】(1) × (2) × (3) √ (4) × (5) × (6) × (7)√ (8) √ (9) × (10) × (11) × (12) √ (13) √ (14) √ (15) × (16) × (17) × (18) × (19)√ (20) √ (21) ×
2.根据钠原子和氯原子的原子结构示意图和它们在元素周期表中所在的周期和族,判断这两种原子得失电子的情况。
钠原子的原子结构示意图;氯原子的原子结构示意图
(1)钠原子容易 电子,钠离子的符号是 ,像这种带正电的离子称为 离子;氯原子容易 电子,氯离子的符号 ,像这种带负电的离子称为 离子。
(2)规律总结:一般情况下,金属原子容易 电子变成 离子,带 电荷。非金属原子容易 电子变成 离子,带 电荷。 元素的原子既不易失电子也不易得电子。
【答案】(1) 失去 Na+ 阳 得到 Cl- 阴
(2) 失去 阳 正 得到 阴 负 稀有气体
【详解】(1)根据钠原子的原子结构示意图可知,钠原子有3个电子层,最外层1个电子,在化学反应中容易失去1个电子,变成阳离子,离子符号为Na+;根据氯原子的原子结构示意图可知,氯原子有3个电子层,最外层7个电子,在化学反应中容易得到1个电子,变成阴离子,离子符号为Cl-。
(2)根据多种元素的原子在化学变化中的得失电子情况,可以得到以下规律:一般情况下,金属元素的原子最外层电子数小于4,容易失去最外层上的电子,形成带正电的阳离子;非金属元素的原子最外层电子数大于4,一般容易得到电子,形成带负电的阴离子。阴阳离子相互吸引就形成了化合物。稀有气体元素的原子最外层电子已达到稳定结构,既不易失电子也不易得电子,化学性质稳定。
3.如图是A、B、C、D四种粒子的结构示意图,请回答下列问题:
(1)图中四种粒子中属于同种元素的是 (填字母)。
(2)D 中x= 。
(3)A、B、C、D四种粒子中具有稳定结构的原子是 (填字母)。
(4)表示阳离子的是 ,表示阴离子的是 。
【答案】(1)A、B
(2)8
(3)D
(4) A C
【详解】(1)依据质子数相同的元素是同种元素,由图示可知四种微粒中A、B质子数相同是同种元素;
(2)由于原子中质子数与核外电子数相等,观察可知该微粒的质子数是18,是具有稳定结构的氩原子,所以核外电子数也应为18,所以x为8;
(3)根据核外电子层排布,最外层为电子数为8属于稳定结构,由粒子结构示意图可知具有稳定结构的原子是D;
(4)A的质子数>电子数是阳离子;C的质子数<电子数是阴离子。
4.下列数据中属于原子质量的 属于原子的相对原子质量的 。
A.18g B.21 C.1.6×10-26 D.3.2×10-26 kg
【答案】 D B
【详解】原子质量的单位可以为kg,属于原子质量的数据是3.2×10-26 kg,原子的相对原子质量是指该原子的实际质量与碳原子质量的的比值,相对原子质量是一个比值,单位是“1”,常省略不写,属于原子的相对原子质量的的数据是21。
5.已知氧的相对原子质量为16,硫的相对原子质量为32,则氧原子的实际质量与硫原子的实际质量之比为 。
【答案】1:2
【分析】相对原子质量是以一个碳-12原子质量的作为标准,一个原子的质量跟一个碳-12原子质量的的比值,为该原子的相对原子质量;相对原子质量与真实质量成正比,相对原子质量之比等原子质量之比,据此进行分析解答。
【详解】相对原子质量是以一个碳-12原子质量的作为标准,一个原子的质量跟一个碳-12原子质量的的比值,为该原子的相对原子质量;相对原子质量与真实质量成正比,已知氧原子的相对原子质量与硫原子的相对原子质量之比为16:32=1:2,则氧原子的实际质量与硫原子的实际质量之比也为1:2。
►问题一 离子的概念及形成
【典例1】如图表示氯化钠微观形成过程。该过程说明原子通过 电子形成离子,其中阴离子是 离子(写出离子符号),最终形成的物质不显电性,原因是 。
【答案】 得失 Cl- 电荷数相等,电性相反
【详解】如图表示氯化钠微观形成过程,该过程说明原子通过得失电子形成离子的,其中氯原子得到电子形成阴离子,符号为:Cl-;两种离子所带电荷数相等,电性相反,所以最终形成氯化钠不显电性;故答案为:得失;Cl-;电荷数相等,电性相反。
【解题必备】
能金属原子最外层电子数一般小于4,在化学反应中容易失去最外层电子成为相对稳定结构,形成阳离子,带正电荷。
非金属原子最外层电子数一般大于4,在化学反应中容易得到电子成为相对稳定结构,形成阴离子,带负电荷。
【变式1-1】微粒a在一定条件下可转化为微粒b,过程如下图所示,变化前后保持不变的是
A.核电荷数B.化学性质C.核外电子数D.最外层电子数
【答案】A
【详解】A、由图可知,变化前后,核电荷数不变,均是17,符合题意;
B、变化过程中,a粒子得到1个电子变为b粒子,故最外层电子数发生了改变,化学性质发生了改变,不符合题意;
C、由图可知,核外电子数发生了改变,微粒a中核外电子数为17,微粒b中核外电子数为18,不符合题意;
D、由图可知,最外层电子数发生了改变,微粒a中最外层电子数为7,微粒b中最外层电子数为8,不符合题意。
故选A。
【变式1-2】如图是某粒子的结构示意图,请回答下列问题。
(1)若x=18,则该粒子是 (填“原子”“阳离子”或“阴离子”)。
(2)若x=17,则该粒子的符号为 。
(3)若该粒子符号为X2+,则该粒子的核电荷数为 。
【答案】(1)原子
(2)Cl-
(3)20
【详解】(1)若x=18。质子数=核外电子数,则该粒子是原子;
(2)若x=17,质子数=17,核外电子数=2+8+8=18,质子数<核外电子数,则该粒子表示氯离子,符号为Cl-;
(3)若该粒子符号为X2+,表示该原子失去2个电子形成的阳离子,则该粒子的原子的核外电子数为2+8+8+2=20,根据在原子中,质子数=核外电子数=核电荷数,则该粒子的核电荷数为20。
►问题二 离子中各类微粒之间的关系
【典例2】某元素原子A的质子数为z,已知B3-和A2+具有相同的核外电子数,则B元素的质子数为
A.z-2+3B.z-2-3C.z+2+3D.z+2-3
【答案】B
【详解】在原子中,质子数=核外电子数,设元素B的质子数是y,某元素原子A的质子数为z,则A原子的核外电子数为z,所以阳离子A2+为A原子失去两个电子形成的,则A2+的核外电子数等于z-2,同理阳离子B3-是B原子得到3个电子形成的,则B3-的核外电子数为y+3,因为B3+和A2+具有相同的电子层结构,即核外电子数相同;所以z-2=y+3,即y=z-2-3;
故选:B。
【解题必备】
阳离子比形成它的原子少一个电子层,所带电荷数等于失去的电子数。
阴离子离子与形成它的原子电子层数相同,所带电荷数等于得到的电子数。
离子所带电荷数的简单计算方法:用核内质子数减去核外电子数,所得数值为正,是阳离子;数值为负,是阴离子。
相对原子质量约等于质子数加中子数
【变式2-1】已知一种氧原子的原子核内含有8个质子和9个中子,则一个该种氧原子形成的阴离子(O2-)的核外电子数为
A.8B.9C.10D.17
【答案】C
【详解】原子中质子数=核外电子数,则该种氧原子的核外电子数为8,O2-是氧原子得到2个电子形成的,则核外电子数为8+2=10,故选C。
【变式2-2】某阳离子A3+的核外有10个电子,核内有14个不带电的粒子,则A原子的质子数和相对原子质量分别是
A.10、24B.13、26C.13、27D.7、21
【答案】C
【详解】原子是由原子核和核外电子构成的,原子核是由质子和中子构成,其中质子带正电,电子带负电,中子不带电,某阳离子A3+的核外有10个电子,且A3+是由A原子失去3个电子形成的,则A原子的核外电子数为10+3=13,又由于原子的质子数=核外电子数,则A原子的质子数为13;核内有14个不带电的粒子,则中子数为14,由于原子的相对原子质量≈质子数+中子数,则A原子的相对原子质量为13+14=27,故选C。
►问题三 离子符号的含义及书写
【典例3】请写出符合题目要求的化学符号或指定数字表示的意义:
(1)钠离子 ;铝离子 ;氯离子 ;氧离子 。
(2) 5个氯离子: ;2个铝离子: 。
(3)Ca2+中数字“2”的意义: 。
【答案】(1) Na+;Al3+; Cl-; O2-
(2) 5Cl-;2Al3+
(3)1个钙离子带2个单位正电荷
【详解】(1)离子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略,若表示多个该离子,就在其离子符号前加上相应的数字,则钠离子可表示为Na+,故填:Na+;Al3+;Cl-;O2-
(2)在离子符号前面加数字表示离子的个数。故填:5Cl-;2Al3+。
(3)标在元素符号右上角的数字表示离子所带电荷数,因此Ca2+中“2”的意义:一个钙离子带2个单位的正电荷。故填:一个钙离子带2个单位的正电荷。
【解题必备】
1.常见的离子符号:H+;Na+;Mg2+;Al3+; F-; Cl-;O2-;S2-
2.离子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略。
3.离子符号右上角的数字表示离子所带电荷数;
4.离子符号前面的数字表示离子的个数
【变式3-1】爆炸性的高能N5+阳离子(氮元素的原子序数为7)被美国加州爱得华空军基地研究高能材料的化学家合成。关于N5+的说法正确的是 。
A.该粒子的电子数为34
B.该粒子的质子数为34
C.该粒子由5个氮分子构成
D.它是一种由5个氮原子构成的单质分子
【答案】 A
【分析】A、由于氮原子的质子数是7,所以其电子数也为7,则5个氮原子的电子数是35,而N5+是N5失去一个电子得到的微粒,所以N5+的核外电子数为34,故A正确;
B、由于氮原子的质子数是7,所以5个氮原子的质子数是35,而形成N5+后其质子数未变,所以其质子数为35个,故B错误。
C、离子和分子都是构成物质的微粒,在该离子中是由5个原子失去1个电子构成,故C错误;
D、N5+阳离子是一种由5个氮原子构成的离子,而不是单质分子,故D错误。
故选A。
【变式3-2】如图所示,用粒子结构示意图表示粒子,按要求填空:
(1)当X>10时,粒子表示 (填“原子”、“阳离子”“阴离子”);
(2)当粒子带2个单位正电荷时,X= ,离子符号为 。
(3)当粒子带1个单位负电荷时,X= ,离子符号为 。
【答案】(1)阳离子
(2) 12 Mg2+
(3) 9 F-
【详解】(1)当X>10时,即质子数大于电子数,则该粒子带正电荷,属于阳离子。故填:阳离子。
(2)当粒子带2个单位正电荷时,则说明其是由原子失去2个电子形成的,因此原子的电子数是2+8+2=12,质子数=电子数=12 。12号元素是镁元素,因此镁离子表示为:Mg2+。故填:12;Mg2+。
(3)当粒子带1个单位负电荷时,说明其是由原子得到1个电子形成的,因此原子的电子数是10-1=9。因此质子数=电子数=9,9号元素是氟元素,则带一个负电荷的氟离子表示为:F-。故填:9;F-。
►问题四 原子与离子的比较
【典例4】下列关于Mg、Mg2+两种粒子的判断中,正确的是
①核电荷数相同②核外电子数相同③电子层结构相同④质量几乎相等⑤质子数相等⑥Mg比Mg2+稳定
A.①④⑤B.①③⑤⑥C.①④⑤⑥D.②③④
【答案】A
【详解】①镁原子失去2个电子后形成镁离子,质子数没有发生改变,所以核电荷数相同,正确;
②镁原子失去2个电子后形成镁离子,所以核外电子数不相同,错误;
③镁原子失去2个电子后形成镁离子,它们电子层结构不相同,错误;
④镁原子失去2个电子后形成镁离子,电子的质量很小,所以质量几乎相等,正确;
⑤镁原子失去2个电子后形成镁离子,质子数没有发生改变,所以质子数相等,正确;
⑥镁原子失去2个电子后形成镁离子,镁离子最外层电子数为8,所以Mg2+比Mg稳定,错误。
正确的有①④⑤;
故选A。
【解题必备】
原子不带电荷,阳离子带正电荷,阴离子带负电荷;
2.原子中:质子数=电子数;阳离子中:质子数>电子数;阴离子中:质子数<电子数
3.原子变成阳离子,质子数不变,核外电子总数减少,最外层电子数改变,电子层减少一层;
原子变成阴离子,质子数不变,核外电子总数增加,最外层电子数改变,电子层数不变;
4.电子质量很小,看忽略不计,故原子变成离子后,质量基本不变,相对原子质量也不变。
【变式4-1】如图是五种微粒的结构示意图。下列说法错误的是
A.图中表示原子的是a、c、d
B.图中表示阴离子的是c、e
C.图中b微粒的化学符号为Mg2+
D.图中d微粒在化学反应中易失去电子
【答案】B
【详解】A.a、c、d粒子质子数=核外电子数,均为原子,该选项说法正确;
B.c为原子,e粒子质子数<核外电子数,为阴离子,b粒子质子数>核外电子数,为阳离子,该选项说法错误;
C.b粒子的质子数为12,对应的元素为镁元素,且由图可知,b粒子为带两个单位正电荷的镁离子,符号为Mg2+,该选项说法正确;
D.d粒子最外层电子数为1,易失去电子,该选项说法正确,
故选B。
【变式4-2】根据下列粒子结构示意图,回答问题。
(1)A、B、C、E所示粒子中属于阳离子的是 ,若D为原子,m= 。
(2)E所示粒子在化学反应中容易 (填“得到”或“失去”)电子形成离子。其离子符号是 。
(3)A、B、C、E中具有相对稳定结构的是 。
【答案】(1) B 6
(2) 得到 Cl-
(3)A、B
【详解】(1)阳离子核内质子数大于核外电子数,所以A、B、C、E所示粒子中属于阳离子的是B;原子中,核内质子数与核外电子数相等,则:16=2+8+m,m=6。故填:B;6。
(2)E所示粒子最外层电子数为7,多于4个,在化学反应中容易得到1个电子,形成带1个单位负电荷的阴离子,其离子符号是Cl-。故填:得到;Cl-。
(3)粒子最外层有8个电子(氦原子只有一层电子,氦为2个电子),这样的结构被认为是一种相对稳定结构,所以A、B、C、E中具有相对稳定结构的是A、B,故填:A、B。
►问题五 相对原子质量
【典例5】下列关于相对原子质量的说法,正确的是
A.采用相对原子质量后,就增大了原子的质量
B.碳原子的相对原子质量是
C.相对原子质量约等于质子数和电子数之和
D.两种原子的质量之比等于它们的相对原子质量之比
【答案】D
【详解】A、相对原子质量是以一种碳原子(即碳-12原子)质量的作为标准,其它原子的质量(实际质量)跟它相比较所得的值,采用相对原子质量后,并没有增大原子的质量,不符合题意;
B、碳原子的相对原子质量是 12。相对原子质量是一个比值,单位为“1”,常省略不写,不符合题意;
C、相对原子质量约等于质子数和中子数之和,不符合题意;
D、相对原子质量是以一种碳原子(即碳-12原子)质量的作为标准,其它原子的质量(实际质量)跟它相比较所得的值,故两种原子的质量之比等于它们的相对原子质量之比,符合题意。
故选D。
【解题必备】
相对原子质量是比值,没有质量单位;
两种原子的实际质量之比等于它们的相对原子质量之比;
相对原子质量约等于质子数加中子数。
【变式5-1】已知铝、镁、铜、铁的相对原子质量分别为:27、24、64、56,等质量的这四种 金属中所含原子个数最多的是
A.铝B.镁C.铜D.铁
【答案】B
【分析】本题考查相对原子质量的大小与原子个数之间的关系。
【详解】题干中各原子相对原子质量由小到大排列为:镁原子<铝原子<铁原子<铜,因为当四种金属质量相同时,含原子数最多的是相对原子质量最小的元素,所以所含原子个数最多的是镁原子,故B符合题意。
【点睛】原子的相对原子质量反映了其实际质量的大小,原子质量越大时其相对原子质量越大,所以当物质质量都相等的前提下,相对原子质量越大,所含的原子数越少;相对原子质量越小,所含的原子数越多。
【变式5-2】甲原子是碳--12原子质量的m倍,甲原子是乙原子质量的n倍,则乙原子的相对原子质量为
A. B. C. D.
【答案】A
【详解】乙原子的相对原子质量=,设乙原子的质量为1,则甲原子的质量为n,则碳-12原子的质量:,故乙原子的相对原子质量=;
故选A。
1.某矿泉水成分表中列出了所含的主要离子,其中表示钠离子的是
A.B.C.D.
【答案】A
【分析】离子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略,若表示多个该离子,就在其离子符号前加上相应的数字。
【详解】A、Na+表示钠离子,故A正确;
B、K+表示钾离子,故B错误;
C、Mg2+表示镁离子,故C错误;
D、Ca2+表示钙离子,故D错误;
故选:A。
2.如图表示了氯化钠的形成过程,下列叙述中错误的是
A.在该反应中,电子起到了重要作用B.氯离子与氯原子的质子数相同
C.氯化钠是由钠原子和氯原子构成的D.反应中,钠原子的电子层数发生改变
【答案】C
【详解】A.在该反应中,通过得失电子,使两者都形成相对稳定的结构,从而形成稳定的化合物,故选项叙述正确;
B.氯离子由氯原子得到一个电子形成的,氯原子核内质子数不变,则氯离子与氯原子的质子数相同,故选项叙述正确;
C.氯化钠是含金属元素和非金属元素的化合物,是由钠离子和氯离子构成的,故选项叙述不正确;
D.由图可知,反应中,钠原子失去最外层电子,电子层数由3层变成2层,故选项叙述正确;
故选:C。
3.回忆镁原子和硫原子结构示意图,下列说法错误的是
A.镁离子(Mg2+)核内有12个质子
B.硫离子可以通过失去电子变成硫原子
C.在化学反应中,硫原子容易失去2电子
D.镁离子与硫离子的最外层电子数相等
【答案】C
【详解】A、Mg原子的质子数等于核外电子数等于12,当失去电子变为离子时,质子数不变,则镁离子(Mg2+)核内有12个质子。A正确;
B、硫离子的化学式S2-,硫离子只可能得到2个电子,形成硫原子。所以使硫离子变为硫原子需失去2个电子。B正确;
C、硫原子最外层有6个电子,所以不易失去电子,更易得到2个电子,形成稳定结构。C错误;
D、 镁原子失去两个电子变成镁离子,最外层电子数变成8;硫原子的最外层电子数=6>4,在化学反应中,易得2个电子变成硫离子,最外层电子数为8。所以二者的最外层电子数相等。D正确。
综上所述:选择C。
4.K+的核外电子排布与氩原子相同,已知钾的相对原子质量是39,则其原子核内中子数为
A.18B.19C.20D.39
【答案】C
【详解】K+的核外电子排布与氩原子相同,氩原子的原子序数=质子数=核外电子数=18,故钾离子的核外电子数也是18,钾离子是钾原子失去1个电子形成的,故钾原子的核外电子数为18+1=19,根据在原子中,质子数=核外电子数,则钾原子的质子数为19,已知钾的相对原子质量是39,根据在原子中,相对原子质量=质子数+中子数,则其原子核内中子数为39-19=20;
故选:C。
5.下列关于Al和Al3+两种粒子的判断中,正确的是:
①核电荷数相等 ②核外电子数相等③质量几乎相等 ④质子数相等⑤化学性质相同 ⑥电子层数相等
A.①③④B.①④⑤C.②④⑥D.全部
【答案】A
【详解】Al3+是由Al失去3个电子形成的,则:
①两者核电荷数相等,正确;
②两者核外电子数不同,不正确;
③电子的质量很小,可忽略不计,则质量几乎相等,正确;
④质子数相同,正确;
⑤最外层电子数不同,化学性质不同,不正确;
⑥电子层数不同,不正确。
则正确的为①③④,故选A。
6.已知M2+核外有x个电子,其相对原子质量为a,则该粒子含有的中子数为
A.a-x-2B.x+2C.a+x-2D.x-2
【答案】A
【详解】已知M2+ 核外有x个电子,其相对原子质量为a, M2+是M原子失去两个电子形成的,故M原子核外电子数为 x+2 ;根据在原子中核内质子数=核外电子数,故M原子核内质子数为 x+2 ;根据相对原子质量≈质子数 + 中子数,故该粒子含有的中子数=相对原子质量 − 质子数 =a−(x+2)=a−x-2 ,故选:A。
7.下列四种微粒的结构示意图中,说法正确的是( )
A.②和④两种粒子的化学性质相似
B.②表示的原子在化学反应中易得到电子
C.③④均表示的是阳离子
D.①表示的微粒符号是O-2
【答案】C
【详解】A、元素的化学性质是由微粒最外层的电子数决定的,②和④两种粒子最外层电子数不相同,化学性质不相似,A选项错误;
B、当原子的最外层电子数小于4时,在化学反应中易失去电子,②表示的原子最外层电子数为2,易失去电子,B选项错误;
C、当质子数=核外电子数时为原子;当质子数大于核外电子数时,为阳离子;当质子数小于核外电子数时,为阴离子;③④表示的粒子质子数均大于核外电子数,均为阳离子,C选项正确;
D、①表示的微粒质子数小于核外电子数,是阴离子,故为氧离子;离子符号的书写就是在元素符号的右上方标明所带的电荷数及其正负,数值在前,正负号在后,所以①表示的微粒符号应为O2-,D选项错误。
故选C。
8.下列微观粒子结构示意图的相关叙述正确的是
A.②易得电子,④易失电子B.①带正电,②带负电
C.只有①③具有相对稳定结构D.①②③的原子的电子层数相同
【答案】D
【详解】A、微粒②中原子核最外层电子数为7,大于4,则化学反应中易得电子;④微粒中原子核外只有一个电子层,且已经有2个电子,则具有相对稳定结构,不容易得失电子,故选项说法错误。
B、①质子数>核外电子数,是镁离子结构,一个镁离子带2个单位正电荷;②中质子数和核外电子数相等,为氯原子结构,所以粒子②不带电,故选项说法错误;
C、微粒①③原子核最外层电子数都为8,则具有相对稳定结构;④微粒中原子核外只有一个电子层,且已经有2个电子,则也具有相对稳定结构,选项说法错误;
D、微粒①表示Mg2+,而Mg的原子核外有12个电子,原子结构示意图为,说明镁原子的电子层数为3;而②表示Cl原子,根据其原子结构示意图可知,氯原子的核外电子层数为3;③表示Ar原子,根据原子结构示意图可知,Ar原子的核外电子层数为3;所以Mg、Cl、Ar原子核外都有三个电子层,故选项说法正确;
故选D。
9.已知一个硫原子的质量为m g,其相对原子质量为32,则一个相对原子质量为152的铕(Eu)原子的质量为
A.B.C.D.
【答案】C
【详解】两个原子的相对原子质量比等于其实际质量比,故,铕原子质量 =。
故选C。
10.硒被国内外医药界称为“长寿元素”和“心脏守护神”,硒的原子结构示意图如图1所示,硒的元素符号是Se,图2是一些常见原子的结构示意图。
(1)图1中x= ,硒在反应中易 (选填“得到”或“失去”)电子,形成的离子的符号是 。
(2)图2中具有相对稳定结构的是 ,与硒的化学性质相似的是 。(填序号)
【答案】(1) 6 得到
(2) C D
【详解】(1)图1表示的是硒的原子结构示意图,在原子中电子数=质子数,由图1可知,硒原子的质子数为34,所以x=34-2-8-18=6;硒原子的最外层有6个电子,6>4,所以硒在反应中易得到2个电子,形成带2个单位负电荷的阴离子,离子符号为。
(2)最外层电子数为8(第一层为最外层是2)是相对稳定结构,所以图2中具有相对稳定结构的是C。最外层电子数相同的原子,化学性质相似,所以与硒的化学性质相似的是D。
11.在A、B、C、D是四种粒子的结构示意图。
根据以上信息回答:
(1)A、B、C、D中属于原子的是 (填序号);
(2)C元素形成离子时容易 电子,该离子的符号为 。
(3)A的化学性质与B、C、D中哪一种原子的化学性质相似 (填序号)。
(4)A、B、C、D中处于稳定结构的粒子是 (填序号)。
【答案】(1)ACD
(2) 失去 Mg2+
(3)D
(4)ABD
【详解】(1)在原子中,核电荷数(质子数)等于核外电子数,故A、B、C、D中属于原子的是ACD;
(2)C原子核电荷数为12,故C元素为镁元素,C最外层电子数为2<4,容易失去2个电子形成阳离子,对应的符号为Mg2+;
(3)元素化学性质与元素的原子最外层电子数相关,原子最外层电子数为8(第一层为2)具有相对稳定结构,故A是原子具有相对稳定结构,B、D也具有相对稳定结构,但B是离子,故A原子的化学性质与D原子的化学性质相似。
(4)最外层电子数为8(第一层为2)具有相对稳定结构,故A、B、C、D中处于稳定结构的粒子是ABD。
12.已知作为相对原子质量标准的一种碳原子的质量为1.993×10-26kg。
(1)若一个铝原子的质量为4.482×10-26kg,则铝原子的相对原子质量?
(2)若氧原子的相对原子质量为16,则一个氧原子的质量?
【答案】(1)该铝原子的相对原子质量=
(2)设一个氧原子的质量为x,则,x≈2.657×10-26kg
【分析】某原子的相对原子质量=。
【详解】(1)见答案;
(2)见答案。
1.物质是直接或间接由原子构成的,原子又由电子、质子与中子等更微小的粒子所构成。若以○、●和分别代表电子、质子与中子,则下列各示意图中表示阳离子的是
A.B.C.D.
【答案】B
【分析】核内质子数等于核外电子数为原子,核内质子数小于核外电子数为阴离子,核内质子数大于核外电子数为阳离子。
【详解】A、质子数1=电子数1,该微粒是原子,错误;
B、质子数3大于电子数2,该微粒是阳离子,正确;
C、质子数1小于电子数2,该微粒是阴离子,错误;
D、质子数2=电子数2,该微粒是原子,错误;
故选:B。
2.某阳离子A3+的核外有10个电子,核内有14个不带电的粒子,则A原子的核电荷数和相对原子质量分别是
A.10、24B.13、26C.13、27D.7、21
【答案】C
【详解】根据某阳离子A3+的核外有10个电子,可知A原子失去3个电子,核外有10个电子,则A原子的核外电子数为:。
根据原子中核电荷数=质子数=核外电子数,则A原子的核电荷数是13;
根据核内有14个不带电的粒子,可知中子数为14,则相对原子质量=质子数+中子数=13+14=27;
则A原子的核电荷数和相对原子质量分别是13;27;
故选:C。
3.如图模型可以用来表示金属钠在氧气中燃烧形成氯化钠的是
A.B.
C.D.
【答案】A
【详解】钠原子最外电子层只有1个电子,而氯原子最外电子层有7个电子。当金属钠在氯气中燃烧时,钠原子失去1个电子形成带1个正电荷的钠离子,氯原子得到1个电子形成带1个负电荷的氯离子,带有异种电荷的钠离子和氯离子之间相互作用,构成了氯化钠。
故选A。
4.下列关于Fe、Fe2+、Fe3+的说法正确的是
A.它们的质子数和中子数都不相同B.它们的最外层电子数相同
C.它们的性质完全相同D.它们的质量几乎相等
【答案】D
【详解】A、它们都属于铁元素,因属于同种元素的原子和离子,则它们的质子数和中子数相等,故选项错误;
B、Fe是原子,Fe2+、Fe3+原子失去电子变为阳离子,故它们的最外层电子数不相同,选项错误;
C、铁原子失去2个电子形成亚铁离子,失去3个电子形成铁离子,它们的最外层电子数不同,它们的性质不完全相同,选项错误;
D、这三种粒子不同点在于电子数不同,电子质量很小,可以忽略不计,原子核完全相同故它们的质量几乎相等,选项正确;
故选:D。
5.元素X的核电荷数为a,它的阴离子Xm﹣与元素Y的阳离子Yn+的电子层结构相同,则元素Y的核内质子数是
A.a+m+nB.a﹣m﹣nC.a﹣m+nD.a+m﹣n
【答案】A
【详解】由于X的核电荷数为a,Xm﹣是X原子得到m个电子才变成离子的,所以Xm﹣的电子数为a+m,Yn+的电子数也是a+m,但是Yn+是Y原子失去n个电子形成的,则Y原子的电子数为a+m+n,所以Y元素的质子数是a+m+n,故选A。
6.下列是几种粒子的结构示意图,有关说法正确的是
A.①②是离子,③④是原子B.②③④对应的元素化学性质相似
C.③表示阳离子D.只有②③具有相对稳定结构
【答案】C
【详解】A、①②中质子数=核外电子数,表示原子,③中质子数大于核外电子数,表示阳离子,④中质子数小于核外电子数,表示阴离子,不符合题意;
B、②是原子,③④是离子,它们虽然最外层电子数相同,但是对应的元素化学性质不相似,不符合题意;
C、③中质子数大于核外电子数,表示阳离子,符合题意;
D、②③④的最外层电子数均为8,均达到了相对稳定结构,不符合题意。
故选C。
7.已知有有x个电子,其相对原子质量为M(M为整数),则这种元素的原子中含有的中子数为
A.B.C.D.
【答案】D
【详解】相对原子质量=质子数+中子数,所以中子数=相对原子质量-质子数,在阴离子中,质子数=核外电子数-得到的电子数,在R-中,得到1个电子,所以质子数=x-1,所以中子数=M-(x-1)=M-x+1。
故选D。
8.甲原子与乙原子的质量比为a:b,而乙原子质量是碳12原子质量的5倍,则甲原子的相对原子质量为
A.5a/12bB.60a/bC.5b/12aD.122a/5b
【答案】B
【详解】设甲、乙原子的质量分别为m甲、m乙,碳12原子的质量为mc12,因为乙原子质量是碳12原子质量的5倍,所以乙原子的质量为5 mc12;因为甲原子与乙原子的质量比为a:b,即:m甲:m乙=a:b= m甲: 5 mc12,所以m甲=
甲原子的相对原子质量=;
答案:B。
9.硒被国内外医药界称为“长寿元素”和“心脏守护神”,硒的原子结构示意图如图1所示,硒的元素符号是Se,图2是一些常见原子的结构示意图。
(1)图1中x= ,硒在反应中易 (选填“得到”或“失去”)电子,形成的离子的符号是 。
(2)图2中具有相对稳定结构的是 ,与硒的化学性质相似的是 。(填序号)
【答案】(1) 6 得到
(2) C D
【详解】(1)图1表示的是硒的原子结构示意图,在原子中电子数=质子数,由图1可知,硒原子的质子数为34,所以x=34-2-8-18=6;硒原子的最外层有6个电子,6>4,所以硒在反应中易得到2个电子,形成带2个单位负电荷的阴离子,离子符号为。
(2)最外层电子数为8(第一层为最外层是2)是相对稳定结构,所以图2中具有相对稳定结构的是C。最外层电子数相同的原子,化学性质相似,所以与硒的化学性质相似的是D。
10.“见著知微,见微知著”是化学思维方法。
(1)微粒A、B、C、D、E中,对应原子结构化学性质最稳定的是 。(填序号)
(2)其中表示阳离子结构示意图的有 。表示的是金属原子结构示意图的有 。(填序号)
(3)如图是原子Sr形成的粒子结构示意图。原子Sr属于 (填“金属”或“非金属”)原子。下面所表示的粒子的化学符号是 。与Sr化学性质相似的是 (填序号)。
【答案】(1)B
(2) C DE/ED
(3) 金属 Sr2+ E
【详解】(1)微粒A、B、C、D、E中,最外层电子数为8是稳定结构,B和C最外层电子数均为8,根据在原子中,质子数=核外电子数,只有B表示的是原子,所以微粒A、B、C、D、E中,对应原子结构化学性质最稳定的是B;
(2)根据阳离子中,质子数大于核外电子数,故其中表示阳离子结构示意图的有C;金属元素最外层的电子数一般小于4,故表示的是金属原子结构示意图的有DE;
(3)由原子Sr形成的粒子结构示意图可知,元素Sr的原子的最外层电子数是38-2-8-18-8=2<4,为金属元素;由原子Sr形成的粒子结构示意图可知,核内质子数比核外的电子数多2个,该微粒是带两个正电荷的阳离子,符号为:Sr2+;最外层电子数决定元素的化学性质,最外层电子数相同的元素,化学性质相似。由于元素Sr的原子的外层电子数是2,E原子的最外层电子数也是2,具有相似的化学性质。
11.如图是六种粒子的结构示意图。请根据图回答下列问题:
(1)如图1,具有相对稳定结构的粒子是 (填字母,下同):属于金属原子的是 。
(2)图2是溴的原子结构示意图,x= ;溴的化学性质与图2中 (填字母序号)的化学性质相似。溴的符号为Br,请写出溴离子的化学符号 。
(3)如图是某粒子的结构示意图。试回答:
①当m-n>10时,该粒子为 (填“原子”、“阳离子”或“阴离子”)
②当n=8时,若该粒子带有1个单位的负电荷,则该粒子的符号为 ,若该粒子不显电性,则该粒子的符号为 ;若该粒子带有2个单位的正电荷,则该粒子的符号为 。
【答案】(1) ACE D
(2) 7 F Br-
(3) 阴离子 Cl- Ar Ca2+
【详解】(1)最外层电子排满具有相对稳定结构。最外层为第一层最多排2个电子,具有多个电子层最外层排满为8个电子,所以具有相对稳定结构的粒子是ACE;
原子序数=质子数,所以A、B、C、D、E、F分别为2号元素氦元素、8号元素氧元素,11号元素钠元素、12号元素镁元素,16号元素硫元素,17号元素氯元素。通过元素名称可知CD为金属元素的微粒,原子中质子数=核外电子数,C质子数≠核外电子数,是离子,D质子数=核外电子数,为原子。所以属于金属原子的是D。
(2)在原子中质子数=电子数,则35=2+8+18+x,解得x=7;
元素的化学性质跟它的原子的最外层电子数目关系非常密切,决定元素化学性质的是最外层电子数,溴原子的最外层电子数为7,则与其化学性质相似的粒子结构示意图中最外层电子数也应为7,F符合要求;
溴原子的最外层电子数为7,容易得到1个电子形成带1个负电荷的溴离子,表示为:Br-;
(3)①当m-n>10时,即m<10+n,所以质子数小于核外电子数,所以为阴离子;
②当n=8时,若该粒子带有1个单位的负电荷,即m=2+8+8-1=17,该元素为氯元素,则该粒子的符号为Cl-;
若该粒子不显电性,即m=2+8+8=18,是氩元素的原子,则该粒子的符号为Ar;
若该粒子带有2个单位的正电荷,即m=2+8+8+8+2=20,该粒子为钙离子,则该粒子的符号为 Ca2+。
12.从镍氢电池到锂电池,再到钠电池、钾电池,科学家在不断提升电池的性能。
(1)金属失去电子后形成 离子,锂、钠、钾等原子很容易失去电子变成离子,所以常被用作电池材料。
(2)研究表明,半径越大的离子越容易在电池正负极之间移动,充电速度越快。如图是锂、钠、钾三种金属的离子半径大小,电池容量相同的这三种电池,充满电的时间最短的是 电池。
【答案】(1) 阳 (2) 钾
【详解】(1)电子带负电,金属原子失去电子后形成带正电荷的阳离子,故填写:阳;
(2)由题意可知,研究表明,半径越大的金属离子越容易在电池正负极之间移动,充电速度越快,由锂、钠、钾三种金属的离子半径大小可得,钾离子的半径最大,电池容量相同的这三种电池,充满电的时间最短的是钾电池,故填写:钾。
1.以氯化钠为例,了解离子的形成过程;知道离子是构成物质的一种粒子。
2. 知道相对原子质量的含义和计算方法,并学会查相对原子质量表。
重点:
相对原子质量的含义和计算方法
难点:
离子的形成
粒子种类
原子
离子
阳离子
阴离子
区别
粒子结构
质子数=电子数
质子数>电子数
质子数<电子数
粒子电性
不带电荷
带正电荷
带负电荷
是否达到稳定结构
最外层未达到稳定结构(稀有气体原子除外)
最外层达到稳定结构
最外层达到稳定结构
联系
原子质量
相对原子质量
来源与性质
实际测出来的,绝对的
比较得出的,相对的
数值
非常小,10-26~10-27级
大于或等于1
单位
有单位,如“g”“kg”等
有单位,为“1”,省略不写
初中化学人教版(2024)九年级上册(2024)课题1 分子和原子学案: 这是一份初中化学人教版(2024)九年级上册(2024)<a href="/hx/tb_c4049533_t4/?tag_id=42" target="_blank">课题1 分子和原子学案</a>,共51页。学案主要包含了物质由微观粒子构成,微粒的性质,探究分子运动现象的实验,分子可以分为原子,原子等内容,欢迎下载使用。
初中化学人教版(2024)九年级上册(2024)课题3 制取氧气导学案及答案: 这是一份初中化学人教版(2024)九年级上册(2024)<a href="/hx/tb_c4049528_t4/?tag_id=42" target="_blank">课题3 制取氧气导学案及答案</a>,共48页。学案主要包含了过氧化氢分解制取氧气,催化剂与催化作用,分解反应等内容,欢迎下载使用。
初中化学人教版(2024)九年级上册(2024)第二单元 空气和氧气课题3 制取氧气学案: 这是一份初中化学人教版(2024)九年级上册(2024)<a href="/hx/tb_c4049528_t4/?tag_id=42" target="_blank">第二单元 空气和氧气课题3 制取氧气学案</a>,共36页。学案主要包含了氧气的工业制法,氧气的实验室制法,加热高锰酸钾制氧气等内容,欢迎下载使用。














