

所属成套资源:备考2025高考化学热点试题含解析答案
高考化学热点试题热点26反应原理综合题含解析答案
展开
这是一份高考化学热点试题热点26反应原理综合题含解析答案,共18页。试卷主要包含了掌握化学平衡的特征等内容,欢迎下载使用。
试题常以选择、填空、读图、作图、计算等形式出现。高考一般以与生产、生活联系紧密的物质为背景材料出组合题,各小题之间有一定独立性。考查内容:
1.了解化学反应速率的概念和定量表示方法。能正确计算化学反应的转化率(α)。
2.了解活化能的概念,了解催化剂的重要作用。
3.了解化学反应的可逆性及化学平衡的建立。
4.掌握化学平衡的特征。了解化学平衡常数(K)的含义,能利用化学平衡常数进行相关计算。
5.理解外界条件(浓度、温度、压强、催化剂等)对反应速率和化学平衡的影响,能用相关理论解释其一般规律。
6.了解化学反应速率和化学平衡的调控在生活、生产和科学研究领域中的重要作用。
1.能源的合理开发和利用,低碳减排是人类正在努力解决的大问题。2023年2月21日,中国气候变化特使谢振华获得首届诺贝尔可持续发展特别贡献奖,以表彰他在全球生态保护中做出的贡献。
(1)在298K、100kPa时,已知:
C(s,石墨)+O2(g)=CO2(g) △H1=-393.5kJ•ml-1;
H2(g)+O2(g)=H2O(l) △H2=-285.8kJ•ml-1;
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H3=-2599.0kJ•ml-1。
298K时,写出1mlC(s,石墨)和H2(g)反应生成C2H2(g)的热化学方程式: 。
(2)在固相催化剂作用下CO2加氢合成甲烷过程中发生以下两个反应:
主反应:CO2(g)+4H2(g)CH4(g)+2H2O(g) △H1=-156.9kJ•ml-1
副反应:CO2(g)+H2(g)CO(g)+H2O(g) △H2=+41.1kJ•ml-1
工业合成甲烷通常控制温度为500℃左右,其主要原因为 。
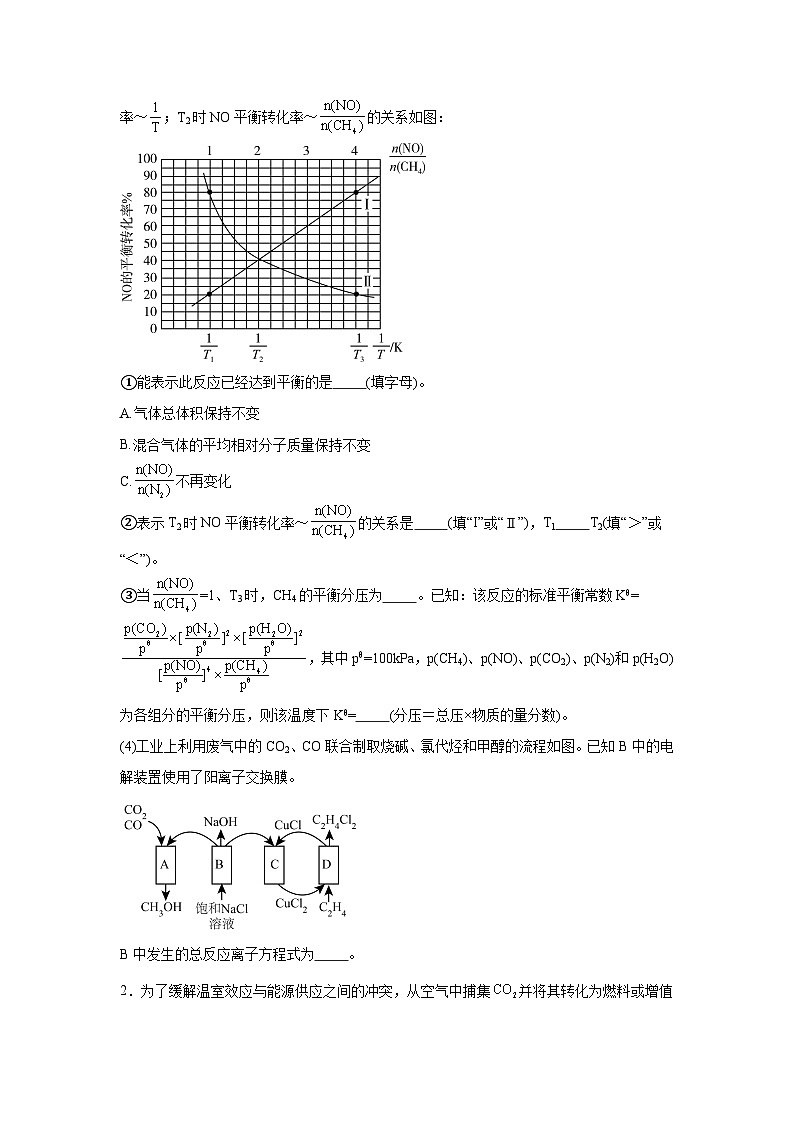
(3)向密闭容器中充入一定量的CH4(g)和NO(g),保持总压为100kPa,发生反应:CH4(g)+4NO(g)2N2(g)+CO2(g)+2H2O(g) △H<0。当=1时,NO的平衡转化率~;T2时NO平衡转化率~的关系如图:
①能表示此反应已经达到平衡的是 (填字母)。
A.气体总体积保持不变
B.混合气体的平均相对分子质量保持不变
C.不再变化
②表示T2时NO平衡转化率~的关系是 (填“I”或“Ⅱ”),T1 T2(填“>”或“<”)。
③当=1、T3时,CH4的平衡分压为 。已知:该反应的标准平衡常数Kθ=,其中pθ=100kPa,p(CH4)、p(NO)、p(CO2)、p(N2)和p(H2O)为各组分的平衡分压,则该温度下Kθ= (分压=总压×物质的量分数)。
(4)工业上利用废气中的CO2、CO联合制取烧碱、氯代烃和甲醇的流程如图。已知B中的电解装置使用了阳离子交换膜。
B中发生的总反应离子方程式为 。
2.为了缓解温室效应与能源供应之间的冲突,从空气中捕集并将其转化为燃料或增值化学品成为了新的研究热点,如甲醇的的制备。回答下列问题:
I.制备合成气:反应在工业上有重要应用。
(1)该反应在不同温度下的平衡常数如表所示。
①反应的ΔH 0(填“>”“<”或“=”)。
②反应常在较高温度下进行,该措施的优缺点是 。
(2)该反应常在Pd膜反应器中进行,其工作原理如图1所示。
①利用平衡移动原理解释反应器存在Pd膜时具有更高转化率的原因是 。
②某温度下,在Pd膜表面上的解离过程存在如下平衡:,其正反应的活化能远小于逆反应的活化能。下列说法错误的是 (填标号)。
A.Pd膜对气体分子的透过具有选择性
B.过程2的ΔH>0
C.加快Pd膜内H原子迁移有利于的解离
D.H原子在Pd膜表面上结合为的过程为放热反应
Ⅱ.合成甲醇:在体积不变的密闭容器中投入 0.5ml CO 和 1ml H2,不同条件下发生反应:CO(g)+2H2(g) CH3OH(g)。实验测得平衡时H2的转化率随温度、压强的变化如图 2 所示。
(3)图2中X代表 (填“温度”或“压强”)。若图2中M 点对应的容器体积为5 L,则N点的平衡常数K为 。
(4)图3中正确表示该反应的平衡常数的负对数pK(pK=−lgK)与X 的关系的曲线 (填“AC”或“AB”)。
(5)通过光催化、光电催化或电解水制氢来进行二氧化碳加氢制甲醇(CH3OH),发生的主要反应是CO2(g)+3H2(g)CH3OH(g)+H2O(g)。若二氧化碳加氢制甲醇的反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明该反应进行到 t1时刻达到平衡状态的是 (填标号)。
a. b. c. d.
3.绿色能源是未来能源发展的方向,积极发展氢能,是实现“碳达峰、碳中和”的重要举措,可以用以下方法制备氢气。
I.甲烷和水蒸气催化制氢气。主要反应如下:
i.CH4(g)+H2O(g)CO(g)+3H2(g) △H=+206.2kJ•ml-1
ii.CO(g)+H2O(g)CO2(g)+H2(g) △H=-41.2kJ•ml-1
(1)反应CH4(g)+CO2(g)2CO(g)+2H2(g)的△H= kJ•ml-1。
(2)在容积不变的绝热密闭容器中发生反应i,下列能说明反应达到平衡状态的是 (填标号)。
A.气体混合物的密度不再变化
B.CH4消耗速率和H2的生成速率相等
C.CO的浓度保持不变
D.气体平均相对分子质量不再变化
E.体系的温度不再发生变化
(3)恒定压强为P0MPa时,将n(CH4):n(H2O)=1:3的混合气体投入反应器中发生反应i和ii,平衡时,各组分的物质的量分数与温度的关系如图所示。
①图中表示CO2的物质的量分数与温度的变化曲线是 (填字母)。
②结合图中数据,其他条件不变,若要H2的产量最大,最适宜的反应温度是 (填标号)。
A.550~600℃ B.650~700℃ C.750~800℃
在其他条件不变的情况下,向体系中加入CaO可明显提高平衡体系中H2的含量,原因是 。
③600℃时,反应ii的平衡常数的计算式为Kp= (Kp是以分压表示的平衡常数,分压=总压×物质的量分数)。
Ⅱ.电解法制氢气。某科研小组设计如图所示电解池,利用CO2和H2O在碱性电解液中制备水煤气(H2、CO),产物中H2和CO的物质的量之比为1∶1。
(4)电极B是 极,生成水煤气的电极反应式为 。
4.催化重整对温室气体的减排具有重要意义,其反应为:。回答下列问题:
(1)已知相关物质的燃烧热(
):
则催化重整反应的 。
(2)将原料按初始组成
充入密闭容器中,保持体系压强为
发生反应。达到平衡时,
体积分数与温度的关系如图所示。
①下,n(平衡时气体):n(初始气体)= 。该温度下,此反应的平衡常数 (以分压表示,分压=总压强×气体成分的物质的量分数。保留1位小数)。
②若A、B、C三点表示不同温度和压强下达到平衡时的体积分数,则 点对应的平衡常数最小,理由是 。
(3)其他条件相同,在不同催化剂(A、B)作用下,反应
进行相同时间后,
的产率随反应温度的变化如图所示。
①在催化剂A、B作用下,它们正、逆反应活化能差值分别用表示,则 (填“>”“T2;
③当=1、T3时,因曲线I是表示当=1时,NO的平衡转化率~的图像,由曲线I可看出在T3时NO平衡转化率为80%,
CH4的平衡分压为100kPakPa,该温度下Kθ=;
(4)B装置电解饱和食盐水生成氢气、氯气、氢氧化钠,总反应离子方程式为2H2O+2Cl-H2↑+2OH-+Cl2↑。
2.(1) < 优点是升高温度,反应速率较快;缺点是正反应为放热反应,升高温度,平衡逆向移动,产物的转化率较低
(2) Pd膜能选择性分离出,平衡正向移动,平衡转化率增大 BD
(3) 温度 100
(4)AC
(5)bc
【详解】(1)①根据表中的数据,温度越高,平衡常数越小,反应的ΔH<0。故答案为:<;
②反应常在较高温度下进行,该措施的优点是升高温度,反应速率较快;缺点是正反应为放热反应,升高温度,平衡逆向移动,产物的转化率较低。故答案为:优点是升高温度,反应速率较快;缺点是正反应为放热反应,升高温度,平衡逆向移动,产物的转化率较低;
(2)①利用平衡移动原理解释反应器存在Pd膜时具有更高转化率的原因是Pd膜能选择性分离出,平衡正向移动,平衡转化率增大。故答案为:Pd膜能选择性分离出,平衡正向移动,平衡转化率增大;
②A.Pd膜只允许氢气通过,不允许二氧化碳通过,对气体分子的透过具有选择性,A项正确;B.过程正反应的活化能远小于逆反应的活化能,ΔH<0,B项错误;C.加快Pd膜内H原子迁移,平衡正向移动,有利于氢气的解离,C项正确;D.为放热过程,H原子在Pd膜表面上结合为氢气的过程为吸热过程,D项错误;答案选BD;
(3)该反应是气体体积减小的反应,增大压强,平衡正向移动,平衡时H2的转化率随压强增大而增大,说明Y代表压强,且Y1>Y2,X代表温度,故图 2 中 X 代表温度;若图2中M 点对应的容器体积为5 L,化学平衡常数只与温度有关,由于M、N两点对应的温度相同,则N、M点的平衡常数K相同,M点氢气转化率为50%,则反应氢气0.5 ml;
则N点的压强平衡常数。故答案为:温度;100;
(4)X代表温度,平衡时H2的转化率随温度升高而降低,说明升高温度,平衡逆向移动,则该反应是放热反应,ΔH<0,随着温度升高,平衡逆向移动,K值减小,pK=−lgK,则pK随着K值的减小而增大,图3中曲线AC能正确表示该反应平衡常数的负对数pK(pK=−lgK )与X的关系,故答案为:AC;
(5)a.反应达到平衡时,甲醇的浓度将会保持不变,图中t1时刻之后,甲醇的浓度仍在减小,则t1时刻反应未达到平衡状态,故a错误;b.总的物质质量不变,随着反应进行,二氧化碳含量减小,其质量分数减小,t1时刻二氧化碳含量不再改变,反应达到平衡,符合题意;c.随着反应进行,二氧化碳量减小、甲醇量增大,甲醇与二氧化碳比值增大,t1时刻比值不再改变,反应达到平衡,符合题意;d.随着反应进行,二氧化碳量减小、甲醇量增大,t1时刻之后两者的量仍然变化,则没有达到平衡,不符合题意;故答案为:bc。
3.(1)+247.4
(2)CDE
(3) n B CaO为碱性氧化物,能吸收酸性氧化物CO2,导致CO2浓度减小,促使反应ii平衡正向移动,导致CO浓度减小,引起反应i平衡也正向移动
(4) 阳 CO2+3H2O+4e-=H2+CO+4OH-
【详解】(1)由题干信息已知,反应i.CH4(g)+H2O(g)CO(g)+3H2(g) H=+206.2kJ•ml-1,反应ii.CO(g)+H2O(g)CO2(g)+H2(g) H=-41.2kJ•ml-1,反应i-反应ii可得反应CH4(g)+CO2(g) 2CO(g)+2H2(g),根据盖斯定律可知,H=(+206.2kJ/ml)-(-41.2kJ/ml)=+247.4kJ•ml-1,故答案为:+247.4;
(2)A.由题干信息可知,反应i反应体系均为气体,则反应过程中气体质量不变,容器体积不变,则气体混合物的密度始终不变,则气体混合物的密度不再变化,不能说明反应达到化学平衡,A不合题意;
B.CH4消耗速率和H2的生成速率均表示正反应速率,且二者系数不相等,故CH4消耗速率和H2的生成速率相等,不能说明反应达到化学平衡,B不合题意;
C.化学平衡的特征之一为各组分的浓度保持不变,故CO的浓度保持不变,说明反应达到化学平衡,C符合题意;
D.由题干信息可知,反应i前后气体的物质的量发生改变,气体质量不变,则气体平均相对分子质量一直在改变,故气体平均相对分子质量不再变化,说明反应达到化学平衡,D符合题意;
E.由于反应容器是一个绝热密闭容器,故体系的温度不再发生变化,说明反应达到化学平衡,E符合题意;
故答案为:CDE;
(3)①随反应进行,二氧化碳和氢气的量增加,故甲烷和水蒸气的量减小,将n(CH4):n(H2O)=1:3的混合气体投入反应器中,故p为表示平衡时水蒸气的物质的量分数随温度的变化,随着温度升高反应i正向移动,反应ii逆向移动,故CO随温度升高而增大,即m表示平衡时CO的物质的量分数随温度的变化,则n表示CO2的物质的量分数随温度的变化,故答案为:n;
②结合图中数据,其他条件不变,当温度达到650℃时,CH4的转化率几乎为100%,H2的物质的量分数达到最大,再升高温度,H2的物质的量分数不再增大,CH4的转化率也增大不大,且增大能源投入,故若要H2的产量最大,最适宜的反应温度是650~700℃,CaO为碱性氧化物,能吸收酸性氧化物CO2,导致CO2浓度减小,促使反应ii平衡正向移动,导致CO浓度减小,引起反应i平衡也正向移动,故在其他条件不变的情况下,向体系中加入CaO可明显提高平衡体系中H2的含量,原因是故答案为:B;CaO为碱性氧化物,能吸收酸性氧化物CO2,导致CO2浓度减小,促使反应ii平衡正向移动,导致CO浓度减小,引起反应i平衡也正向移动;
③由题干图像信息可知,600℃平衡时,H2的物质的量分数为:50%,H2O(g)的物质的量分数为32%,CH4的物质的量分数为4%,设投入CH4为1ml、H2O为3ml,根据三段式分析:,,则有,解得x=0.78ml,,解得y=0.45ml,CO物质的量分数为:×100%=6%,CO2的物质的量分数为×100%=8%,600℃时,反应ii的平衡常数的计算式为Kp===,故答案为:;
(4)由题干电解池装置图可知,电解B产生氧气,电解反应为:4OH- -4e-=O2↑+2H2O,发生氧化反应,故电极B是阳极,则A电极为阴极,发生还原反应,生成水煤气即CO和H2,该电极的电极反应式为CO2+3H2O+4e-=H2+CO+4OH-,故答案为:阳;CO2+3H2O+4e-=H2+CO+4OH-。
4.(1)
(2) 177.8 A 该反应是吸热反应,升高温度,平衡正向移动,平衡常数增大;A、B、C三点中,A点温度最低
(3) =
相关试卷
这是一份高考化学热点试题热点25物质结构与性质综合题含解析答案,共12页。
这是一份高考化学热点试题热点24有机合成与推断综合题含解析答案,共19页。
这是一份高考化学热点试题热点23化学工艺流程综合题含解析答案,共12页。试卷主要包含了层状结构薄膜能用于制作电极材料,氮化镓具有优异的光电性能等内容,欢迎下载使用。









