



安徽省2024届“耀正优”高三上学期名校12月期末联考化学试卷(Word版附解析)
展开这是一份安徽省2024届“耀正优”高三上学期名校12月期末联考化学试卷(Word版附解析),文件包含安徽省2024届“耀正优+”高三上学期名校12月期末化学试题Word版含解析docx、安徽省2024届“耀正优+”高三上学期名校12月期末化学试题Word版无答案docx等2份试卷配套教学资源,其中试卷共28页, 欢迎下载使用。
考生注意:
1.本试卷满分100分,考试时间75分钟。
2.答题前,考生务必用直径0.5毫米黑色墨水签字笔将密封线内项目填写清楚。
3.考生作答时,请将答案答在答题卡上。选择题每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑;非选择题请用直径0.5毫米黑色墨水签字笔在答题卡上各题的答题区域内作答,超出答题区域书写的答案无效,在试题卷、草稿纸上作答无效。
4.本卷命题范围:必修二、必修二、选择性必修一、选择性必修三、
5.可能用到的相对原子质量:
一、选择题(本题共14小题,每小题3分,共42分。在每小题给出的四个选项中只有一项是符合题目要求的)
1. 化学与生活息息相关,下列说法错误的是
A. 烟花绚丽多彩,与电子跃迁有关
B. 用过氧乙酸消毒,利用了该物质的酸性
C. 用植物油和烧碱制作肥皂,植物油发生了水解反应
D. 全氟烷基物质难以降解,是因为其中的C—F键的键能很大
2. 下列化学用语或表述正确的是
A. HClO的结构式:H—O—ClB. C2H4分子的球棍模型:
C. H2O2中的共价键类型:极性键D. NH3的VSEPR模型名称:三角锥形
3. 下列离子方程式正确的是
A. 用FeS除去污水中的
B. 用澄清石灰水检验CO2:
C. 向Na2S2O3溶液中加入稀硝酸:
D. K4[Fe(CN)6]溶液滴入FeCl2溶液中:
4. 已知反应设NA是阿伏加德罗常数的值,下列说法正确的是
A. 22.4LCO2所含π键的数目为NA
B. 每形成1mlH—O键,转移电子数目为NA
C. 晶体中所含离子的数目为0.3NA
D. 1L0.1ml/LCH3COOK溶液中含CH3COO⁻的数目为0.1NA
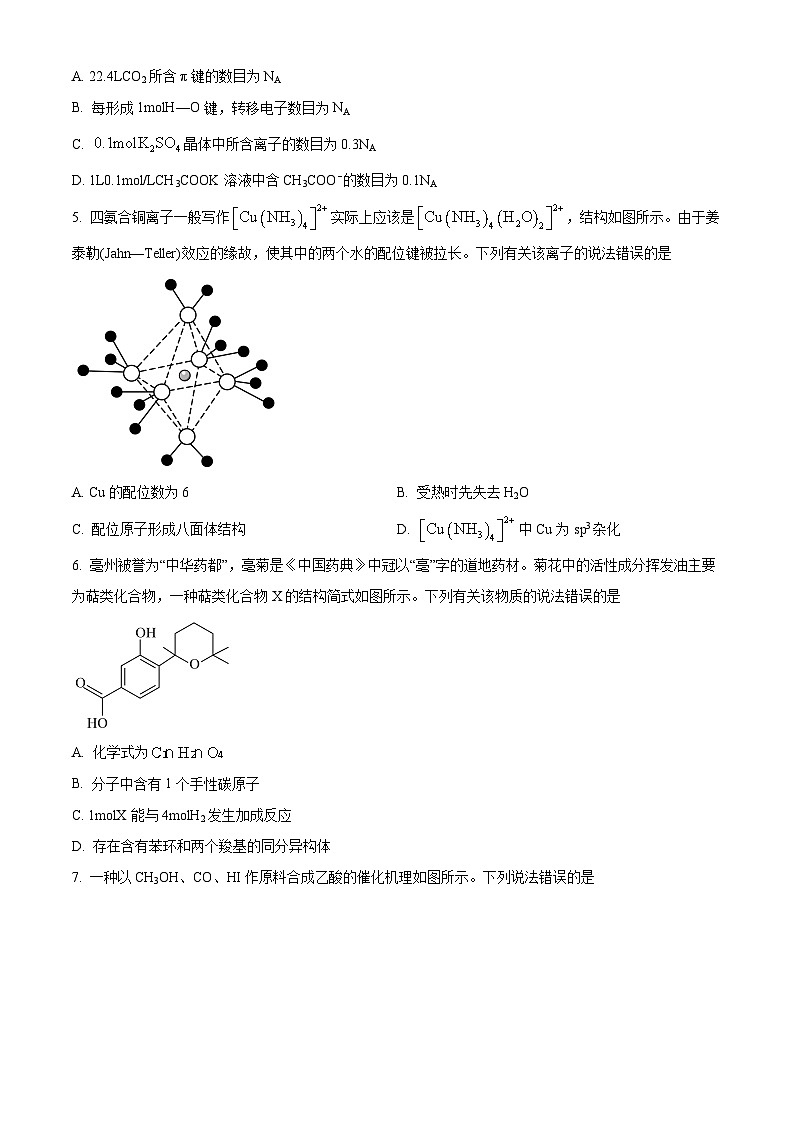
5. 四氨合铜离子一般写作实际上应该是,结构如图所示。由于姜泰勒(Jahn—Teller)效应的缘故,使其中的两个水的配位键被拉长。下列有关该离子的说法错误的是
A. Cu的配位数为6B. 受热时先失去H2O
C. 配位原子形成八面体结构D. 中Cu为sp3杂化
6. 亳州被誉为“中华药都”,亳菊是《中国药典》中冠以“亳”字的道地药材。菊花中的活性成分挥发油主要为萜类化合物,一种萜类化合物X的结构简式如图所示。下列有关该物质的说法错误的是
A. 化学式为
B. 分子中含有1个手性碳原子
C. 1mlX能与4mlH2发生加成反应
D. 存在含有苯环和两个羧基的同分异构体
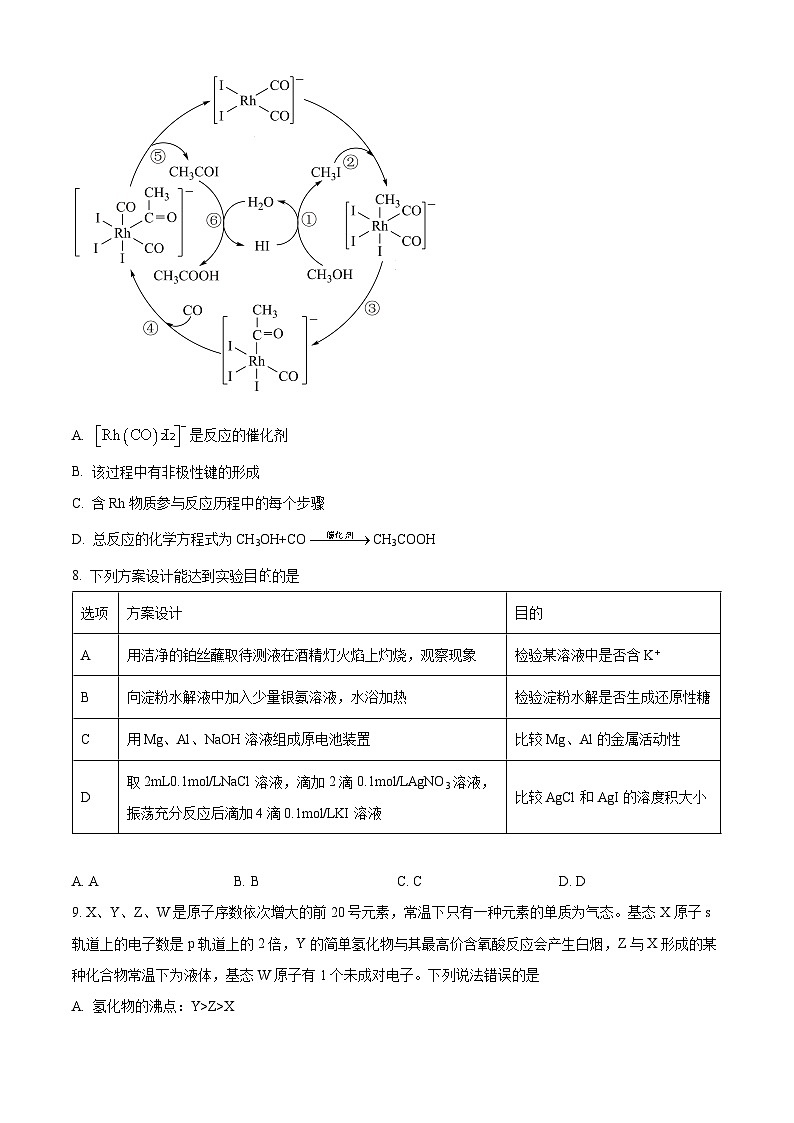
7. 一种以CH3OH、CO、HI作原料合成乙酸的催化机理如图所示。下列说法错误的是
A. 是反应的催化剂
B. 该过程中有非极性键的形成
C. 含Rh物质参与反应历程中的每个步骤
D. 总反应的化学方程式为CH3OH+COCH3COOH
8. 下列方案设计能达到实验目的是
A. AB. BC. CD. D
9. X、Y、Z、W是原子序数依次增大的前20号元素,常温下只有一种元素的单质为气态。基态X原子s轨道上的电子数是p轨道上的2倍,Y的简单氢化物与其最高价含氧酸反应会产生白烟,Z与X形成的某种化合物常温下为液体,基态W原子有1个未成对电子。下列说法错误的是
A. 氢化物的沸点:Y>Z>X
B. 电负性:Y>Z>X>W
C. 原子半径:W>Z>X>Y
D. 上述元素形成的某种化合物的溶液可用于检测Fe3+
10. SO2和NO2是主要大气污染物,利用如图装置可同时吸收SO2和NO。已知电解池的阴极室中溶液的pH保持在4~7之间。下列说法正确的是
A. 电极a为直流电源的正极
B. 电解过程中,阳极区电解液的pH增大
C. 阴极反应式为
D. 吸收NO的离子方程式为2NO+
11. 氮化镓是新型半导体材料,其晶胞如图所示,A原子坐标,晶胞参数为cnm,阿伏加德罗常数的值为NA。下列说法正确的是
A. 晶体最简化学式为Ga2N7
B. B原子坐标为34,34,34
C. N形成的正四面体空隙中Ga的填充率为100%
D. 该氮化镓晶体的密度为
12. 铜产业是铜陵最有特色和最具发展潜力的产业。用黄铜矿(冶炼铜的一种工艺流程如图所示:
已知:i..“浸取”时反应的化学方程式为
ii.“调节pH”时[CuCl₂]-发生歧化反应。
下列说法错误的是
A. CuCl中Cu的价电子排布式为3d10
B. “除硫”时可用稀盐酸代替浓盐酸以降低生产成本
C. “调节pH”时主要反应的离子方程式为:
D. “滤液2”中含有的离子主要是Cu2+和Cl-,可以返回到流程中循环利用
13. 已知反应: △H<0。在1L恒容密闭容器中充入体积比为1:3的CO2和H2,二者在催化剂、加热条件下反应合成乙烯。不同温度对CO2的平衡转化率及催化剂的催化效率的影响如图所示。下列有关说法错误的是
A. 曲线a表示的是CO2的平衡转化率与温度的关系
B. M点的反应速率可能比N点的反应速率大
C. 增大CO2和H2体积比例,曲线a将下移
D. M点时,若平衡体系的压强为130kPa,则乙烯的分压为20kPa
14. 已知H2R是二元弱酸。298K时,向一定浓度的KHR溶液中滴加盐酸,混合溶液中pX与pH的关系如图所示或下列说法错误的是
A. 直线L₁表示与pH的关系
B. 的数量级为10-4
C. c点溶液中,
D. KHR和K2R的混合溶液可能呈中性
二、非选择题(本题包括4小题,共58分)
15. 某实验小组以BaS溶液为原料制备),并用重量法测定产品中的含量。设计了如下实验方案:
步骤1:的制备
按如图所示装置进行实验,得到BaCl2溶液,经一系列步骤获得产品。
步骤2:产品中的含量测定
①称取产品0.5000g,用100mL水溶解,酸化,加热至近沸;
②在不断搅拌下,向①所得溶液逐滴加入热溶液;
③沉淀完全后,60℃水浴40分钟,经过滤、洗涤、烘干等步骤,称量白色固体,质量为0.4660g。
回答下列问题:
(1)仪器a的名称是___________;若没有仪器b,可能产生的后果是___________。
(2)I是制取HCl气体的装置,主要反应的化学方程式为___________;该反应能发生,原因是___________。
(3)装置Ⅲ用于吸收装置Ⅱ中产生。已知:和的电离常数如表所示:
装置Ⅲ中的试剂能否选用溶液?___________(说明理由)。
(4)在沉淀过程中,某同学在加入一定量热的溶液后,认为沉淀已经完全,判断沉淀已完全的方法是___________。
(5)在过滤操作中,用到的玻璃仪器是___________(填名称)。
(6)产品中的质量分数为___________(保留3位有效数字)。
16. 石棉尾矿主要含有和少量的等物质。利用石棉尾矿生产碳酸镁晶体的一种工艺流程如下:
回答下列问题:
(1)用氧化物的形式表示Mg3(Si2O5)(OH)4:___________。
(2)为提高“水浸”速率,可采取的措施有_____________________(写出2条)。
(3)“焙烧”时会产生SO3,SO3是___________分子(填“极性”或“非极性”);“水浸”后过滤所得“浸渣”的主要成分是SiO2,6gSiO2晶体中所含共价键的物质的量为___________ml。
(4)“调节pH除杂”时,物质X可以___________(写出1种)。
(5)“沉镁”时的离子方程式为___________;“沉镁”时需将温度控制在50℃左右,温度不能过高也不能过低的原因是___________。
(6)“沉镁”后的“母液”主要成分是(可回收利用,但还含有一定浓度的为除去母液中的可在母液中加入氨水调节溶液pH。已知若时,可认为已完全除去,则加入氨水调节溶液pH的最低值为___________。
17. 氢能将在实现“双碳”目标中起到重要作用。乙醇—水催化重整可获得氢气。主要发生以下反应:
反应①:
反应②:2
回答下列问题:
(1)反应①自发进行的条件是 。
A. 高温B. 低温C. 高压D. 低压
(2)已知有关键能数据如下表:
反应②中△H2=__________________kJ∙ml-1反应的△H3=__________________kJ∙ml-1。
(3)为提高氢气的平衡产率,可采取的措施为___________(写出2条)。
(4)向体积为VL的恒容密闭容器中充入1mlC2H5OH(g)和发生上述反应①②。初始时体系压强为100kPa,平衡时CO2和CO的选择性、H2的产率随温度的变化曲线如图所示。(CO的选择性
①表示CO2的选择性的是曲线___________。
②400℃以后,H2的产率随温度变化的原因是___________。
③反应①的标准平衡常数其中p0为标准压强100kPa),p(X)为气体X的平衡分压,分压=总压×该气体的物质的量分数。500℃时,测得的转化率为80%,则反应①的=_____________(保留1位小数)。
18. 是食盐中添加的抗结剂,高温下会分解生成(CN)2、KCN、C等物质。
(1)C、N、O、K元素的第一电离能由大到小的顺序为___________。
(2)Fe2+的价电子排布图为___________,Fe2+在水中形成,该离子中H-O-H的键角___________(填“>”“=”或“<”)单个水分子中的。
(3)(CN)2与水反应生成HCN、HOCN,HCN分子的立体构型是___________,HCN的酸性远弱于H2CO3,原因是___________,HOCN分子中σ键与π键数目之比为___________。
(4)铁、钾的单质均是电热的良导体,其根本原因是___________。
(5)墨晶体中存在___________及类似金属键的作用力,因此它属于混合型晶体
(6)钾晶体中原子的堆积方式如图所示。
钾晶体中原子的空间利用率为___________×100%(用含π的式子表示)。选项
方案设计
目的
A
用洁净的铂丝蘸取待测液在酒精灯火焰上灼烧,观察现象
检验某溶液中是否含K+
B
向淀粉水解液中加入少量银氨溶液,水浴加热
检验淀粉水解是否生成还原性糖
C
用Mg、Al、NaOH溶液组成原电池装置
比较Mg、Al的金属活动性
D
取2mL0.1ml/LNaCl溶液,滴加2滴0.1ml/LAgNO3溶液,振荡充分反应后滴加4滴0.1ml/LKI溶液
比较AgCl和AgI的溶度积大小
物质
H2S
H2CO3
电离常数
Ka1=1.3×10⁻⁷
Ka2=7.1×10⁻¹⁵
Ka1=4.2×10-7
Ka2=5.6×10-11
化学键
H−H
H−O
C=O
C≡O
键能/kJ·ml⁻¹
436
464
803
1071
相关试卷
这是一份2024届安徽省“耀正优+”高三名校期末上学期化学试题,共6页。
这是一份安徽省耀正优2023-2024学年高三上学期期末测试化学(6),共8页。
这是一份安徽省2024届“耀正优+”高三上学期名校12月期末化学试题,共13页。












