

所属成套资源:新高考化学二轮复习题型归纳与变式演练题型 (2份打包,原卷版+解析版)
新高考化学二轮复习题型归纳与变式演练题型12 化学平衡图表分析(2份打包,原卷版+解析版)
展开这是一份新高考化学二轮复习题型归纳与变式演练题型12 化学平衡图表分析(2份打包,原卷版+解析版),文件包含新高考化学二轮复习题型归纳与变式演练题型12化学平衡图表分析原卷版docx、新高考化学二轮复习题型归纳与变式演练题型12化学平衡图表分析解析版docx等2份试卷配套教学资源,其中试卷共79页, 欢迎下载使用。
TOC \ "1-2" \h \u \l "_Tc9074" PAGEREF _Tc9074 \h 1
\l "_Tc28067" 【考向一】“接续”图像分析 PAGEREF _Tc28067 \h 1
\l "_Tc31825" 【考向二】“断点”图像分析 PAGEREF _Tc31825 \h 3
\l "_Tc14903" 【考向三】“拐点”图像分析 PAGEREF _Tc14903 \h 5
\l "_Tc28074" 【考向四】“残缺”图像分析 PAGEREF _Tc28074 \h 7
\l "_Tc19213" 【考向五】平滑曲线图像分析 PAGEREF _Tc19213 \h 9
\l "_Tc19996" 【考向六】变量控制图像分析 PAGEREF _Tc19996 \h 11
\l "_Tc11261" 【考向七】转化率—投料比—温度图像分析 PAGEREF _Tc11261 \h 14
\l "_Tc29475" 【考向八】新型陌生图像分析 PAGEREF _Tc29475 \h 17
\l "_Tc31107" PAGEREF _Tc31107 \h 20
【考向一】“接续”图像分析
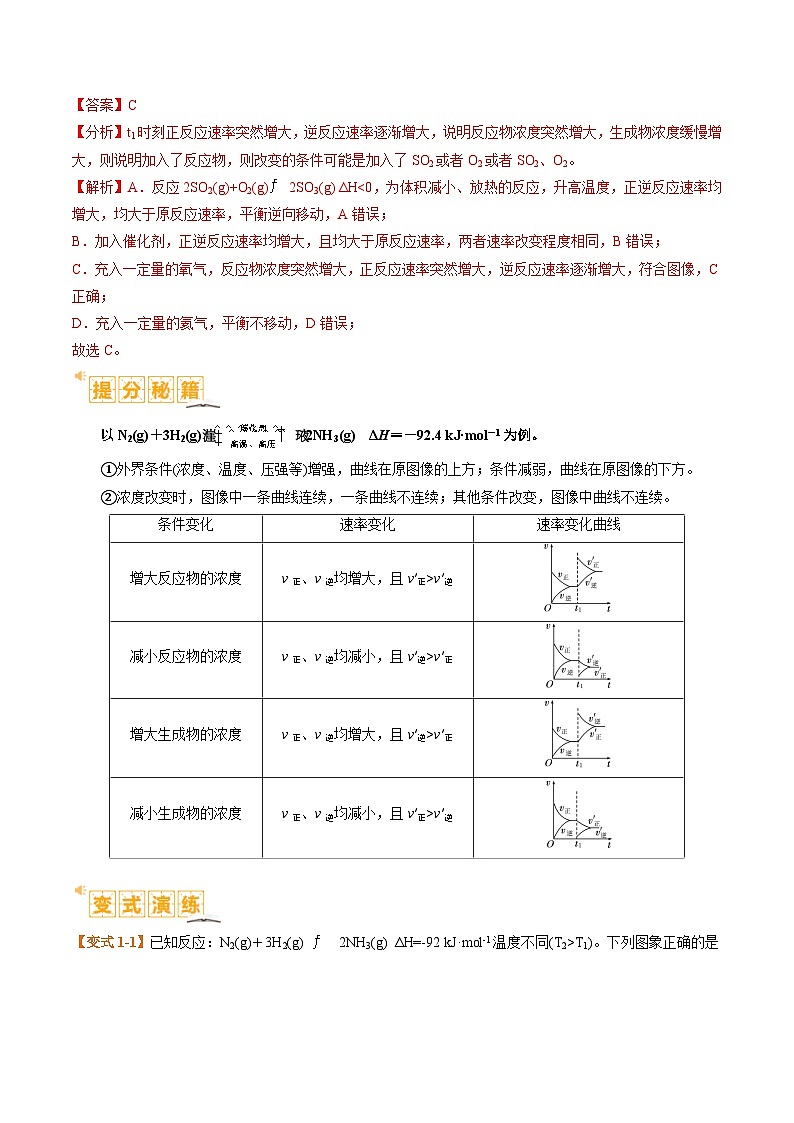
【典例1】在恒容密闭容器中发生反应:2SO2(g)+O2(g)2SO3(g) ΔH<0,其速率-时间图像如下,则t1时刻改变的条件可能是
A.升高温度B.加入催化剂
C.充入一定量的氧气D.充入一定量的氦气
以N2(g)+3H2(g)2NH3(g) ΔH=-92.4 kJ·ml-1为例。
①外界条件(浓度、温度、压强等)增强,曲线在原图像的上方;条件减弱,曲线在原图像的下方。
②浓度改变时,图像中一条曲线连续,一条曲线不连续;其他条件改变,图像中曲线不连续。
【变式1-1】已知反应:N2(g)+3H2(g) 2NH3(g) ΔH=-92 kJ·ml-1温度不同(T2>T1)。下列图象正确的是
A.AB.BC.CD.D
【变式1-2】(2023上·河北石家庄·高三石家庄精英中学期中)一定温度下,密闭容器中发生反应A(s)+3B(g)⇌C(g)+2D(g) △H<0,下列图示与对应的叙述相符的是
A.t1时,减小C的浓度B.纵坐标表示生成物含量
C.t1时,一定使用了催化剂D.纵坐标表示反应物转化率
【考向二】“断点”图像分析
【典例2】在容积不变的密闭容器中存在: 3H2(g) +3CO(g) =CH3OCH3(g) +CO2(g) ΔH<0,其他条件不变时,改变某一 条件对上述反应速率的影响,下列分析正确的是
A.图I研究的是t0时刻增大H2的物质的量浓度对反应速率的影响
B.图I研究的是t0时刻降低温度对反应速率的影响
C.图II研究的是t0时刻增大压强对反应速率的影响
D.图II研究的是t0时刻使用催化剂对反应速率的影响
以N2(g)+3H2(g)2NH3(g) ΔH=-92.4 kJ·ml-1为例。
①外界条件(浓度、温度、压强等)增强,曲线在原图像的上方;条件减弱,曲线在原图像的下方。
②浓度改变时,图像中一条曲线连续,一条曲线不连续;其他条件改变,图像中曲线不连续。
③若“断点”后的速率增大,且正、逆反应速率增大程度不同,则可能是升高温度或增大压强;若“断点”后的速率减小,且正、逆反应速率减小程度不同,则可能是降低温度或减小压强;再利用平衡移动方向作出具体的判断。
(1)温度对反应速率的影响
(2)压强对反应速率的影响
(3)催化剂对反应速率的影响
(4)对于反应前后气体的化学计量数之和相等的反应,改变压强时,v正、v逆同等倍数增大或减小,速率变化曲线如图:
(5)变化趋势不同的“突变点”可能是容器体积和物质的量共同变化引起的
【变式2-1】可逆反应在一定条件下达到平衡状态。在t1时刻改变某一条件,化学反应速率与反应时间的关系如图所示。下列说法正确的是
A.维持温度、反应体系容积不变,t1时充入SO3(g)
B.维持温度、压强不变,t1时充入SO3(g)
C.维持体积不变,t1时升高反应体系温度
D.维持温度、容积不变,t1时充入一定量Ar
【变式2-2】在容积不变的密闭容器中,发生可逆反应A(g)+2B(g)3C(g)+D(s)ΔH<0,当其他条件不变时改变某一条件,对此反应的影响可用如图像表示。下列说法错误的是
A.图Ⅰ表示t1时刻升高温度对反应速率的影响
B.图Ⅰ不能表示t1时刻增大C物质的浓度对反应速率的影响
C.图Ⅱ一定表示的是在t1时刻使用了催化剂对反应速率的影响
D.图Ⅲ乙的温度比甲的温度高
【考向三】“拐点”图像分析
【典例3】在一密闭容器中有如下反应:aX(g)+bY(g)nW(g);ΔH,某化学兴趣小组的同学根据此反应在不同条件下的实验数据,作出了如下曲线图:
其中,ω(W)表示W在反应混合物中的体积分数,t表示反应时间。当其它条件不变时,下列分析正确的是
A.图Ⅰ可能是不同压强对反应的影响,且p2>p1,a+b<n
B.图Ⅱ可能是不同压强对反应的影响,且p1>p2,n<a+b
C.图Ⅱ可能是在同温同压下催化剂对反应的影响,且2使用的催化剂效果好
D.图Ⅲ可能是不同温度对反应的影响,且T1>T2,ΔH<0
已知不同温度或压强下,反应物的转化率α(或百分含量)与时间的关系曲线,推断温度的高低及反应的热效应或压强的大小及气体物质间的化学计量数的关系。[以A(g)+B(g)C(g)中反应物的转化率αA为例说明]
解答这类图像题时应注意以下两点:
(1)“先拐先平,数值大”原则
分析反应由开始(起始物质相同时)达到平衡所用时间的长短可推知反应条件的变化。
①若为温度变化引起,温度较高时,反应达平衡所需时间短。如图甲中T2>T1。
②若为压强变化引起,压强较大时,反应达平衡所需时间短。如图乙中p1>p2。
③若为是否使用催化剂,使用适宜催化剂时,反应达平衡所需时间短。如图丙中a使用催化剂。
(2)正确掌握图像中反应规律的判断方法
①图甲中,T2>T1,升高温度,αA降低,平衡逆向移动,正反应为放热反应。
②图乙中,p1>p2,增大压强,αA升高,平衡正向移动,则正反应为气体体积缩小的反应。
③若纵坐标表示A的百分含量,则甲中正反应为吸热反应,乙中正反应为气体体积增大的反应。
【变式3-1】(2023·全国·高三专题练习)在体积不变的密闭容器中进行反应:。下列各图表示其他条件不变时,改变某一条件对上述反应的影响,其中分析正确的是
A.图A表示t0时刻增大NH3的浓度对反应速率的影响
B.图B中的a曲线表示使用催化剂对反应速率的影响
C.图C表示温度对反应速率的影响,且T1>T2
D.图D中a、b、c三点中只有b点已经达到平衡状态
【变式3-2】(2023上·黑龙江大庆·高三肇州县第二中学校考)图像对应的叙述正确的是
A.图丁:该正向反应在任何温度下都能自发进行
B.图丙:对图中反应升高温度,该反应平衡常数减小
C.图乙:时刻改变的条件只能是加入催化剂
D.图甲:A的平衡转化率为
【考向四】“残缺”图像分析
【典例4】(2023上·新疆乌鲁木齐·高三乌鲁木齐市第九中学校考阶段练习)在一体积可变的恒温密闭容器中发生反应 ,每次达到平衡后仅改变其中一个反应条件,正反应速率随时间的变化如图所示,下列说法错误的是
A.时可能是升高温度B.时可能是扩大容器体积
C.时可能是充入了部分D.时可能是加入了高效催化剂
部分正逆反应速率图像
对于部分正逆反应速率不全的图像分析,要进行补全再分析,这样就能判断出反应进行的方向,并根据条件进行条件改变的判断。
(1)已知:A(g)+2B(g)3C(g) ΔH<0,向一恒温恒容的密闭容器中充入1 ml A和2 ml B发生反应,t1时达到平衡状态I,在t2时改变某一条件,t3时重新达到平衡状态Ⅱ,正反应速率随时间的变化如图所示。
(2)在某一恒温体积可变的密闭容器中发生如下反应: ,时刻达到平衡后,在时刻改变某一条件,其反应过程(Ⅰ、Ⅱ)如图所示。下列说法中不正确的是
【变式4-1】一定温度下,密闭容器中进行反应:2SO2(g)+O2(g)2SO3(g) ΔH<0.测得v正(SO2)随反应时间(t)的变化如图所示。下列有关说法正确的是
A.t2时改变的条件:只加入一定量的SO2
B.t1时平衡常数K1大于t3时平衡常数K3
C.t1时平衡混合气的M1大于t3时平衡混合气的M3
D.t1时平衡混合气中SO3的体积分数等于t3时平衡混合气中SO3的体积分数
【变式4-2】某反应4A(g)mB(g)+2C(g) ΔH<0,正反应速率的变化如图。其中t1、t2、t3、t4只改变一个条件,t2时刻图象变化并非加入催化剂引起,下列叙述中错误的是
A.m=2B.t1时增大了A的浓度
C.t3时减小了压强D.t1至t4时间段内,化学平衡常数的值保持不变
【考向五】平滑曲线图像分析
【典例5】一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量的变化如图所示,下列对该反应的推断不合理的是
A.在0~6s内,C的化学反应速率约为0.067 ml·L-1·s-1
B.6s后,反应停止了
C.该反应的化学方程式为3B+4C⇌6A+2D
D.在0~4s内,v(A)=3v(D)
已知不同温度下的转化率—压强图像或不同压强下的转化率—温度图像,推断反应的热效应或反应前后气体物质间化学计量数的关系。[以反应A(g)+B(g)C(g)中反应物的转化率αA为例说明]
解答这类图像题时应注意以下两点:
(1)“定一议二”原则:可通过分析相同温度下不同压强时反应物A的转化率大小来判断平衡移动的方向,从而确定反应方程式中反应物与产物气体物质间的化学计量数的大小关系。如甲中任取一条温度曲线研究,压强增大,αA增大,平衡正向移动,正反应为气体体积减小的反应,乙中任取横坐标一点作横坐标的垂直线,也能得出相同结论。
(2)通过分析相同压强下不同温度时反应物A的转化率的大小来判断平衡移动的方向,从而确定反应的热效应。如利用上述分析方法,在甲中作横坐标的垂直线,乙中任取一曲线,即能分析出正反应为放热反应。
(3)等温(压)平衡曲线解读
①纵坐标Y可表示物质的量、浓度、转化率以及物质的量分数等含义。
②解题分析时,常需要作辅助线(对横坐标轴作垂线),若横坐标表示温度(或压强),则此辅助线为等温线(或等压线)。
③如图丙所示,在曲线上的每个点(如B点)都达到平衡状态,若纵坐标表示反应物转化率,则有:
A点是非平衡状态,若要达到平衡,需降低转化率,即平衡要向逆反应方向移动,此点v正<v逆;
C点是非平衡状态,若要达到平衡,需增大转化率,即平衡要向正反应方向移动,此点v正>v逆;
处于平衡状态或非平衡状态的各点的反应速率,其大小主要由温度决定,故有vC>vB>vA。
【变式5-1】(2023上·河北·高三石家庄一中校联考期中)工业上用CO生产甲醇的反应为。图1表示反应中能量的变化;图2表示一定温度下,在体积固定为2L的密闭容器中加入4mlH2和一定量的CO(g)后,CO(g)和CH3OH(g)的浓度随时间的变化;图3表示不同压强P1、P2下平衡时甲醇百分含量随温度变化的情况。下列叙述不正确的
A.此反应在低温时自发进行,图1中曲线b表示使用催化剂的能量变化
B.若CO、H2、CH3OH(g)的燃烧热△H分别为akJ·ml-1、bkJ·ml-1、ckJ·ml-1,则
C.由图2知,其他条件不变,再充入1mlCO和2mlH2,反应达到新平衡时
D.P1
A.A、C两点气体的平均相对分子质量:A>C
B.A、C两点气体的颜色:A浅,C深
C.由状态B到状态A,可以用加催化剂的方法
D.A、C两点的反应速率:A>C
【考向六】变量控制图像分析
【典例6】反应 在某一时间段内的反应速率与反应时间的关系曲线如图,其中SO3的百分含量最高的一段时间是
A.B.C.D.
1.解化学图像题的“三步骤”
2.解化学平衡图像题的“五项注意”
(1)注意曲线上的特殊点,如与坐标轴的交点、多条曲线的交点、拐点、极值点等。
(2)注意曲线坡度的“平”与“陡”,并弄清其意义。
(3)注意弄清高温、高压时反应速率快,有利于先达到平衡,即“先拐先平”。也就是说其他条件不变时,较高温度或较大压强时达到平衡所用的时间短。
(4)注意运用图像中浓度(或物质的量)的变化来确定反应中化学计量数的关系,即化学计量数之比等于同一时间内各反应物、生成物的浓度(或物质的量)变化量之比。
(5)对时间—速率图像,注意分清曲线的连续性、跳跃性,是“渐变”还是“突变”,是“大变”还是“小变”,是“变大”还是“变小”,变化后是否仍然相等等情况,才可确定对应改变的条件是什么及如何改变。
如:某密闭容器中发生如下反应: 。如图表示该反应的速率()随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是
【变式6-1】某密闭容器中充入等物质的量的A和B,一定温度下发生反应A(g)+xB(g)2C(g),达到平衡后,在不同的时间段,分别改变影响反应的一个条件,测得容器中物质的浓度、反应速率分别随时间的变化如图所示:
下列说法中不正确的是
A.30~40 min 内该反应使用了催化剂
B.化学方程式中的x=1,正反应为放热反应
C.30 min时减小压强,40 min时升高温度
D.8 min前A的平均反应速率为0.08 ml·L-1·min-1
【变式6-2】(2024上·辽宁锦州·高三统考期末)工业上生产CO的反应原理为 。一定条件下,将足量焦炭和一定量放入体积为2L的恒容密闭容器中发生反应,和CO的物质的量n随时间t的变化关系如图。下列说法正确的是
A.0~2min,;2~3min,
B.当容器内的气体密度()不变时,反应一定达到平衡状态,且
C.3min时温度由升高到,则,平衡常数
D.5min时再充入一定量的CO,a、d曲线分别表示、的变化
【考向七】转化率—投料比—温度图像分析
【典例7】(2023上·江苏泰州·高三姜堰中学校考期中)重整反应能够有效去除大气中的,是实现“碳中和”的重要途径之一,发生的反应如下:
重整反应:
积炭反应I:
积炭反应Ⅱ:
在恒压、起始投料比条件下,体系中含碳组分平衡时的物质的量随温度变化关系曲线如图所示。下列说法正确的是
A.曲线B表示平衡时物质的量随温度的变化
B.减小起始投料比,有利于去除
C.积炭会导致催化剂失活,降低的平衡转化率
D.高于600℃时,升高温度有利于减少积炭的量并去除气体
1.转化率—投料比—温度图像
新型图像往往根据实际工业生产,结合图像,分析投料比、转化率、产率的变化。此类题目信息量较大,能充分考查学生读图、提取信息、解决问题的能力,在新课标高考中受到命题者的青睐。
2.投料比对转化率和百分含量的影响
(1)反应物转化率相等的唯一条件:投料比=化学计量数比
(2)生成物含量最大的条件:投料比=化学计量数比
(3)催化剂的组成不变:投料比=化学计量数比
3.图像分析:
(1)如:一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g)CO(g)+3H2(g)。设起始eq \f(nH2O,nCH4)=Z,在恒压下,平衡时CH4的体积分数φ(CH4)与Z和T(温度)的关系如图所示 。
(2)如:以mA(g)+nB(g)pC(g)+qD(g)为例
随着增大,若保持B的量不变,增加A的量,平衡正向移动,C的量增多。
A.开始阶段,C量的增加值比总量的增加值大,所以C的含量增加。
B.b点=,C的含量最大
C.后来阶段,C量的增加值比总量的增加值小,所以C的含量降低。
②反应物转化率间的关系
A.a、b、c三点A的转化率:a>b>c
B.a、b、c三点B的转化率:c>b>a
【变式7-1】(2023上·江苏南通·高三江苏省如皋中学校考)二氧化碳加氢制甲烷过程中的主要反应为
CO2(g)+4H2(g)=CH4(g)+2H2O(g) ΔH=-164.7kJ·ml-1
CO2(g)+H2(g)=CO(g)+H2O(g) ΔH=41.2kJ·ml-1
在密闭容器中,1.01×105Pa,n起始(CO2):n起始(H2)=1:4时,CO2平衡转化率、在催化剂作用下反应相同时间所测得的CO2实际转化率随温度的变化如图所示。
CH4的选择性可表示为×100%。
下列说法正确的是
A.反应2CO(g)+2H2(g)=CO2(g)+CH4(g)的焓变ΔH=-205.9kJ·ml-1
B.CH4的平衡选择性随着温度的升高而减少
C.用该催化剂催化二氧化碳反应的最佳温度范围约为480~530℃
D.450℃时,提高的值或增大压强,均能使CO₂平衡转化率达到X点的值
【变式7-2】(2023上·贵州贵阳·高三统考)已知气相直接水合法可以制取乙醇: 。在的条件下投料,乙烯的平衡转化率与温度(T)及压强(p)的关系如图所示。
下列有关说法错误的是
A.
B.
C.在、280℃条件下,C点的
D.A点对应条件下反应的平衡常数(用平衡分压代替浓度,分压=总压×物质的量分数)
【考向八】新型陌生图像分析
【典例8】(2024上·江苏南通·高三校联考)二氧化碳的资源化利用对实现“双碳”有着重要意义。二氧化碳加氢制甲烷过程中的主要反应为
在密闭容器中,、时,平衡转化率、在催化剂作用下反应相同时间所测得的实际转化率随温度的变化如题图所示。的选择性可表示为。下列说法正确的是
A.反应
B.的选择性一定随着温度的升高而增加
C.用该催化剂催化二氧化碳反应的最佳温度约为的原因是此温度下的平衡转化率接近100%
D.时,提高的值或增大压强,均能使平衡转化率达到X点的值
1.图像表格信息试题分析
图像表格类试题是以图像、图形和表格为试题的信息来源,以化学中的基本概念、基本理论、元素化合物和化学实验等知识为载体,精心设计问题的一种信息处理和分析题。主要考查学生实验设计能力,数据读取、分析与处理能力,图像的识别与分析能力。通过对图像、表格类试题信息的规范审读,进一步提高学生获取信息的能力。
2.图表信息试题的解题策略
(1)应用分析归纳的方法,得出表格数据中蕴含的具有本质性的规律。
(2)应用观察方法,准确理解图示中纵横轴代表的含义,并能结合化学知识分析判断曲线的走向趋势及起点、拐点、水平线的含义。
(3)注意信息的情境化,理解所给信息的作用。注意信息与基础知识间的联系。
3.选择竞争型图像分析
现代化工生产过程中,因为存在着多个副反应,所以要提高目标产品的产率,就要选择适当的催化剂提高目标产品的选择性,使反应物尽可能多地转化成目标产品。所以,在多重平衡的反应中,要降低副产品的选择性。
(竞争、连续)反应图像的解题思维流程
第一步:审反应方程式:
①找准竞争(或连续)反应在反应特点方面的异同
分清主、副反应
第二步:提取研究状态(平衡、非平衡):
①非平衡状态量,其变化与反应速率有关
②平衡状态量,则与平衡移动有关
第三步:析图:依据图中横坐标、纵坐标的内容找出图中曲线中的“点”“线”的含义和变化趋势并用平衡移动原理解答具体问题
如:CH4与CO2重整生成H2和CO的过程中主要发生下列反应:CH4(g)+CO2(g)2H2(g)+2CO(g) ΔH=247.1 kJ·ml-1 H2(g)+CO2(g)H2O(g)+CO(g) ΔH=41.2 kJ·ml-1。在恒压、反应物起始物质的量比n(CH4)∶n(CO2)=1∶1条件下,CH4和CO2的平衡转化率随温度变化的曲线如图所示。下列有关说法正确的是( )
A.升高温度、增大压强均有利于提高CH4的平衡转化率
B.曲线A表示CH4的平衡转化率随温度的变化
C.相同条件下,改用高效催化剂能使曲线A和曲线B相重叠
D.恒压、800 K、n(CH4)∶n(CO2)=1∶1条件下,反应至CH4转化率达到X点的值,改变除温度外的特定条件继续反应,CH4转化率能达到Y点的值
4.表格信息试题分析
(1)明确表格数据的单位
(2)总结表格数据的变化规律,判断相应的平衡状态。
(3)结合化学平衡常数、化学反应速率、平衡转化率进行相关计算。
(4)不同状态下的数据处理要注意利用对比法综合分析。
如:将一定量的SO2(g)和O2(g)分别通入体积为2 L的恒容密闭容器中,在不同温度下进行反应,得到如下表中的两组数据:
下列说法中不正确的是( )
A.x=2.4
B.T1、T2的关系:T1>T2
C.K1、K2的关系:K2>K1
D.实验1在前6 min的反应速率v(SO2)=0.2 ml·L-1·min-1
【变式8-1】(2023上·江西南昌·高三校联考期中)CO2催化加氢制CH4的反应为:。催化剂上反应过程示意如图1所示。其他条件不变时,10min时CO2的转化率和CH4的选择性(CO2转化为甲烷的量/CO2转化的总量)随温度变化如图2所示。下列说法不正确的是
A.催化剂改变了中O—C—O键的键角
B.150℃到350℃时,基本没有发生副反应
C.催化加氢制是一个吸热反应
D.使用催化剂不能改变反应的△H
【变式8-2】(2023上·江苏徐州·高三统考期中)乙二醇在生产、生活中有着广泛的用途,某工艺制取乙二醇所涉及的反应如下:
反应Ⅰ
反应Ⅱ
在压强一定的条件下,将、按1:3进料比通入装有催化剂的反应器中,测得的转化率与、的选择性[]。
下列说法正确的是
A.曲线a表示转化率
B.195℃时,反应Ⅰ的平衡常数约为2904
C.190~198℃范围内,温度升高,的值减小
D.其它条件相同时,增大压强和升高温度均可以提高平衡时的产量
1.(2023·重庆卷)逆水煤气变换体系中存在以下两个反应:
反应Ⅰ:
反应Ⅱ:
在恒容条件下,按投料比进行反应,平衡时含碳物质体积分数随温度的变化如图所示。下列说法正确的是
A.反应Ⅰ的,反应Ⅱ的
B.点反应Ⅰ的平衡常数
C.点的压强是的3倍
D.若按投料,则曲线之间交点位置不变
2.(2023·浙江卷)一定条件下,苯基丙炔()可与发生催化加成,反应如下:
反应过程中该炔烃及反应产物的占比随时间的变化如图(已知:反应I、Ⅲ为放热反应),下列说法不正确的是
A.反应焓变:反应I>反应Ⅱ
B.反应活化能:反应I<反应Ⅱ
C.增加浓度可增加平衡时产物Ⅱ和产物I的比例
D.选择相对较短的反应时间,及时分离可获得高产率的产物Ⅰ
3.(2023·湖南卷)向一恒容密闭容器中加入和一定量的,发生反应:。的平衡转化率按不同投料比随温度的变化曲线如图所示。下列说法错误的是
A.
B.反应速率:
C.点a、b、c对应的平衡常数:
D.反应温度为,当容器内压强不变时,反应达到平衡状态
4.(2022·江苏卷)乙醇-水催化重整可获得。其主要反应为,,在、时,若仅考虑上述反应,平衡时和CO的选择性及的产率随温度的变化如图所示。
CO的选择性,下列说法正确的是
A.图中曲线①表示平衡时产率随温度的变化
B.升高温度,平衡时CO的选择性增大
C.一定温度下,增大可提高乙醇平衡转化率
D.一定温度下,加入或选用高效催化剂,均能提高平衡时产率
5.(2022·广东卷)恒容密闭容器中,在不同温度下达平衡时,各组分的物质的量(n)如图所示。下列说法正确的是
A.该反应的
B.a为随温度的变化曲线
C.向平衡体系中充入惰性气体,平衡不移动
D.向平衡体系中加入,H2的平衡转化率增大
6.(2021·江苏卷)NH3与O2作用分别生成N2、NO、N2O的反应均为放热反应。工业尾气中的NH3可通过催化氧化为N2除去。将一定比例的NH3、O2和N2的混合气体以一定流速通过装有催化剂的反应管,NH3的转化率、生成N2的选择性[100%]与温度的关系如图所示。
下列说法正确的是
A.其他条件不变,升高温度,NH3的平衡转化率增大
B.其他条件不变,在175~300 ℃范围,随温度的升高,出口处N2和氮氧化物的量均不断增大
C.催化氧化除去尾气中的NH3应选择反应温度高于250 ℃
D.高效除去尾气中的NH3,需研发低温下NH3转化率高和N2选择性高的催化剂
7.(2023·山东卷)一定条件下,化合物E和TFAA合成H的反应路径如下:
已知反应初始E的浓度为0.10ml∙L-1,TFAA的浓度为0.08ml∙L-1,部分物种的浓度随时间的变化关系如图所示,忽略反应过程中的体积变化。下列说法正确的是
A.t1时刻,体系中有E存在
B.t2时刻,体系中无F存在
C.E和TFAA反应生成F的活化能很小
D.反应达平衡后,TFAA的浓度为0.08ml∙L-1
8.(2023·辽宁卷)硫酸工业在国民经济中占有重要地位。
(1)我国古籍记载了硫酸的制备方法——“炼石胆(CuSO4·5H2O)取精华法”。借助现代仪器分析,该制备过程中CuSO4·5H2O分解的TG曲线(热重)及DSC曲线(反映体系热量变化情况,数值已省略)如下图所示。700℃左右有两个吸热峰,则此时分解生成的氧化物有SO2、 和 (填化学式)。
(2)铅室法使用了大容积铅室制备硫酸(76%以下),副产物为亚硝基硫酸,主要反应如下:
NO2+SO2+H2O=NO+H2SO4
2NO+O2=2NO2
(ⅰ)上述过程中NO2的作用为 。
(ⅱ)为了适应化工生产的需求,铅室法最终被接触法所代替,其主要原因是 (答出两点即可)。
(3)接触法制硫酸的关键反应为SO2的催化氧化:
SO2(g)+O2(g)SO3(g) ΔH=-98.9kJ·ml-1
(ⅰ)为寻求固定投料比下不同反应阶段的最佳生产温度,绘制相应转化率(α)下反应速率(数值已略去)与温度的关系如下图所示,下列说法正确的是 。
a.温度越高,反应速率越大
b.α=0.88的曲线代表平衡转化率
c.α越大,反应速率最大值对应温度越低
d.可根据不同下的最大速率,选择最佳生产温度
(ⅱ)为提高钒催化剂的综合性能,我国科学家对其进行了改良。不同催化剂下,温度和转化率关系如下图所示,催化性能最佳的是 (填标号)。
(ⅲ)设O2的平衡分压为p,SO2的平衡转化率为αe,用含p和αe的代数式表示上述催化氧化反应的Kp= (用平衡分压代替平衡浓度计算)。
1.(2023·广东·汕头市澄海中学校联考模拟预测)在相同条件下研究催化剂I、II对反应的影响,各物质浓度c随反应时间t的部分变化曲线如图,则下列说法不正确的是
A.催化剂I、II相比,I使反应活化能更低
B.使用催化剂I,反应时间为时,X的转化率为
C.a曲线表示使用催化剂II时X的浓度随t的变化
D.使用催化剂II时,内,
2.(2023上·新疆喀什·高三校考期中)下列叙述及对应图示正确的是
A.图甲是某温度下c(CH3COOH)+c(CH3COO-)=0.100ml•L-1的醋酸与醋酸钠混合溶液中c(CH3COOH)、c(CH3COO-)与pH的关系曲线,pH=3的溶液中:Ka<10-4.75
B.图乙是恒温密闭容器中发生CaCO3(s)=CaO(s)+CO2(g)反应时,c(CO2)随反应时间变化的曲线,t1时刻改变的条件可能是缩小容器的体积
C.图丙是铁条与盐酸反应的反应速率随反应时间变化的曲线,t1时刻溶液的温度最高
D.图丁是在0.1ml•L-1Na2CO3溶液中加水稀释,随着加水量的增加,溶液中c(HCO)的变化曲线,则Na2CO3的水解程度A点大于B点
3.(2023·浙江·统考二模)工业上用CO生产甲醇的反应为CO(g)+2H2(g)CH3OH(g) △H<0。下列图象不正确的是
A.B.
C.D.
4.根据相应的图像(图像编号与答案一一对应),判断下列相关说法正确的是
A.密闭容器中反应达到平衡,T0时改变某一条件有如图变化所示,则改变的条件一定是加入催化剂
B.反应达到平衡时,外界条件对平衡影响关系如图所示,则正反应为放热反应,且a>b
C.物质的百分含量和温度关系如图所示,则该反应的正反应为放热反应
D.反应速率和反应条件变化关系如图所示,则该反应的正反应为放热反应,A、B、C、D均是气体
5.(2023上·全国·高三校联考期末)乙醇-水催化重整可获得。其主要反应为
在密闭容器中,、起始时,若仅考虑上述反应,平衡时的体积分数随温度的变化如题图所示。下列说法正确的是
A.一定温度下,增大可提高乙醇平衡转化率
B.反应的
C.研发高效催化剂可提高的平衡产率
D.控制反应的最佳温度约为
6.(2024上·重庆·高三重庆南开中学校考)甲醇可通过氢化法合成:。恒定温度为时,将和充入密闭容器中,测得按I变化。下列说法不正确的是
A.时,I中反应进行到B点时释放的热量为
B.时,该反应平衡常数为
C.若其他条件不变,增大起始,所得可能按Ⅱ变化
D.若其他条件不变,缩小容器体积,所得可能按Ⅱ无变化
7.(2023上·内蒙古赤峰·高三赤峰二中校考)常温下,取一定量的PbI2固体配成饱和溶液,t时刻改变某一条件,离子浓度变化如图所示。下列有关说法正确的是
A.常温下,PbI2的Ksp为2×10-6
B.温度不变,向PbI2饱和溶液中加入少量硝酸铅浓溶液,平衡向生产沉淀的方向移动,Pb2+的浓度减小
C.温度不变,t时刻改变的条件可能是向溶液中加入了KI固体,PbI2的Ksp增大
D.常温下,Ksp(PbS)=8×10-28,向PbI2的悬浊液中加入Na2S溶液,反应PbI2(s)+S2-(aq)PbS(s)+2I-(aq)的平衡常数为5×1018
8.已知:A(g)+2B(g) 3C(g) ΔH<0,向一恒温恒容的密闭容器中充入1 ml A和2 ml B发生反应,t1时达到平衡状态I,在t2时改变某一条件,t3时重新达到平衡状态Ⅱ,正反应速率随时间的变化如图所示。下列说法不正确的是
A.t2时改变的条件:向容器中加入CB.平衡时B的体积分数φ:φ(II)=φ(I)
C.t2~t3时反应向正方向移动D.平衡时A(g)的物质的量浓度:c(I)
A.平衡时的浓度:
B.b、c两点的正反应速率:
C.此反应在任意温度下都可自发进行
D.当容器内气体的平均相对分子质量不变时,反应达平衡状态
10.(2023上·内蒙古赤峰·高三赤峰二中校考)下列为化学反应速率和化学平衡图像,其中图像和实验结论正确的是
A.图1对应
B.图2对应 ,M点正反应速率<N点逆反应速率
C.图3对应 ,恒温恒容,按不同投料比充入和进行反应,若平衡时和的转化率相等,则
D.图4对应,A、B、C三点表示不同温度、压强下NO的平衡转化率,压强最小的是B点,化学平衡常数最小的是A点
11.(2023上·江苏盐城·高三校联考)一定条件下合成乙烯:6H2(g)+2CO2(g)CH2=CH2(g)+4H2O(g)。已知温度对CO2的平衡转化率和催化剂催化效率的影响如图所示,下列说法不正确的是
A.生成乙烯的速率:v(M)一定小于v(N)
B.当温度高于250℃,升高温度,平衡向逆反应方向移动,催化剂的催化效率降低
C.平衡常数:KM>KN
D.若投料比n(H2):n(CO2)=3:1,则图中M点乙烯的体积分数为7.7%。
12.(2023上·江苏苏州·高三统考)催化加氢合成甲醇是资源化利用的重要途径。催化加氢主要反应有:
反应Ⅰ
反应Ⅱ
压强分别为、时,将的混合气体置于密闭容器中反应,不同温度下体系中的平衡转化率和、的选择性如图所示。
[(或)的选择性]
下列说法不正确的是
A.曲线①、②表示的选择性,且
B.150℃~250℃,随温度升高甲醇的平衡产率降低
C.一定温度下,调整可提高的平衡转化率
D.相同温度下,反应Ⅰ和反应Ⅱ的平衡常数
13.(2023上·河北石家庄·高三石家庄精英中学期中)已知反应:2NO2(红棕色)N2O4(无色) △H<0,将一定量的NO2充入注射器后封口,如图是在拉伸或压缩注射器的过程中混合气体透光率随时间的变化气体颜色越深,透光率越小),下列说法正确的是
A.b点的操作为拉伸注射器
B.c点与a点相比,c(NO2)增大,c(N2O4)减小
C.d点平衡逆向移动
D.若容器绝热,则平衡常数Ka
A.8min时反应达到平衡状态B.该反应正反应为吸热反应
C.x=1D.30min~40min间使用了催化剂
条件变化
速率变化
速率变化曲线
增大反应物的浓度
v正、v逆均增大,且v′正>v′逆
减小反应物的浓度
v正、v逆均减小,且v′逆>v′正
增大生成物的浓度
v正、v逆均增大,且v′逆>v′正
减小生成物的浓度
v正、v逆均减小,且v′正>v′逆
图象
选项
A
B
C
D
条件变化
速率变化
速率变化曲线
升高温度
v正、v逆均增大,且v′逆>v′正
降低温度
v正、v逆均减小,且v′正>v′逆
条件变化
速率变化
速率变化曲线
增大压强
v正、v逆均增大,且v′正>v′逆
减小压强
v正、v逆均减小,且v′逆>v′正
条件变化
速率变化
速率变化曲线
使用催化剂
v正、v逆
同等倍数增大
图像
条件变化
恒温恒压下,增大反应物的浓度
恒温恒压下,增大生成物的浓度
条件变化
加入催化剂
增大等体反应的压强
实验
编号
温度℃
平衡
常数
起始量/ml
平衡量/ml
达到平衡
所需时间min
SO2
O2
SO2
O2
1
T1
K1
4
2
x
0.8
6
2
T2
K2
4
2
0.4
y
t
相关试卷
这是一份新高考化学二轮复习题型归纳与变式演练题型09 有机物的结构与性质(2份打包,原卷版+解析版),文件包含新高考化学二轮复习题型归纳与变式演练题型09有机物的结构与性质原卷版docx、新高考化学二轮复习题型归纳与变式演练题型09有机物的结构与性质解析版docx等2份试卷配套教学资源,其中试卷共61页, 欢迎下载使用。
这是一份新高考化学二轮复习题型归纳与变式演练题型08 元素周期律推断(2份打包,原卷版+解析版),文件包含新高考化学二轮复习题型归纳与变式演练题型08元素周期律推断原卷版docx、新高考化学二轮复习题型归纳与变式演练题型08元素周期律推断解析版docx等2份试卷配套教学资源,其中试卷共75页, 欢迎下载使用。
这是一份新高考化学二轮复习题型归纳与变式演练题型07 化学实验基础(选择题)(2份打包,原卷版+解析版),文件包含新高考化学二轮复习题型归纳与变式演练题型07化学实验基础选择题原卷版docx、新高考化学二轮复习题型归纳与变式演练题型07化学实验基础选择题解析版docx等2份试卷配套教学资源,其中试卷共77页, 欢迎下载使用。












