

- (黑吉辽通用)新高考化学三轮冲刺强化练习 选择题 元素周期律和元素推断 物质结构和性质(2份打包,原卷版+解析版) 试卷 0 次下载
- (黑吉辽通用)新高考化学三轮冲刺强化练习 选择题 化学与STSE 化学用语 物质的性质与用途(2份打包,原卷版+解析版) 试卷 0 次下载
- (黑吉辽通用)新高考化学三轮冲刺强化练习 选择题 有机化合物的结构和性质 实验基本操作(2份打包,原卷版+解析版) 试卷 0 次下载
- (黑吉辽通用)新高考化学三轮冲刺强化练习 选择题 物质的制备 性质和转化 阿伏加德罗常数(2份打包,原卷版+解析版) 试卷 0 次下载
- (黑吉辽通用)新高考化学三轮冲刺强化练习 非选择题 化学反应原理综合题(2份打包,原卷版+解析版) 试卷 0 次下载
(黑吉辽通用)新高考化学三轮冲刺强化练习 选择题 化学反应与能量 化学反应速率与化学平衡(2份打包,原卷版+解析版)
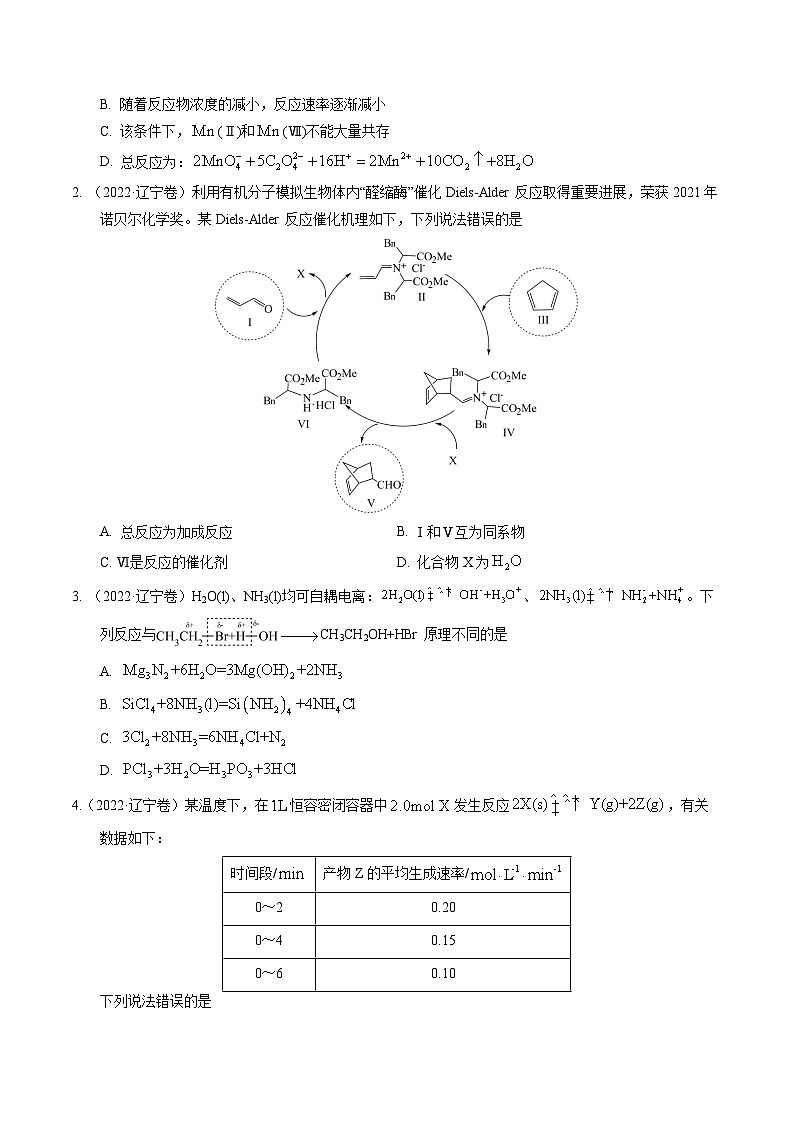
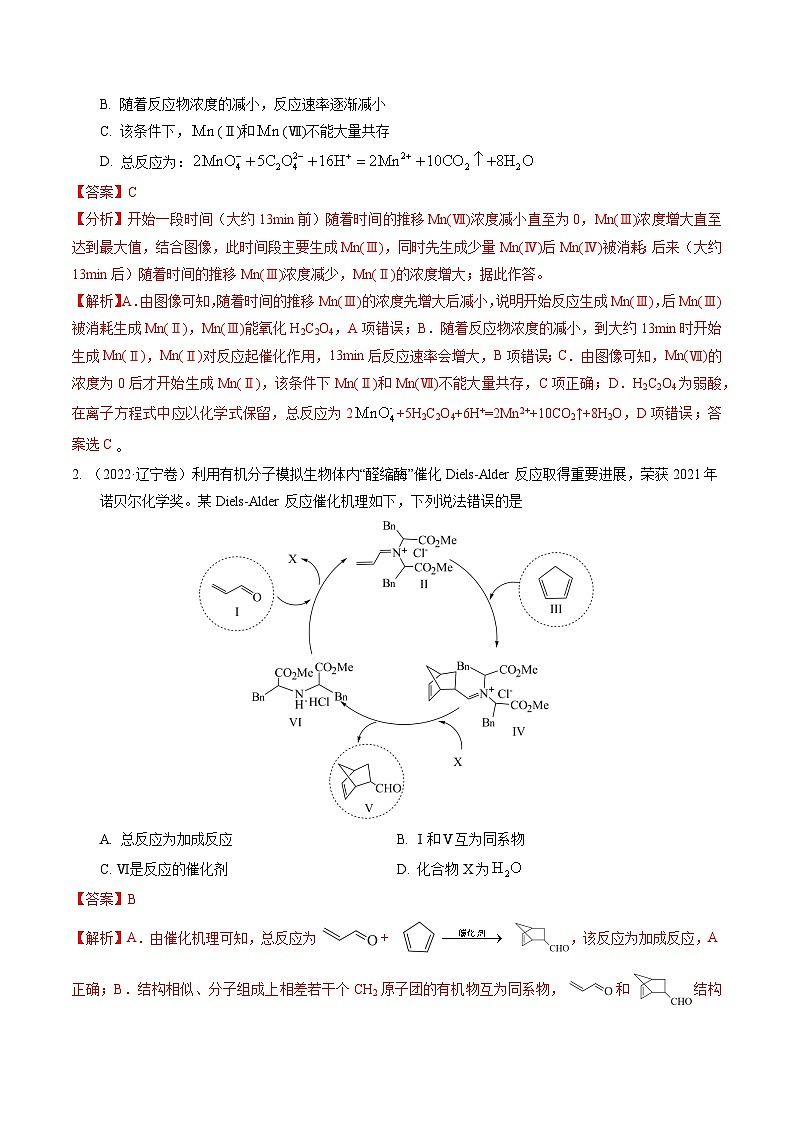
展开1. (2023·辽宁卷)一定条件下,酸性溶液与发生反应,(Ⅱ)起催化作用,过程中不同价态含粒子的浓度随时间变化如下图所示。下列说法正确的是
A. (Ⅲ)不能氧化
B. 随着反应物浓度的减小,反应速率逐渐减小
C. 该条件下,(Ⅱ)和(Ⅶ)不能大量共存
D. 总反应为:
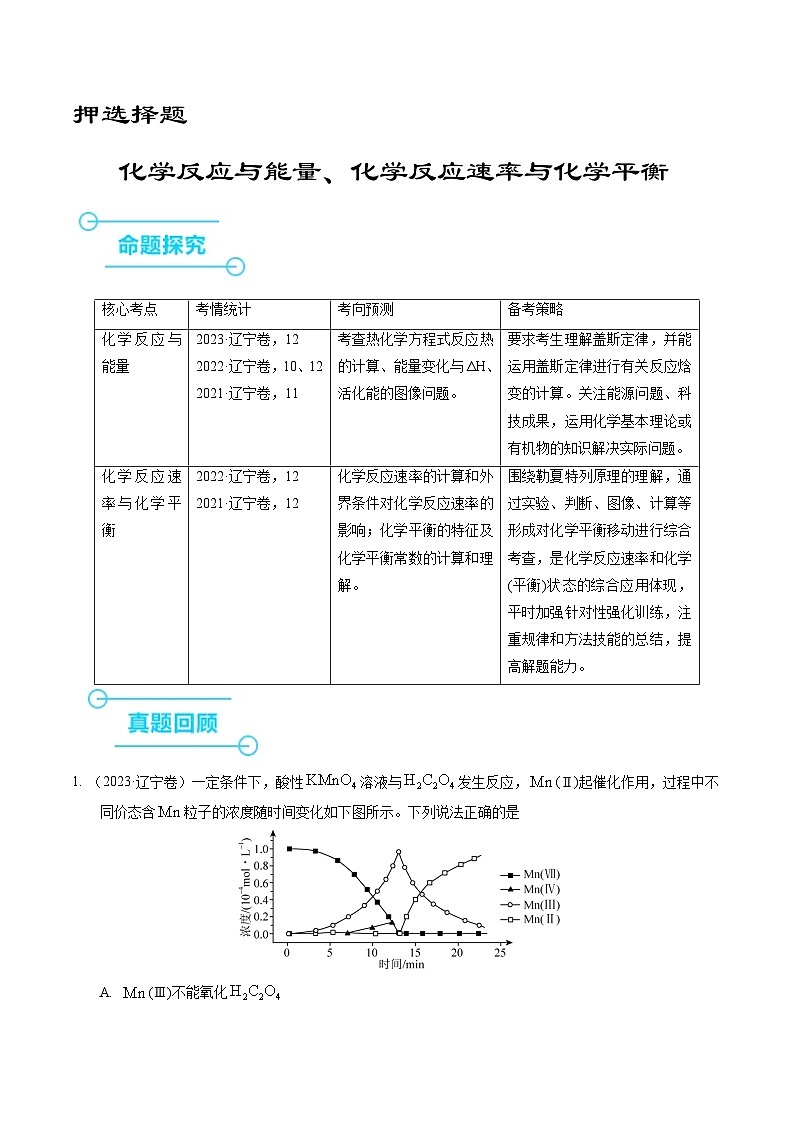
2. (2022·辽宁卷)利用有机分子模拟生物体内“醛缩酶”催化Diels-Alder反应取得重要进展,荣获2021年诺贝尔化学奖。某Diels-Alder反应催化机理如下,下列说法错误的是
A. 总反应为加成反应B. Ⅰ和Ⅴ互为同系物
C. Ⅵ是反应的催化剂D. 化合物X为
3. (2022·辽宁卷)H2O(l)、NH3(l)均可自耦电离:、。下列反应与CH3CH2OH+HBr原理不同的是
A.
B.
C.
D.
4.(2022·辽宁卷)某温度下,在恒容密闭容器中发生反应,有关数据如下:
下列说法错误的是
A. 时,Z的浓度大于
B. 时,加入,此时
C. 时,Y的体积分数约为33.3%
D. 时,X的物质的量为
5.(2021·辽宁卷)某温度下,在恒容密闭容器中加入一定量X,发生反应,一段时间后达到平衡。下列说法错误的是
A. 升高温度,若增大,则
B. 加入一定量Z,达新平衡后减小
C. 加入等物质的量的Y和Z,达新平衡后增大
D. 加入一定量氩气,平衡不移动
6.(2021·辽宁卷)某温度下,降冰片烯在钛杂环丁烷催化下聚合,反应物浓度与催化剂浓度及时间关系如图。已知反应物消耗一半所需的时间称为半衰期,下列说法错误的是
A. 其他条件相同时,催化剂浓度越大,反应速率越大
B. 其他条件相同时,降冰片烯浓度越大,反应速率越大
C. 条件①,反应速率为
D. 条件②,降冰片烯起始浓度为时,半衰期为
一、化学反应与能量
1.化学反应的能量变化——能垒图
在化学反应过程中,反应前后能量会发生变化。能垒指的是由于化学反应的成功发生对于反应物到达能量高的过渡态的过程的依赖性而产生的一个“阻碍”,只有一部分有足够能量的分子才能跨越能垒进行反应,每一个小的分步反应的从较低能量到过渡态所吸收的能量,可以理解成ΔH-t图中“爬坡”的阶段,这些阶段的吸收的能量都是能垒。
活化能是对能垒的一种量化描述,它代表着反应物到过渡态的具体能量差值,在这个ΔH-t图中,最高点(也就是能量最大的过渡态)到起始点(反应物)所吸收的能量。也就是,活化能越高,能垒越高,反应速率越慢,反之亦然。教材中的能量变化图示如下:
(1)反应历程中的最大能垒是指正反应过程中最大相对能量的差值,可以用估算法的方法进行确定;
(2)能垒越大,反应速率越小,即多步反应中能垒最大的反应为决速反应;
(3)相同反应物同时发生多个竞争反应,其中能垒越小的反应,反应速率越大,产物占比越高。
2.催化剂与活化能
(1)催化剂的催化机理:催化剂参与化学反应,生成能量更低的中间产物,降低了达到过渡态所需要的活化能,使反应易于发生,速率加快。这就是我们经常说的催化剂改变反应途径,降低反应的活化能。
(2)催化剂能降低反应所需活化能,化学反应速率加快,但不影响焓变∆H的大小,不影响平衡。
(3)催化反应一般过程(简化的过程):
①反应物扩散到催化剂表面;
②反应物被吸附在催化剂表面;
③被吸附的反应物发生化学反应生成产物;
④产物的解吸。
3.常见催化剂性质及应用
(1)催化剂的特性:选择性(是指给定条件下反应物之间能够同时发生多个反应情况下,催化剂可以大幅度提高目标产物在最终产物中的比率,酶的选择性极高)。
(2)选择反应温度依据之一:在选择某反应的温度时,首先应考虑催化剂的活性温度,以便最大限度地发挥催化剂的作用。
(3)催化剂中毒:由于某些物质(反应原料中带入的杂质、催化剂自身的某些杂质、反应产物或副产物)的作用而使催化活性衰退或丧失的现象。
(4)催化剂影响速率不影响化学平衡:对于可逆反应,催化剂同等程度地改变正逆反应速率,因而不能改变反应物的转化率,但可缩短反应达到化学平衡的时间。
(5)周期表中催化剂寻找区域:过渡元素区。
中学中常用的催化剂:酶是蛋白质,也是催化剂。二氧化锰、五氧化二钒、铁触媒、铂铑催化剂、Ni、Cu、Ag,浓硫酸、稀硫酸。
(6)教材研究催化剂的三个实验:①一个反应的催化剂可能有多种。如过氧化氢溶液分解的催化剂,除了二氧化锰之外,还可以用FeCl3、CuSO4溶液。②高锰酸钾与草酸反应,生成的Mn2+是访反应的催化剂,褪色速率会突然加快,是易被忽视的自催化反应。③淀粉水解实验,酶的催化条件温和而高效。
4.“环式”反应历程与机理
“环式”反应过程图如下:
“入环”的物质为反应物,如图中的 = 1 \* GB3 ① = 4 \* GB3 ④;位于“环上”的物质为催化剂或中间体,如图中的 = 5 \* GB3 ⑤ = 6 \* GB3 ⑥ = 7 \* GB3 ⑦ = 8 \* GB3 ⑧;“出环”的物质为生成物,如图中的 = 2 \* GB3 ② = 3 \* GB3 ③;由反应物和生成物可快速得出总反应方程式。
明确反应物:最重要的要看清图示中的箭头,明确哪些物质进行循环体系,哪些物质离子循环体系,进行循环体系的物质为总反应的反应物,离子循环体系的物质为总反应的生成物。
明确催化剂和中间产物:从循环图示中找出分解的若干反应,通过分步反应区分哪些是催化剂,哪些是中间产物。
写出总反应:依据质量守恒定律,确定循环 图示中没标出的物质,利用氧化还原反应的配平方法进行配平,写出总反应,同时标出催化剂和反应条件。
二、化学反应速率与化学平衡
1.外界条件对可逆反应的正、逆反应速率的影响
方向是一致的,但影响程度不一定相同
2.影响化学平衡的因素
3.关于化学平衡移动方向判断的分析
化学平衡状态是一种参数恒定的状态,而化学平衡的移动是指条件改变所导致的化学反应进行的方向的改变,化学平衡移动会带来化学平衡状态的参数的改变,但化学平衡移动不一定带来化学平衡状态的参数的改变,且参数的变化趋势也不是恒定的。所以,化学平衡移动的方向取决于正、逆反应速率的改变。
所带来的净变化量,即决定平衡移动方向的判据为v(正)与v(逆)的关系;条件改变瞬间若带来了体系中组分浓度的变化,且浓度商Q与平衡常数K的关系发生改变,化学平衡必然发生移动。因此,将v(正)与v(逆)的关系及浓度商Q与平衡常数K的关系作为平衡移动及方向的判据是合理的,而百分含量、转化率等平衡移动的判断依据没有抓住平衡移动的本质,必然带来结论的偏失。
4.牢记几种不能用勒夏特列原理解释的问题
(1)若外界条件改变后,无论平衡向正反应方向移动或向逆反应方向移动,都无法减弱外界条件的变化,则平衡不移动。如对于H2(g)+Br2(g)2HBr(g),由于反应前后气体的分子总数不变,外界压强增大或减小时,平衡无论正向或逆向移动都不能减弱压强的改变,因此对于该反应,压强改变,平衡不发生移动。
(2)催化剂能同等程度地改变正、逆反应速率,所以催化剂不会影响化学平衡。
5.化学反应速率和化学平衡图像题解题方法
(1)分析图像纵、横坐标轴上的数据,观察图像上曲线的走向和变化趋势。
(2)若图像上的曲线有两条或者两条以上时,注意观察和理解曲线的交点和拐点所代表的意义,先出现拐点的“温度高或压强大”。
(3)若图像中有三个量时,应“定一议二”。
(4) = 4 \* GB3 ④加入催化剂或对等体反应改变压强,平衡不移动,但会改变到达平衡的时间。
(5)曲线斜率大表示反应速率快,可能是升温、加压或使用催化剂。
(6)综合运用勒夏特列原理解决问题。
考点一 化学反应与能量
1.(2024·黑龙江大庆·高三一模)我国科学家已经成功地利用二氧化碳催化氢化获得甲酸,利用化合物1催化氢化二氧化碳的反应过程如图甲所示,其中化合物2与水反应生成化合物3与的反应历程如图乙所示,其中TS表示过渡态,Ⅰ表示中间体。下列说法错误的是
A.降低温度可促进化合物2与水反应生成化合物3与
B.化合物1为中间体Ⅰ1
C.图乙中形成中间体Ⅰ2的反应为总反应的决速步骤
D.化合物1到化合物2的过程中存在碳氧键的断裂和碳氢键的形成
2.(2024·辽宁沈阳·高三一模)基于非金属原子嵌入石墨烯三嗪基中,用于催化一氧化碳加氢生成甲醇的反应历程如图,其中吸附在催化剂表面上的物种用“”标注,下列说法中错误的是
A.整个反应历程中有极性键的断裂和生成
B.过渡态相对能量:TS55>TS44>TS77
C.物种吸附在催化剂表面的过程为吸热过程
D.反应决速步的活化能为
3.(2024·辽宁鞍山·统考一模)HA、HB为两种一元酸,为研究25°C时反应的相关性质,查阅此温度下相关数据:△H=+29.1kJ/ml;△S=+150.0J/(K·ml),下列说法正确的是
A.由于此过程△H>0,故HB比HA内能更低
B.△S对该反应自发性的影响小于△H
C.相对于B-,A-与质子的结合能力更强
D.体积和物质的量浓度均相同的NaA和NaB两溶液中,前者离子总数更多
4.(2024届·贵州·高三一模)甲酸常被用于橡胶、医药等工业,一定条件下可分解生成CO和H2O。在无催化剂和有催化剂的条件下,能量与反应历程的关系分别如图1、图2所示。下列说法错误的是
A.途径一和途径二中均涉及了极性键的断裂和生成
B.ΔH1<ΔH2<0
C.途径二使用了H+作为催化剂
D.途径二反应的快慢由生成的速率决定
5.(2024·贵州·统考模拟预测)叔丁基溴可与硝酸银在醇溶液中反应:
反应分步进行:
①
②
下图是该反应能量变化图。下列说法正确的是
A.选用催化剂可改变反应的大小
B.图中对应的物质是
C.其他条件不变时,的浓度越高,总反应速率越快
D.其他条件不变时,的浓度是总反应速率的决定因素
6.(2024·黑龙江哈尔滨·高三一模)丙烯与HCl加成生成CH3CHClCH3或CH3CH2CH2Cl的能量与反应历程如图所示,下列说法正确的是
A.中间体稳定性:A
C.反应CH3CH=CH2+ HCl→CH3-CH2-CH2Cl的活化能为(△E3+△E4) kJ/ml
D.由图可知,CH3CHClCH3为丙烯与HCl加成的主要产物
7.(2023春·辽宁大连·高三辽师大附中校考阶段练习)我国科学家合成了一种新型Au15/MC材料,实现了低温催化水煤气变换。反应历程如图所示,其中吸附在催化剂表面的物种用“*”标注,TS指过渡态。下列有关说法不正确的是
A.新型Au15/MC材料能实现低温催化水煤气变换主要原因是大幅度降低了活化能
B.分子从催化剂表面脱附的过程都是吸热的
C.反应历程中活化能最大的一步为CO*+2H2O*→CO*+H2O*+OH*+H*
D.该过程有极性键的断裂和生成
8.(2024·内蒙古赤峰·统考一模)苯和液溴反应进程中的能量变化如图所示。
已知:①断裂化学键所需要的能量(kJ/ml):
②
③
下列叙述正确的是
A.该反应为放热反应,ΔH=-55 kJ/ml
B.第一步是该反应的决速步骤
C.该反应的原子利用率约为 88%
D.可用NaOH溶液除去溴苯中混有的Br2
9.(2024·四川资阳·统考一模)我国科学家成功研发了甲烷和二氧化碳的共转化技术,助力“碳中和”目标。该催化反应历程如图所示:
已知部分化学键的键能数据如下:
下列说法不正确的是
A.该催化反应历程中没有非极性键断裂
B.催化剂的使用降低了该反应的活化能和焓变
C.总反应的原子利用率为100%
D.该反应的热化学方程式为:
10.(2023·辽宁抚顺·统考模拟预测)用五乙烯六胺(PEHA)多聚物来捕获二氧化碳,以Ru-PNP络合物作催化剂,可直接将空气中二氧化碳转化为甲醇,反应可能的过程如图所示。下列叙述错误的是
A.此过程总反应方程式为
B.产品甲醇作为重要的能源物质,可作为车用燃料
C.催化剂在循环过程中未参与中间反应
D.反应过程中既有极性键的断裂,又有非极性键的断裂
11.(2023·福建龙岩·统考模拟预测)CO2加氢制备CH4的一种催化机理如图(活化的微粒用*标注),下列说法中正确的是
A.CO2*的能量高于CO2
B.Ni-H2的形成增大了H-H键能
C.Ni、La2O3和La2O2CO3加氢反应的催化剂
D.制备CH4的过程涉及极性键和非极性键的断裂、形成
12.(2023·辽宁鞍山·统考二模)L-脯氨酸催化有机反应的机理如图所示(、分别表示向纸面内、向外伸展的共价键)。下列叙述错误的是
A.L-脯氨酸的化学式为:
B.过渡态中存在分子内氢键
C.若,则内盐中含有3个手性原子
D.图中总过程的化学方程式可表示为:
13.(2024·黑龙江·高三一模)南京师范大学李亚飞团队发明了在常温常压条件下,通过电化学反应将N2和CO2转化为尿素的绿色尿素合成方法,反应途径如图所示(图中M2B2为二维金属硼化物,M=M、Ti、Cr等过渡金属,*代表吸附)。
下列说法错误的是
A.M2B2是该反应过程的催化剂
B.反应②的产物*COOH中碳元素的化合价为+4
C.该过程中有极性键和非极性键的断裂
D.该过程的总反应式为CO2+N2+6e-+6H+=NH2CONH2+H2O
考点二 化学反应速率与化学平衡
1.(2024·吉林·统考模拟预测)CO2捕获技术用于去除气流中的CO2或者分离出CO2作为气体产物,其中CO2催化合成甲酸是原子利用率高的反应,且生成的甲酸是重要化工原料。下列说法错误的是
A.CO2分子中σ键和π键数目之比为1:1
B.在捕获过程,CO2分子中的共价键完全断裂
C.N(C2H5)3能够协助CO2到达催化剂表面
D.CO2催化加氢合成甲酸的总反应式:H2+CO2HCOOH
2.(2024届·吉林长春·统考一模)反应的速率方程为(k为速率常数,其中, A、R为常数,为活化能,T为开氏温度,其半衰期反应物消耗一半所需的时间)为0.8/k。改变反应物浓度时,反应的瞬时速率如表所示。下列说法正确的是
A.
B.
C.升温、加入催化剂,缩小容积(加压),均能使k增大,导致反应的瞬时速率加快
D.在过量的B存在时,A剩余12.5%所需的时间是
3.(2024届·黑龙江·统考一模)一定条件下,在的密闭容器中进行反应: 。反应过程中的有关数据如下表:
下列说法正确的是
A.该反应在高温下自发进行
B.时,的浓度小于
C.若保持温度不变,将容器体积扩大一倍,再达新平衡时
D.若保持温度不变,在第向体系中加入三种物质各,则平衡向逆反应方向移动
4.(2024·黑龙江牡丹江·统考一模)一定条件下,水气变换反应的中间产物是HCOOH。为探究该反应过程,研究HCOOH水溶液在密封石英管中的分解反应:
Ⅰ.(快)
Ⅱ.(慢)
研究发现,在反应Ⅰ、Ⅱ中,仅对反应Ⅰ有催化加速作用;反应Ⅰ速率远大于反应Ⅱ,近似认为反应Ⅰ建立平衡后始终处于平衡状态。忽略水的电离,其浓度视为常数。温度下,在密封石英管内完全充满水溶液,使HCOOH分解,分解产物均完全溶于水。含碳物种浓度与反应时间的变化关系如图所示(忽略碳元素的其他存在形式)。下列说法不正确的是
A.活化能:反应Ⅰ<反应Ⅱ
B.时,反应Ⅰ此时已经处于平衡状态
C.时刻测得CO、的浓度分别为、,反应Ⅱ达平衡时,测得的浓度为。则反应Ⅱ的平衡常数为
D.相同条件下,若反应起始时溶液中同时还含有盐酸,则图示点a、b、c、d中,CO新的浓度峰值点可能是b
5.(2024·吉林长春·高三一模)一定温度下,向三个容积不等的恒容密闭容器中分别投入2mlNOCl,发生反应:2NOCl(g)2NO(g)+Cl2(g)。反应tmin后,三个容器中NOCl的转化率如图中A、B、C三点。下列叙述正确的是
A.A点加入适当催化剂,可以提高NOCl的转化率
B.容积为aL的容器达到平衡后再投入,平衡不移动
C.A、B两点的压强之比为25:28
D.容积为cL的容器NOCl的平衡转化率小于80%
6.(2024·黑龙江哈尔滨·高三一模)在523.15K、7MPa的条件下,乙烯通过固体酸催化可直接与水反应生成乙醇:。该反应的吉布斯自由能()与温度(T)的关系如图所示。下列说法正确的是
A.该反应原子利用率100%
B.加入更多的固体酸催化剂,有利于提高乙醇的平衡产率
C.由图像可知
D.图中M点
7.(2024届·黑龙江·高三一模)一定条件下,在1.0L的密闭容器中进行反应: 。反应过程中的有关数据如下表:
下列说法正确的是
A.该反应在高温下自发进行
B.1min时,CO的浓度小于
C.若保持温度不变,将容器体积扩大一倍,再达新平衡时
D.若保持温度不变,在第向体系中加入三种物质各,则平衡向逆反应方向移动
8.(2023·辽宁本溪·本溪高中校考模拟预测)一定温度下,在2个容积均为1L的恒容密闭容器中,加入一定量的反应物,发生反应: ,相关数据见下表。
下列说法不正确的是
A.
B.Ⅰ中反应达到平衡时,CO的转化率为50%
C.达到平衡所需要的时间:Ⅱ>Ⅰ
D.对于Ⅰ,平衡后向容器中再充入0.2ml CO和0.2ml ,平衡正向移动
9.(2023·辽宁·校联考二模)某温度下,在2L恒容密闭容器中4mlNH2COONH4(s),发生如下反应,在0-1min内,CO2的生成速率为0.4ml•L-1•min-1,0-2min内,CO2的生成速率为0.3ml•L-1•min-1,0-3min内,CO2的生成速率为0.2ml•L-1•min-1,下列说法错误的是
A.当混合气体的平均摩尔质量不变时,标志此反应达到了平衡状态
B.0-1min内,NH2COONH4(s)的反应速率为62.4g/min
C.30秒时,CO2的浓度大于0.2ml/L
D.2min时,再加入2mlNH3,此时反应的V逆>V正
10.(2023·辽宁·校联考模拟预测)在600K下,按初始投料比分别为1:1、1:2、1:3投料,发生反应为。测得不同压强下,CO平衡转化率如图所示。下列叙述正确的是
A.曲线X代表起始投料比为1:1
B.,该反应达到平衡状态
C.若其他条件不变,升高温度会使对应的曲线上移
D.m点对应的的平衡转化率为60%
11.(2023·辽宁·校联考三模)天然金刚石存在稌少,以石墨为原料制备人造金刚石成为当前研究热点。下图是碳单质在不同温度、压强下存在形式的平衡图像,其中M区为金刚石的工业催化合成区,下列有关说法错误的是
A.稳定性:金刚石<石墨
B.密度:金刚石>石墨
C.在M区实现金刚石的合成,高温环境有利于提高石墨的平衡转化率
D.上图Q区与R区中,表示气态碳单质存在的区域应出现在R区
12.(2023·辽宁大连·大连二十四中校考模拟预测)实验室在1L的密闭容器中进行模拟合成实验,将和通入容器中,在催化剂的作用下发生:
反应I:(主反应);
反应II:
500℃时,将容器的体积压缩到原来的一半,在其他条件不变的情况下,平衡体系中变化正确的是
A.减小
B.反应I正反应速率加快,逆反应速率减慢
C.的物质的量增加
D.重新平衡时增大
13.(2023·辽宁沈阳·东北育才学校校考模拟预测)在催化剂作用下,向容积为1L的容器中加入1mlX和3mlY,发生反应:X(g)+2Y(s)2Z(s),平衡时和反应10min时X的转化率α(X)随温度的变化分别如曲线I、Ⅱ所示。下列说法正确的是
A.使用更高效的催化剂,可以使b点移动到d点
B.保持温度和体积不变,向d点体系中再充入1mlX,再次达平衡时c(X)>0.4ml/L
C.0-10min的平均反应速率:v(a)<v(c)
D.bc段变化可能是由于升高温度平衡逆向移动
14.(2023·辽宁沈阳·辽宁实验中学校考模拟预测)可以和发生反应:。一定温度下,向某恒容密闭容器中加入足量铁粉并充入一定量的气体,反应过程中气体和气体的浓度与时间的关系如图所示。下列说法正确的是
A.时该化学反应达到平衡状态
B.平衡后向容器内充入,重新达到平衡时增大
C.4 min时,的转化率约为71.4%
D.4 min内,的平均反应速率
15.(2023·辽宁阜新·校联考模拟预测)一定条件下热解制取:。已知其他条件不变时,温度对的平衡转化率和催化剂催化效率的影响如图所示。下列说法一定正确的是
A.平衡常数:
B.达到平衡所需时间:
C.总能量:
D.单位时间的转化率。:
核心考点
考情统计
考向预测
备考策略
化学反应与能量
2023·辽宁卷,12
2022·辽宁卷,10、12
2021·辽宁卷,11
考查热化学方程式反应热的计算、能量变化与ΔH、活化能的图像问题。
要求考生理解盖斯定律,并能运用盖斯定律进行有关反应焓变的计算。关注能源问题、科技成果,运用化学基本理论或有机物的知识解决实际问题。
化学反应速率与化学平衡
2022·辽宁卷,12
2021·辽宁卷,12
化学反应速率的计算和外界条件对化学反应速率的影响;化学平衡的特征及化学平衡常数的计算和理解。
围绕勒夏特列原理的理解,通过实验、判断、图像、计算等形成对化学平衡移动进行综合考查,是化学反应速率和化学(平衡)状态的综合应用体现,平时加强针对性强化训练,注重规律和方法技能的总结,提高解题能力。
时间段/
产物Z的平均生成速率/
0~2
0.20
0~4
0.15
0~6
0.10
反应历程与活化能
催化剂对反应历程与活化能影响
人教版新教材
鲁科版新教材
苏教版
条件改变
影响
增大反应物浓度
v正瞬间增大,v逆瞬间不变,随后也增大
增大压强
v正和v逆都增大,气体分子数减小方向的反应速率增大的程度大
对无气体参加或生成的化学反应的速率无影响
反应前后气体分子数不变的反应,正、逆反应速率同等程度地增大
升高温度
v正和v逆都增大,但吸热反应方向的反应速率增大的程度大
使用催化剂
能同等程度地改变正、逆反应速率
改变的条件(其他条件不变)
化学平衡移动的方向
浓度
增大反应物浓度或减小生成物浓度
向正反应方向移动
减小反应物浓度或增大生成物浓度
向逆反应方向移动
压强(对有气体参加的反应)
反应前后气体体积改变
增大压强
向气体分子总数减小的方向移动
减小压强
向气体分子总数增大的方向移动
反应前后气体体积不变
改变压强
平衡不移动
温度
升高温度
向吸热反应方向移动
降低温度
向放热反应方向移动
催化剂
同等程度改变v正、v逆,平衡不移动
C−H
C−Br
Br−Br(g)
H−Br(g)
413
276
194
366
共价键
键能(kJ/ml)
413
497
462
351
348
/
0.25
0.5
1
0.5
1
/
0.05
0.05
0.1
0.1
0.2
v/
1.6
3.2
3.2
0
2
4
6
8
2.4
1.6
0.6
2
0.2
0
0
2
4
6
8
2.4
1.6
0.6
2
0.2
0
容器编号
温度/℃
起始物质的量/ml
平衡物质的量/ml
Ⅰ
0.2
0.2
0.1
Ⅱ
0.2
0.2
0.12
(黑吉辽通用)新高考化学三轮冲刺强化练习 非选择题 有机化学综合题(2份打包,原卷版+解析版): 这是一份(黑吉辽通用)新高考化学三轮冲刺强化练习 非选择题 有机化学综合题(2份打包,原卷版+解析版),文件包含黑吉辽通用新高考化学三轮冲刺强化练习非选择题有机化学综合题原卷版docx、黑吉辽通用新高考化学三轮冲刺强化练习非选择题有机化学综合题解析版docx等2份试卷配套教学资源,其中试卷共58页, 欢迎下载使用。
(黑吉辽通用)新高考化学三轮冲刺强化练习 非选择题 化学工艺流程综合题(2份打包,原卷版+解析版): 这是一份(黑吉辽通用)新高考化学三轮冲刺强化练习 非选择题 化学工艺流程综合题(2份打包,原卷版+解析版),文件包含黑吉辽通用新高考化学三轮冲刺强化练习非选择题化学工艺流程综合题原卷版docx、黑吉辽通用新高考化学三轮冲刺强化练习非选择题化学工艺流程综合题解析版docx等2份试卷配套教学资源,其中试卷共46页, 欢迎下载使用。
(黑吉辽通用)新高考化学三轮冲刺强化练习 非选择题 化学实验综合题(2份打包,原卷版+解析版): 这是一份(黑吉辽通用)新高考化学三轮冲刺强化练习 非选择题 化学实验综合题(2份打包,原卷版+解析版),文件包含黑吉辽通用新高考化学三轮冲刺强化练习非选择题化学实验综合题原卷版docx、黑吉辽通用新高考化学三轮冲刺强化练习非选择题化学实验综合题解析版docx等2份试卷配套教学资源,其中试卷共46页, 欢迎下载使用。












