


所属成套资源:(黑吉辽通用)新高考化学三轮冲刺强化练习 (2份打包,原卷版+解析版)
- (黑吉辽通用)新高考化学三轮冲刺强化练习 选择题 有机化合物的结构和性质 实验基本操作(2份打包,原卷版+解析版) 试卷 0 次下载
- (黑吉辽通用)新高考化学三轮冲刺强化练习 选择题 物质的制备 性质和转化 阿伏加德罗常数(2份打包,原卷版+解析版) 试卷 0 次下载
- (黑吉辽通用)新高考化学三轮冲刺强化练习 非选择题 化学实验综合题(2份打包,原卷版+解析版) 试卷 0 次下载
- (黑吉辽通用)新高考化学三轮冲刺强化练习 非选择题 化学工艺流程综合题(2份打包,原卷版+解析版) 试卷 0 次下载
- (黑吉辽通用)新高考化学三轮冲刺强化练习 非选择题 有机化学综合题(2份打包,原卷版+解析版) 试卷 0 次下载
(黑吉辽通用)新高考化学三轮冲刺强化练习 非选择题 化学反应原理综合题(2份打包,原卷版+解析版)
展开
这是一份(黑吉辽通用)新高考化学三轮冲刺强化练习 非选择题 化学反应原理综合题(2份打包,原卷版+解析版),文件包含黑吉辽通用新高考化学三轮冲刺强化练习非选择题化学反应原理综合题原卷版docx、黑吉辽通用新高考化学三轮冲刺强化练习非选择题化学反应原理综合题解析版docx等2份试卷配套教学资源,其中试卷共52页, 欢迎下载使用。
1. (2023.辽宁卷) 硫酸工业在国民经济中占有重要地位。
(1)我国古籍记载了硫酸的制备方法——“炼石胆(CuSO4·5H2O)取精华法”。借助现代仪器分析,该制备过程中CuSO4·5H2O分解的TG曲线(热重)及DSC曲线(反映体系热量变化情况,数值已省略)如下图所示。700℃左右有两个吸热峰,则此时分解生成的氧化物有SO2、_______和_______(填化学式)。
(2)铅室法使用了大容积铅室制备硫酸(76%以下),副产物为亚硝基硫酸,主要反应如下:
NO2+SO2+H2O=NO+H2SO4
2NO+O2=2NO2
(ⅰ)上述过程中NO2的作用为___________________________。
(ⅱ)为了适应化工生产的需求,铅室法最终被接触法所代替,其主要原因是____________________(答出两点即可)。
(3)接触法制硫酸的关键反应为SO2的催化氧化:
SO2(g)+O2(g)SO3(g) ΔH=-98.9kJ·ml-1
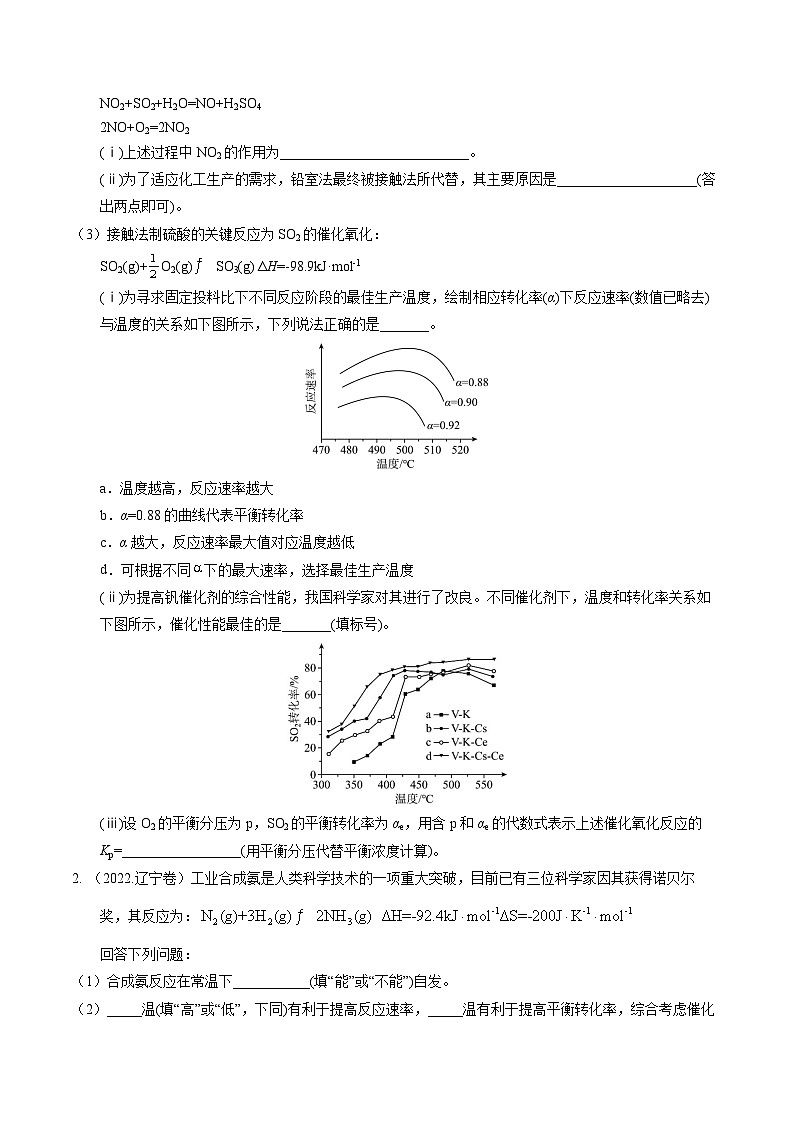
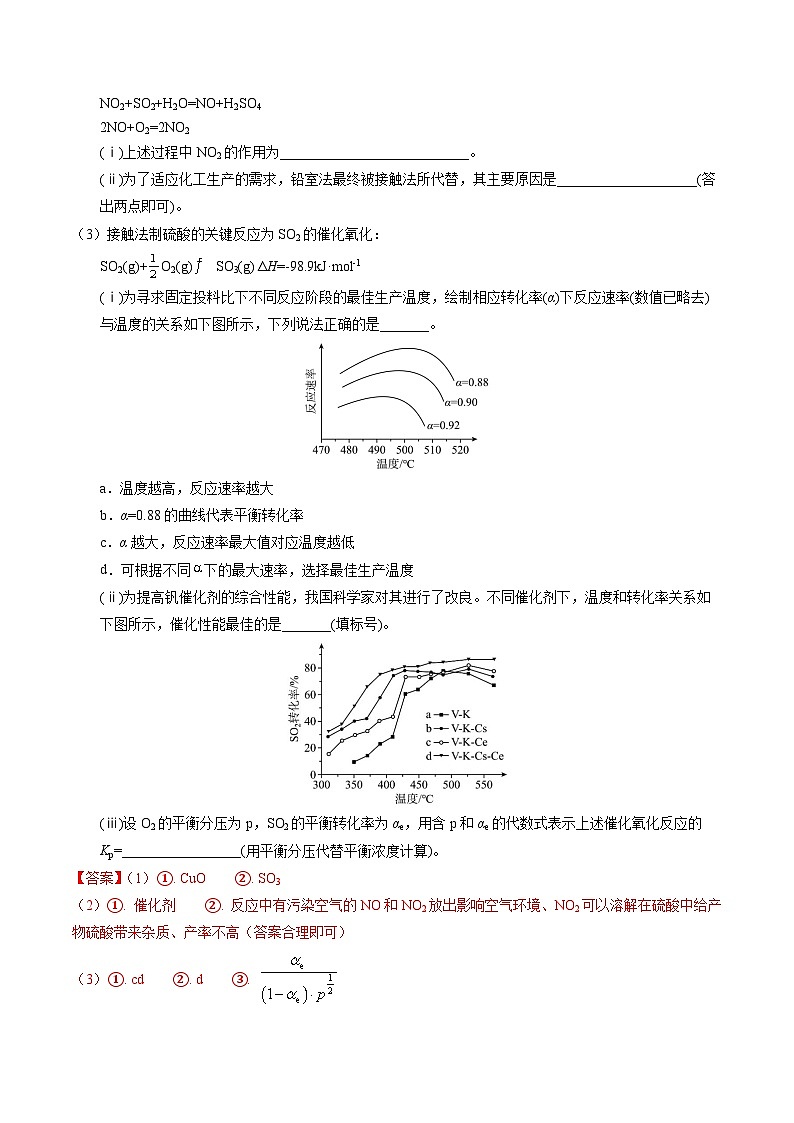
(ⅰ)为寻求固定投料比下不同反应阶段的最佳生产温度,绘制相应转化率(α)下反应速率(数值已略去)与温度的关系如下图所示,下列说法正确的是_______。
a.温度越高,反应速率越大
b.α=0.88的曲线代表平衡转化率
c.α越大,反应速率最大值对应温度越低
d.可根据不同下的最大速率,选择最佳生产温度
(ⅱ)为提高钒催化剂的综合性能,我国科学家对其进行了改良。不同催化剂下,温度和转化率关系如下图所示,催化性能最佳的是_______(填标号)。
(ⅲ)设O2的平衡分压为p,SO2的平衡转化率为αe,用含p和αe的代数式表示上述催化氧化反应的Kp=_________________(用平衡分压代替平衡浓度计算)。
【答案】(1)①. CuO ②. SO3
(2)①. 催化剂 ②. 反应中有污染空气的NO和NO2放出影响空气环境、NO2可以溶解在硫酸中给产物硫酸带来杂质、产率不高(答案合理即可)
(3)①. cd ②. d ③.
【解析】
【小问1详解】根据图示的热重曲线所示,在700℃左右会出现两个吸热峰,说明此时CuSO4发生热分解反应,从TG图像可以看出,质量减少量为原CuSO4质量的一半,说明有固体CuO剩余,还有其他气体产出,此时气体产物为SO2、SO3、O2,可能出现的化学方程式为3CuSO43CuO+2SO2↑+SO3↑+O2↑,结合反应中产物的固体产物质量和气体产物质量可以确定,该反应的产物为CuO、SO2、SO3、O2,故答案为CuO、SO3。
【小问2详解】(i)根据所给的反应方程式,NO2在反应过程中线消耗再生成,说明NO2在反应中起催化剂的作用;
(ii)近年来,铅室法被接触法代替因为在反应中有污染空气的NO和NO2放出影响空气环境、同时作为催化剂的NO2可以溶解在硫酸中给产物硫酸带来杂质影响产品质量、产率不高(答案合理即可)。
【小问3详解】(i)a.根据不同转化率下的反应速率曲线可以看出,随着温度的升高反应速率先加快后减慢,a错误;b.从图中所给出的速率曲线可以看出,相同温度下,转化率越低反应速率越快,但在转化率小于88%的时的反应速率图像并没有给出,无法判断α=0.88的条件下是平衡转化率,b错误;c.从图像可以看出随着转化率的增大,最大反应速率不断减小,最大反应速率出现的温度也逐渐降低,c正确;d.从图像可以看出随着转化率的增大,最大反应速率出现的温度也逐渐降低,这时可以根据不同转化率选择合适的反应温度以减少能源的消耗,d正确;故答案选cd;
(ii)为了提高催化剂的综合性能,科学家对催化剂进行了改良,从图中可以看出标号为d的催化剂V-K-Cs-Ce对SO2的转化率最好,产率最佳,故答案选d;
(iii)利用分压代替浓度计算平衡常数,反应的平衡常数Kp===;设SO2初始量为m ml,则平衡时n(SO2)=m-m·αe=m(1-αe),n(SO3)=m·αe,Kp==,故答案为。
2. (2022.辽宁卷)工业合成氨是人类科学技术的一项重大突破,目前已有三位科学家因其获得诺贝尔奖,其反应为:
回答下列问题:
(1)合成氨反应在常温下___________(填“能”或“不能”)自发。
(2)_____温(填“高”或“低”,下同)有利于提高反应速率,_____温有利于提高平衡转化率,综合考虑催化剂(铁触媒)活性等因素,工业常采用。
针对反应速率与平衡产率的矛盾,我国科学家提出了两种解决方案。
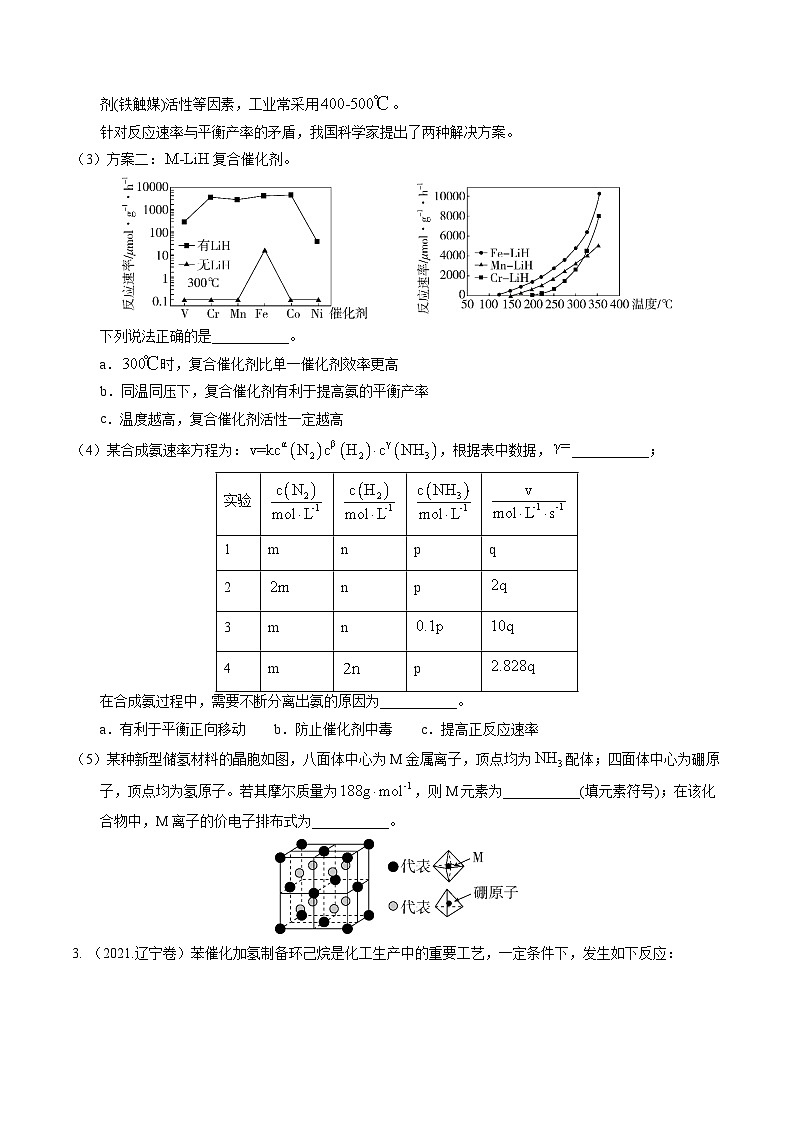
(3)方案二:复合催化剂。
下列说法正确的是___________。
a.时,复合催化剂比单一催化剂效率更高
b.同温同压下,复合催化剂有利于提高氨的平衡产率
c.温度越高,复合催化剂活性一定越高
(4)某合成氨速率方程为:,根据表中数据,___________;
在合成氨过程中,需要不断分离出氨的原因为___________。
a.有利于平衡正向移动 b.防止催化剂中毒 c.提高正反应速率
(5)某种新型储氢材料的晶胞如图,八面体中心为M金属离子,顶点均为配体;四面体中心为硼原子,顶点均为氢原子。若其摩尔质量为,则M元素为___________(填元素符号);在该化合物中,M离子的价电子排布式为___________。
【答案】(1)能 (2) ①. 高 ②. 低
(3)a (4) ①. ②. a
(5) ①. ②.
【解析】
【分析】(1)氨的分离对反应速率的影响;从反应速率方程可以推知,当降低时,v增大。注意由于反应速率方程通常由实验测定,其中v应指净反应速率,即,因此在其他条件一定时,分离氨气是通过降低逆反应速率,从而提高净反应速率。
(2)中,氢元素化合价的判断:由于电负性,因此中H显价,中H元素的化合价为-1价;(3)中根据图像进行判断,利用控制变量法进行分析;(4)利用实验对比,注意选择对比实验室,选择控制变量,找变量;(5)利用晶胞密度计算公式计算元素的相对原子质量,根据元素相对原子质量进行判断元素;
【小问1详解】对于合成氨反应,常温下,,故合成氨反应在常温下能自发进行;
【小问2详解】其他条件一定时,升高温度,可以提供更高的能量,使活化分子百分数增大,反应速率加快;合成氨反应是放热反应,要提高平衡转化率,即使反应平衡正向移动,应降低温度;故答案为:高、低;
【小问3详解】由题图可知,时,复合催化剂催化时合成氨反应的反应速率比单-催化剂催化时大很多,说明时复合催化剂比单-催化剂效率更高,a正确;同温同压下,复合催化剂能提高反应速率,但不能使平衡发生移动,故不能提高氨的平衡产率,b错误;温度过高,复合催化剂可能会失去活性,催化效率反而降低,c错误;故选a;
【小问4详解】
将实验1、3中数据分别代入合成氨的速率方程可得:①,③,可得。合成氨过程中,不断分离出氨,即降低体系中,生成物浓度下降,平衡向正反应方向移动,但不会提高正反应速率,a正确,c错误;反应主产物即氨不能使催化剂中毒,b错误。
【小问5详解】由图可知,“”代表,“”代表,面心立方最密堆积的晶胞中,“”处于8个顶角和6个面心,则每个晶胞中含“”的个数为,8个“ ”均处于晶胞内部,则“”和“ ”的个数之比为,故该晶体的化学式为;又知该化合物的摩尔质量为,则有,解得,故M元素为。化合物中,整体为0价,中B为价,H为价,则为价,基态原子核外电子排布式为,失老轨道上的2个电子得到,故的价电子排布式为。
3. (2021.辽宁卷)苯催化加氢制备环己烷是化工生产中的重要工艺,一定条件下,发生如下反应:
Ⅰ.主反应:(g)+3H2(g)⇌(g) ∆H10
回答下列问题:
(1)已知:Ⅲ.
Ⅳ.2 (g)+15O2(g)⇌12CO2(g)+6H2O(l) ∆H4
Ⅴ.(g)+9O2(g)=6CO2(g)+6H2O(l) ∆H5
则∆H1==_______(用∆H3、∆H4和∆H5表示)。
(2)有利于提高平衡体系中环己烷体积分数的措施有_________。
A. 适当升温B. 适当降温 C. 适当加压 D. 适当减压
(3)反应Ⅰ在管式反应器中进行,实际投料往往在的基础上适当增大用量,其目的是______________________。
(4)氢原子和苯分子吸附在催化剂表面活性中心时,才能发生反应,机理如图。当中混有微量或等杂质时,会导致反应Ⅰ的产率降低,推测其可能原因为________________。
(5)催化剂载体中的酸性中心能催化苯及环己烷的裂解。已知酸性中心可结合孤电子对,下图中可作为酸性中心的原子的标号是_______(填“①”“②”或“③”)。
(6)恒压反应器中,按照投料,发生Ⅰ、Ⅱ反应,总压为,平衡时苯的转化率为α,环己烷的分压为p,则反应1的__________________(列出计算式即可,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
【答案】(1) (2)BC
(3)提高苯的利用率 (4)金属催化剂会与H2S或CO反应从而失去催化活性
(5)② (6)
【解析】
【分析】
【小问1详解】根据盖斯定律结合已知反应:Ⅲ. Ⅳ.2 (g)+15O2(g)⇌12CO2(g)+6H2O(l) ∆H4 Ⅴ. (g)+9O2(g)=6CO2(g)+6H2O(l) ∆H5
Ⅰ.主反应:(g)+3H2(g)⇌(g)可由,则,故答案为:;
【小问2详解】根据Ⅰ.主反应:(g)+3H2(g)⇌(g)是一个气体体积减小的方向的放热反应,故有利于提高平衡体系中环己烷体积分数即使平衡向正方向移动,根据勒夏特列原理,可采用适当降低温度和实当加压有利平衡正向移动,而升温和减压都将使平衡逆向移动,故答案为:BC;
【小问3详解】反应Ⅰ在管式反应器中进行,实际投料往往在的基础上适当增大用量,增大H2的浓度将使平衡正向移动,从而提高苯的转化率即利用率,故适当增大H2用量的目的是提高苯的利用率,故答案为:提高苯的利用率;
【小问4详解】氢原子和苯分子吸附在催化剂表面活性中心时,才能发生反应,机理如图。当中混有微量或等杂质时,会导致反应Ⅰ的产率降低,推测其可能原因为金属催化剂会与H2S或CO反应从而失去催化活性,故答案为:金属催化剂会与H2S或CO反应从而失去催化活性;
【小问5详解】催化剂载体中的酸性中心能催化苯及环己烷的裂解。已知酸性中心可结合弧电子对,由图可知,①中原子无孤对电子也没有空轨道,②中原子无孤对电子但有空轨道可接收孤电子对,③中有孤对电子,无空轨道,故下图中可作为酸性中心的原子的标号是②,故答案为:②;
【小问6详解】恒压反应器中,按照投料,设投入的苯的物质的量为1ml,发生Ⅰ、Ⅱ反应总压为,平衡时苯的转化率为α,环己烷的分压为p,则:, 有反应后平衡体系中总的物质的量为:1-α+4-3α+α-x+x=5-3α,故平衡时,苯的分压为:,H2的分压为:,则反应1的= ,故答案为:。
一、反应热的计算
(1)利用键能计算反应热:ΔH=∑E(反应物)-∑E(生成物),即ΔH等于反应物的键能总和与生成物的键能总和之差。
(2)由反应物、生成物的总能量计算反应热:ΔH=生成物总能量-反应物总能量,这类计算通常会通过图像的方式给出反应物、生成物的能量。
(3)应用盖斯定律既可以计算出目标反应的ΔH,也可以得出目标反应的热化学方程式。这是热化学的重点考查方式。
①调方向:根据目标方程式反应物、生成物的位置,调整已知方程式的反应方向。满足目标方程式各物质的位置要求,注意方程式方向改变ΔH符号随之改变。
②调系数:把目标方程式中不存在的物质的系数调整为相等。
③相加:然后把调整好的方程式相加就得到目标方程式,必要时可约简化学计量数。同时也得到相应方程式的反应热ΔH。
二、化学反应速率和化学平衡问题
1.分析反应速率和化学平衡问题的注意点
(1)熟练“三段式”,准确计算反应速率、转化率和平衡常数。
①明确三种量的意义:一是起始量(物质的量或浓度),二是变化量,三是平衡量;
②用变化量求反应速率和转化率,用平衡浓度求平衡常数。
(2)化学平衡状态的比较分析时,要审清两个条件:①恒温恒容;②恒温恒压。
(3)平衡常数的计算
①固体和纯液体的浓度视为常数(不出现在平衡常数表达式中);
②理解气体分压的意义(等于气体物质的量之比)以及气体压强平衡常数的计算。
(4)对于可逆反应,温度变化对正、逆反应速率均产生影响,且影响趋势相同,但影响程度不同。
①升温对吸热反应影响较大,对放热反应影响较小;
②降温对吸热反应影响较小,对放热反应影响较大。
2.分析图表时应注意的问题
(1)仔细分析曲线的最高点、最低点、拐点和平衡点,找准纵坐标与横坐标的对应数据。
(2)分析表格数据时,找出数据大小的变化规律。
三、化学平衡常数的应用
(1)判断反应进行的方向
通过与浓度商的大小比较,判断反应进行的方向。对于可逆反应:mA(g)+nB(g)pC(g)+qD(g),在一定温度下的任意时刻,浓度商(Qc)表达式为
Qc= QUOTE 。
若Qcv(逆),向正反应方向进行。
若Qc=K,v(正)=v(逆),反应处于平衡状态。
若Qc>K,v(正)”、“=”或“”、“=”或“
相关试卷
这是一份(黑吉辽通用)新高考化学三轮冲刺强化练习 非选择题 有机化学综合题(2份打包,原卷版+解析版),文件包含黑吉辽通用新高考化学三轮冲刺强化练习非选择题有机化学综合题原卷版docx、黑吉辽通用新高考化学三轮冲刺强化练习非选择题有机化学综合题解析版docx等2份试卷配套教学资源,其中试卷共58页, 欢迎下载使用。
这是一份(黑吉辽通用)新高考化学三轮冲刺强化练习 非选择题 化学工艺流程综合题(2份打包,原卷版+解析版),文件包含黑吉辽通用新高考化学三轮冲刺强化练习非选择题化学工艺流程综合题原卷版docx、黑吉辽通用新高考化学三轮冲刺强化练习非选择题化学工艺流程综合题解析版docx等2份试卷配套教学资源,其中试卷共46页, 欢迎下载使用。
这是一份(黑吉辽通用)新高考化学三轮冲刺强化练习 非选择题 化学实验综合题(2份打包,原卷版+解析版),文件包含黑吉辽通用新高考化学三轮冲刺强化练习非选择题化学实验综合题原卷版docx、黑吉辽通用新高考化学三轮冲刺强化练习非选择题化学实验综合题解析版docx等2份试卷配套教学资源,其中试卷共46页, 欢迎下载使用。









