

(通用版)新高考化学三轮冲刺练习 第13-14题 电化学原理与应用、电解质溶液曲线(2份打包,原卷版+解析版)
展开
这是一份(通用版)新高考化学三轮冲刺练习 第13-14题 电化学原理与应用、电解质溶液曲线(2份打包,原卷版+解析版),文件包含通用版新高考化学三轮冲刺练习第13-14题电化学原理与应用电解质溶液曲线原卷版docx、通用版新高考化学三轮冲刺练习第13-14题电化学原理与应用电解质溶液曲线解析版docx等2份试卷配套教学资源,其中试卷共54页, 欢迎下载使用。
考点一 电化学原理与应用
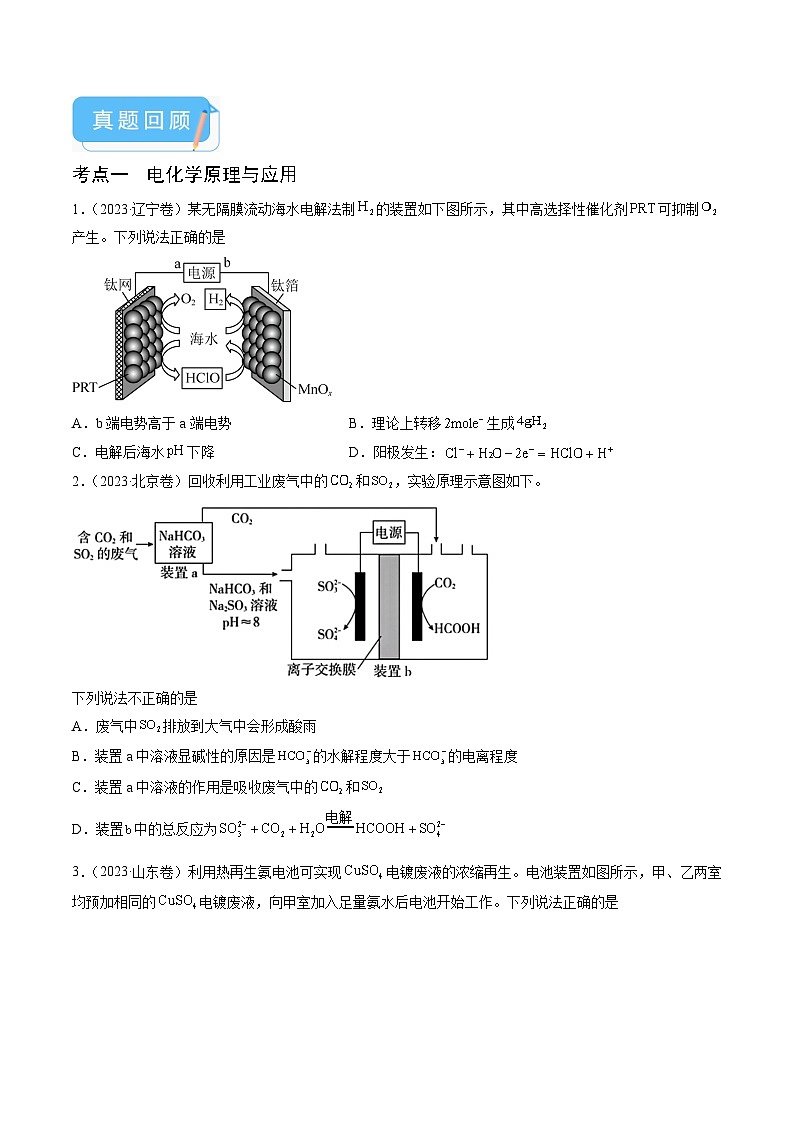
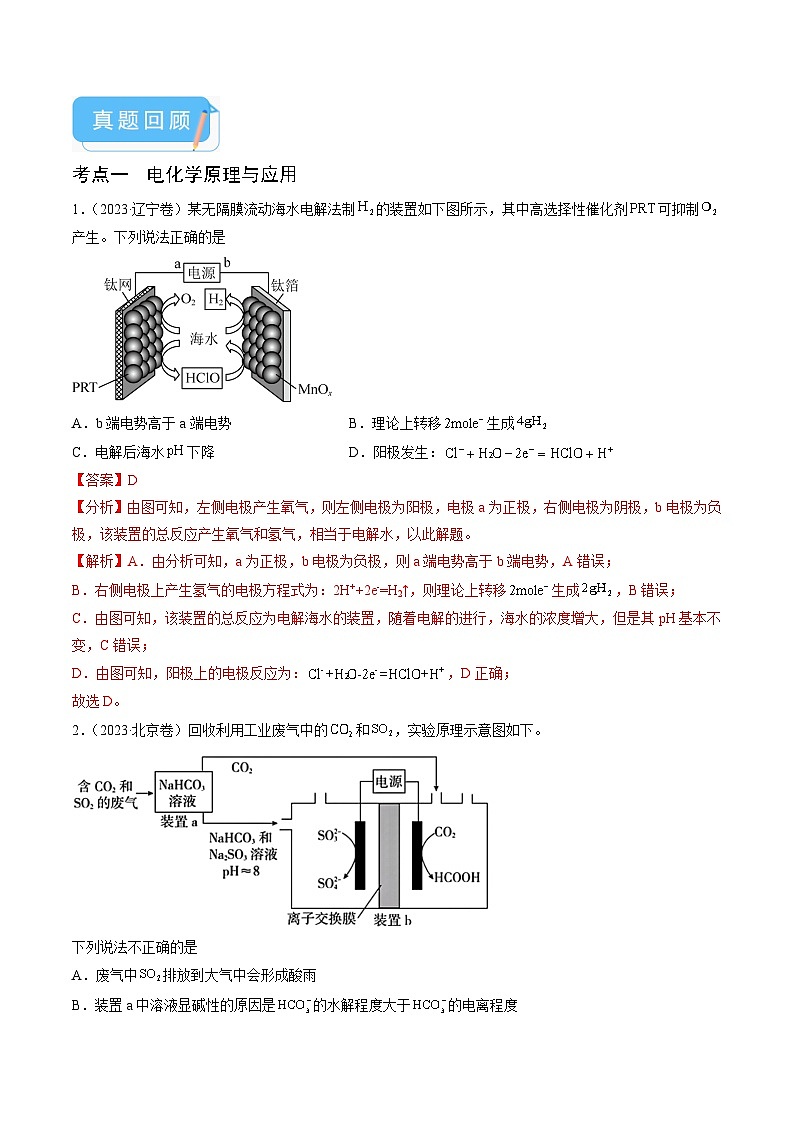
1.(2023·辽宁卷)某无隔膜流动海水电解法制的装置如下图所示,其中高选择性催化剂可抑制产生。下列说法正确的是
A.b端电势高于a端电势B.理论上转移生成
C.电解后海水下降D.阳极发生:
2.(2023·北京卷)回收利用工业废气中的和,实验原理示意图如下。
下列说法不正确的是
A.废气中排放到大气中会形成酸雨
B.装置a中溶液显碱性的原因是的水解程度大于的电离程度
C.装置a中溶液的作用是吸收废气中的和
D.装置中的总反应为
3.(2023·山东卷)利用热再生氨电池可实现电镀废液的浓缩再生。电池装置如图所示,甲、乙两室均预加相同的电镀废液,向甲室加入足量氨水后电池开始工作。下列说法正确的是
A.甲室电极为正极
B.隔膜为阳离子膜
C.电池总反应为:
D.扩散到乙室将对电池电动势产生影响
4.(2023·湖北卷)我国科学家设计如图所示的电解池,实现了海水直接制备氢气技术的绿色化。该装置工作时阳极无生成且KOH溶液的浓度不变,电解生成氢气的速率为。下列说法错误的是
A.b电极反应式为
B.离子交换膜为阴离子交换膜
C.电解时海水中动能高的水分子可穿过PTFE膜
D.海水为电解池补水的速率为
5.(2023·辽宁卷)某低成本储能电池原理如下图所示。下列说法正确的是
A.放电时负极质量减小
B.储能过程中电能转变为化学能
C.放电时右侧通过质子交换膜移向左侧
D.充电总反应:
考点二 电解质溶液曲线
6.(2023·山东卷)在含HgI2(g)的溶液中,一定c(I-)范围内,存在平衡关系:;;;;,平衡常数依次为。已知、,、随的变化关系如图所示,下列说法错误的是
A.线表示的变化情况
B.随增大,先增大后减小
C.
D.溶液中I元素与元素的物质的量之比始终为
7.(2023·北京卷)利用平衡移动原理,分析一定温度下在不同的体系中的可能产物。
已知:i.图1中曲线表示体系中各含碳粒子的物质的量分数与的关系。
ii.2中曲线Ⅰ的离子浓度关系符合;曲线Ⅱ的离子浓度关系符合[注:起始,不同下由图1得到]。
下列说法不正确的是
A.由图1,
B.由图2,初始状态,无沉淀生成
C.由图2,初始状态,平衡后溶液中存在
D.由图1和图2,初始状态、,发生反应:
8.(2023·辽宁卷)某废水处理过程中始终保持H2S饱和,即,通过调节pH使和形成硫化物而分离,体系中与关系如下图所示,c为和的浓度,单位为。已知,下列说法正确的是
A.B.③为与的关系曲线
C.D.
9.(2023·湖南卷)常温下,用浓度为的标准溶液滴定浓度均为的和的混合溶液,滴定过程中溶液的随()的变化曲线如图所示。下列说法错误的是
A.约为
B.点a:
C.点b:
D.水的电离程度:
10.(2023·湖北卷)为某邻苯二酚类配体,其,。常温下构建溶液体系,其中,。体系中含Fe物种的组分分布系数δ与pH的关系如图所示,分布系数,已知,。下列说法正确的是
A.当时,体系中
B.pH在9.5~10.5之间,含L的物种主要为
C.的平衡常数的lgK约为14
D.当时,参与配位的
一、溶液中各类平衡常数的计算方法及关系
(1)电离平衡常数(Ka)与电离度(α)的关系(以一元弱酸HA为例)
HA H+ + A-
起始浓度 c酸 0 0
平衡浓度 c酸·(1-α) c酸·α c酸·α
Ka= eq \f((c酸·α)2,c酸·(1-α)) = eq \f(c酸·α2,1-α) 。
若α很小,可认为1-α≈1,则Ka=c酸·α2 eq \b\lc\(\rc\)(\a\vs4\al\c1(或α=\r(\f(Ka,c酸)))) 。
(2)电离平衡常数与水解平衡常数的关系
①对于一元弱酸HA,Ka与Kh的关系
HAH++A-,Ka(HA)= eq \f(c(H+)·c(A-),c(HA)) ;
A-+H2OHA+OH-,Kh(A-)= eq \f(c(OH-)·c(HA),c(A-)) 。
则Ka·Kh=c(H+)·c(OH-)=Kw,故Kh= eq \f(Kw,Ka) 。
②对于二元弱酸H2B,Ka1(H2B)、Ka2(H2B)与Kh(HB-)、Kh(B2-)的关系
HB-+H2OH2B+OH-,
Kh(HB-)= eq \f(c(OH-)·c(H2B),c(HB-)) = eq \f(c(H+)·c(OH-)·c(H2B),c(H+)·c(HB-)) = eq \f(Kw,Ka1) 。
B2-+H2OHB-+OH-,
Kh(B2-)= eq \f(c(OH-)·c(HB-),c(B2-)) = eq \f(c(H+)·c(OH-)·c(HB-),c(H+)·c(B2-)) = eq \f(Kw,Ka2) 。
【特别提示】
常温时,对于一元弱酸HA,当Ka>1.0×10-7时,KhCaCO3>MnCO3;
③X点相对于CaCO3来说要析出沉淀,相对于CaSO4来说是不饱和溶液,能继续溶解CaSO4;
④Y点:c(SO42—)>c(Ca2+),二者的浓度积等于10-5;
Z点:c(CO32—)c(HA-)
C.pH=7时,c(Na+)>3c(A2-)
D.H2A与NaOH恰好完全反应生成正盐时,c(OH-)=c(HA-)+c(H2A)+c(H+)
21.常温下,用调节浊液的pH,测得在通入的过程中,体系中(X代表或)与的关系如图所示。下列说法正确的是
已知:为微溶于水,溶于盐酸,不溶于氢氟酸、乙醇和丙酮的固体。
A.
B.随着的加入,溶解度逐渐减小
C.p点对应的溶液中
D.m、n点时的溶液中均存在
22.(2024·广西北海·统考一模)柠檬酸是番茄中最常见的天然酸性物质,其分子结构简式为(用表示)。常温下,用溶液滴定溶液的滴定曲线如图所示。已知常温下柠檬酸的电离常数为:。下列叙述正确的是
A.a点溶液中,
B.b点溶液中,
C.常温下溶液加水稀释过程中,减小
D.常温下的水解常数为
23.(2024·黑龙江·统考一模)时,用溶液分别滴定等物质的量浓度的三种溶液pM[p表示负对数,表示]随溶液变化的关系如图所示。已知:常温下,。下列推断正确的是
A.曲线③代表与的关系曲线
B.调节时,可将废水中完全沉淀
C.滴定溶液至X点时,溶液中:
D.经计算,能完全溶于HR溶液
24.溶液滴定溶液时,、各含磷元素微粒的和的关系如图。下列说法中正确的是
A.①为的与的关系
B.b点时,溶液中
C.的
D.d点时,溶液中存在着
25.(2024·山东青岛一模)互为同分异构体的二元弱酸在催化剂作用下的相互转化可表示为 (无催化剂不考虑转化)。常温下,催化剂存在时,调节0.1ml⋅L-1H2A溶液的pH(催化剂自身对pH无影响),H2B、HB-、B2-的平衡分布系数变化如图。例如H2B的分布系数为。下列说法正确的是
A.无催化剂存在时,NaHB溶液显碱性
B.有催化剂存在且pH=3.6时,
C.,
D.Na2A溶液中加入催化剂后,溶液碱性增强
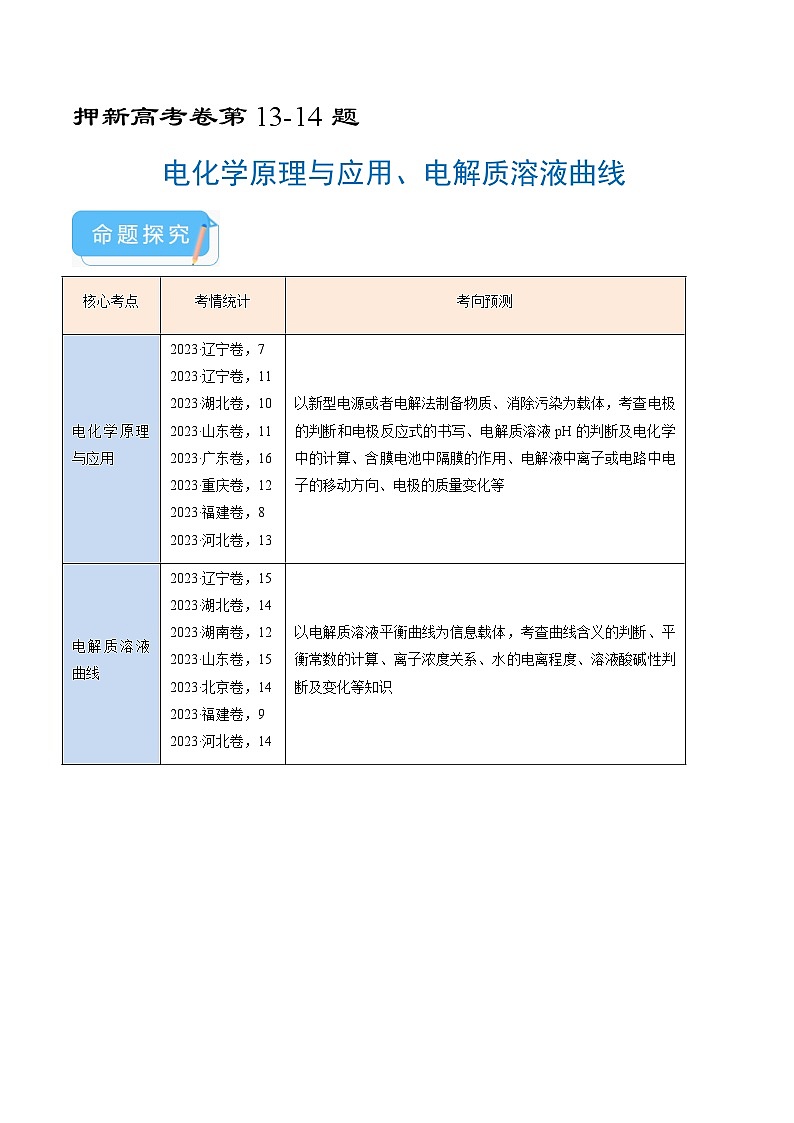
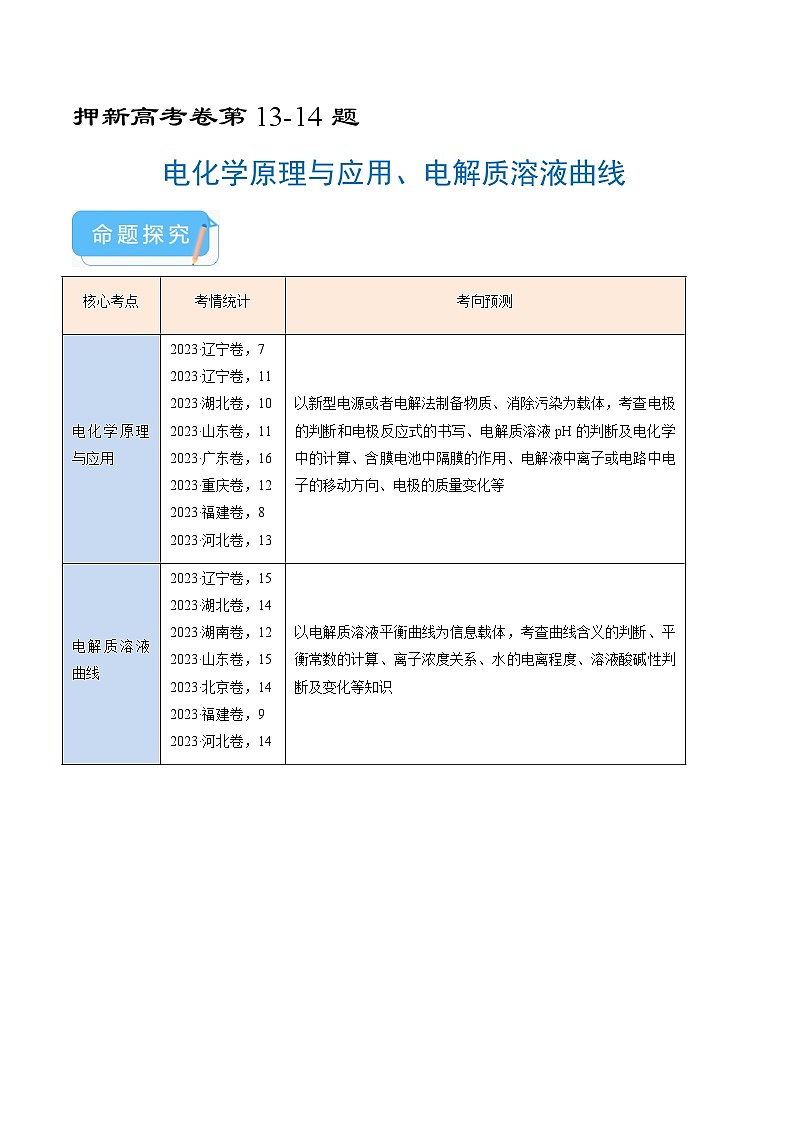
核心考点
考情统计
考向预测
电化学原理与应用
2023·辽宁卷,7
2023·辽宁卷,11
2023·湖北卷,10
2023·山东卷,11
2023·广东卷,16
2023·重庆卷,12
2023·福建卷,8
2023·河北卷,13
以新型电源或者电解法制备物质、消除污染为载体,考查电极的判断和电极反应式的书写、电解质溶液pH的判断及电化学中的计算、含膜电池中隔膜的作用、电解液中离子或电路中电子的移动方向、电极的质量变化等
电解质溶液曲线
2023·辽宁卷,15
2023·湖北卷,14
2023·湖南卷,12
2023·山东卷,15
2023·北京卷,14
2023·福建卷,9
2023·河北卷,14
以电解质溶液平衡曲线为信息载体,考查曲线含义的判断、平衡常数的计算、离子浓度关系、水的电离程度、溶液酸碱性判断及变化等知识
单一溶液
酸或碱溶液——考虑电离
盐溶液——考虑水解
混合溶液
不反应
同时考虑电离和水解
反应
不过量
生成酸或碱——考虑电离
生成盐——考虑水解
过量
根据过量程度考虑电离或水解
不同溶液中某离子浓度的变化
若其他离子能促进该离子的水解,则该离子浓度减小,若抑制其水解,则该离子浓度增大
不同温度下水溶液中c(H+)与c(OH-)的变化曲线
常温下,CaSO4在水中的沉淀溶解平衡曲线(Ksp=9×10-6)
①A、C、B三点均为中性,温度依次升高,Kw依次增大
②D点为酸性溶液,E点为碱性溶液,Kw=1×10-14
③直线AB的左上方均为碱性溶液,任意一点:c(H+)Ksp,将会有沉淀生成
③d点在曲线的下方,Q
相关试卷
这是一份(江苏版)新高考化学三轮冲刺强化练习 第16题 化学实验综合(2份打包,原卷版+解析版),文件包含江苏版新高考化学三轮冲刺强化练习第16题化学实验综合原卷版docx、江苏版新高考化学三轮冲刺强化练习第16题化学实验综合解析版docx等2份试卷配套教学资源,其中试卷共66页, 欢迎下载使用。
这是一份(江苏版)新高考化学三轮冲刺强化练习 第12题 电解质溶液综合选择题(2份打包,原卷版+解析版),文件包含江苏版新高考化学三轮冲刺强化练习第12题电解质溶液综合选择题原卷版docx、江苏版新高考化学三轮冲刺强化练习第12题电解质溶液综合选择题解析版docx等2份试卷配套教学资源,其中试卷共33页, 欢迎下载使用。
这是一份(江苏版)新高考化学三轮冲刺强化练习 第10题 反应原理小综合(2份打包,原卷版+解析版),文件包含江苏版新高考化学三轮冲刺强化练习第10题反应原理小综合原卷版docx、江苏版新高考化学三轮冲刺强化练习第10题反应原理小综合解析版docx等2份试卷配套教学资源,其中试卷共25页, 欢迎下载使用。









