



新高考化学三轮复习考前冲刺练习易错专题07 原子结构和分子结构(2份打包,原卷版+解析版)
展开►易错点二 分子结构与性质
典例精讲
易错点一 原子结构与性质
【易错典例】
例1(1)基态Ge原子的核外电子排布式为[Ar]_______,有__个未成对电子。光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是________________。
(2)镍元素基态原子的电子排布式为________,3d能级上的未成对电子数为________。元素铜与镍的第二电离能分别为:ICu=1 958 kJ·ml-1、INi=1 753 kJ·ml-1,ICu>INi的原因是_______________。
(3)写出基态As原子的核外电子排布式_________________。根据元素周期律,原子半径Ga________As,第一电离能Ga________As(填“大于”或“小于”)。
【答案】(1)3d104s24p2 ;2;O>Ge>Zn(2)1s22s22p63s23p63d84s2或[Ar] 3d84s2 ;2;金属;铜失去的是全充满的3d10电子,镍失去的是4s1电子(3)1s22s22p63s23p63d104s24p3或[Ar]3d104s24p3 ;大于;小于
【解析】(1)Ge是32号元素,与碳元素是同一主族的元素,在元素周期表中位于第四周期 = 4 \* ROMAN IVA族;基态Ge原子的核外电子排布式为[Ar] 4s24p2,也可写为3d104s24p2;在其原子的最外层的2个4s电子是成对电子,位于4s轨道,2个4p电子分别位于2个不同的4p轨道上,所以基态Ge原子有2个未成对的电子;光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。元素的非金属性越强,其吸引电子的能力就越强,元素的电负性就越大。元素Zn、Ge、O的非金属性强弱顺序是:O>Ge>Zn,所以这三种元素的电负性由大至小的顺序是O>Ge>Zn 。(2)镍是28号元素,位于第四周期,第Ⅷ族,根据核外电子排布规则,其基态原子的电子排布式为1s22s2 2p63s23p63d84s2,3d能级有5个轨道,先占满5个自旋方向相同的电子,剩余3个电子再分别占据三个轨道,电子自旋方向相反,所以未成对的电子数为2;铜失去的是全充满的3d10电子,镍失去的是4s1电子,所以ICu>INi。(3)As的原子序数是33,则基态As原子的核外电子排布式为1s22s22p63s23p63d104s24p3;同周期自左向右原子半径逐渐减下,则原子半径Ga大于As,由于As的4p轨道电子处于半充满状态,稳定性强,所以第一电离能Ga小于As。
【解题必备】
原子结构与性质在高考中常见的命题角度有原子核外电子的排布规律及其表示方法、原子结构与元素电离能和电负性的关系及其应用。在高考试题中,各考查点相对独立,难度不大。试题侧重原子核外电子排布式或轨道表示式,未成对电子数判断,电负性、电离能、原子半径和元素金属性与非金属性比较的考查。高考中考查点主要集中在电子排布的书写及电离能、电负性大小比较上,所以在书写基态原子电子排布时,应避免违反能量最低原理、泡利原理、洪特规则及特例;还需注意同能级的轨道半充满、全充满或全空状态的原子结构稳定如Cr:3d54s1、Mn:3d54s2、Cu:3d104s1、Zn:3d104s2;另外需理解电离能与金属性及金属元素价态的关系,电负性与非金属性及组成化合物所形成的化学键的关系。
(1)第四周期元素原子或离子电子排布式的书写:原子结构的考查,应注意看清是原子的电子排布式、离子的电子排布式、价电子排布式还是电子排布图等。第四周期的元素从K开始数,数到几,外围电子数就是几,例如Fe,从钾开始数到铁为8,其电子排布式为[Ar]3d64s2;Se,从钾开始数到Se为16,其电子排布式为[Ar]3d104s24p4。
(2)常见元素的第一电离能和电负性大小比较:第一电离能的考查,特别注意第ⅡA和ⅤA族的特殊性。在元素周期表中,元素的第一电离能从左到右有增大的趋势,从上往下逐渐减小、电负性从左到右逐渐增大,从上往下逐渐减小;同周期主族元素,第ⅡA族(ns2)全充满、ⅤA族(np3)半充满,比较稳定,所以其第一电离能大于同周期相邻的ⅢA和ⅥA族元素。注意常常应用化合价及物质类别判断电负性的大小,如HClO中Cl为+1价、O为-2价,可知O的电负性大于Cl。
【变式突破】
1. (1)C、N、O、Al、Si、Cu是常见的六种元素。
①Si位于元素周期表第______周期第______族。
②N的基态原子核外电子排布式为______;Cu的基态原子最外层有______个电子。
③用“>”或“<”填空:
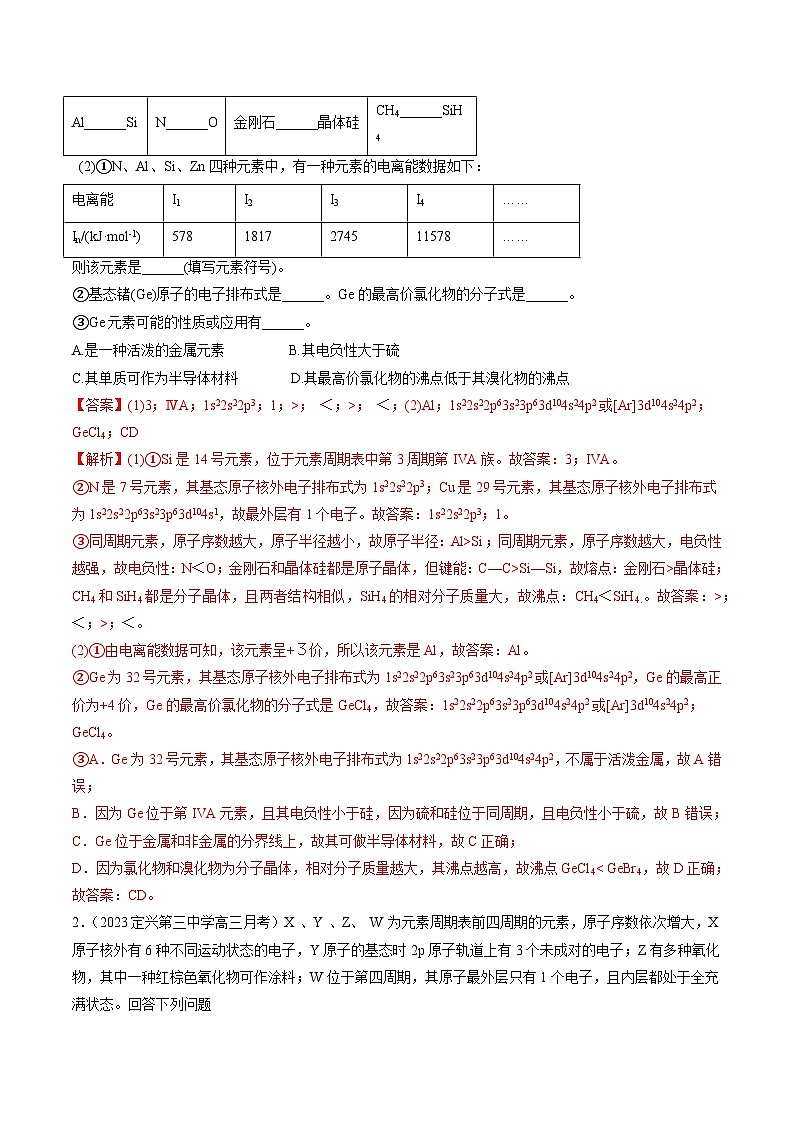
(2)①N、Al、Si、Zn四种元素中,有一种元素的电离能数据如下:
则该元素是______(填写元素符号)。
②基态锗(Ge)原子的电子排布式是______。Ge的最高价氯化物的分子式是______。
③Ge元素可能的性质或应用有______。
A.是一种活泼的金属元素 B.其电负性大于硫
C.其单质可作为半导体材料 D.其最高价氯化物的沸点低于其溴化物的沸点
【答案】(1)3;ⅣA;1s22s22p3;1;>; <;>; <;(2)Al;1s22s22p63s23p63d104s24p2或[Ar]3d104s24p2;GeCl4;CD
【解析】(1)①Si是14号元素,位于元素周期表中第3周期第IVA族。故答案:3;IVA。
②N是7号元素,其基态原子核外电子排布式为1s22s22p3;Cu是29号元素,其基态原子核外电子排布式为1s22s22p63s23p63d104s1,故最外层有1个电子。故答案:1s22s22p3;1。
③同周期元素,原子序数越大,原子半径越小,故原子半径:Al>Si;同周期元素,原子序数越大,电负性越强,故电负性:N<O;金刚石和晶体硅都是原子晶体,但键能:C—C>Si—Si,故熔点:金刚石>晶体硅;CH4和SiH4都是分子晶体,且两者结构相似,SiH4的相对分子质量大,故沸点:CH4<SiH4.。故答案:>;<;>;<。
(2)①由电离能数据可知,该元素呈+3价,所以该元素是Al,故答案:Al。
②Ge为32号元素,其基态原子核外电子排布式为1s22s22p63s23p63d104s24p2或[Ar]3d104s24p2,Ge的最高正价为+4价,Ge的最高价氯化物的分子式是GeCl4,故答案:1s22s22p63s23p63d104s24p2或[Ar]3d104s24p2;GeCl4。
③A.Ge为32号元素,其基态原子核外电子排布式为1s22s22p63s23p63d104s24p2,不属于活泼金属,故A错误;
B.因为Ge位于第IVA元素,且其电负性小于硅,因为硫和硅位于同周期,且电负性小于硫,故B错误;
C.Ge位于金属和非金属的分界线上,故其可做半导体材料,故C正确;
D.因为氯化物和溴化物为分子晶体,相对分子质量越大,其沸点越高,故沸点GeCl4< GeBr4,故D正确;
故答案:CD。
2.(2023定兴第三中学高三月考)X 、Y 、Z、 W 为元素周期表前四周期的元素,原子序数依次增大,X原子核外有6种不同运动状态的电子,Y原子的基态时2p原子轨道上有3个未成对的电子;Z有多种氧化物,其中一种红棕色氧化物可作涂料;W位于第四周期,其原子最外层只有1个电子,且内层都处于全充满状态。回答下列问题
(1)X 在元素周期表中的位置是:___________;Y的最高价氧化物对应水化物与Y的最简单气态氢化物反应的化学方程式:___________。
(2)X、Y最简单气态氢化物的稳定性:X ___________Y(填“大于”或“小于”)。
(3)Z原子核外电子排布式为:___________。
(4)W位于元素周期表的___________区,与W处于同一周期且最外层电子数相同的元素的基态原子共有___________种、这些元素分别为___________(填元素符号)。
(5)在发生焰色反应时,W的4s电子会跃迁到4p轨道,写出此激发态W原子的价层电子排布式: ___________。
(6)与钛位于同一周期且含有相同未成对电子数的过渡元素为___________ (填元素符号)
(7)基态砷原子N电子层中的成对电子与单电子的数量比为___________。
【答案】(1)第二周期IVA族;HNO3+NH3 = NH4NO3(2)小于(3)1s22s22p63s23p63d64s2或[Ar] d64s2(4)ds;2;K、Cr(5)3d10 4p1(6)Ni(7)2:3
【解析】X原子核外有6种不同运动状态的电子,则是碳元素,Y原子的基态时2p原子轨道上有3个未成对的电子,是氮元素;Z有多种氧化物,其中一种红棕色氧化物可作涂料是氧化铁,则Z是铁元素;W位于第四周期,其原子最外层只有1个电子,且内层都处于全充满状态,符合条件的是铜元素。
(1)X 是碳元素,其在元素周期表中的位置是:第二周期IVA;Y的最高价氧化物对应水化物是硝酸,Y的最简单气态氢化物是氨气,两者反应的化学方程式:HNO3+NH3 = NH4NO3;
(2)X、Y最简单气态氢化物分别是甲烷、氨气,非金属性越强气态氢化物越稳定,氮元素的非金属性大于碳元素,则它们的稳定性:X大于Y;
(3)Z是铁元素,其原子核外电子排布式为:1s22s22p63s23p63d64s2或[Ar] d64s2;
(4)W是铜元素,位于元素周期表的ds 区,与W处于同一周期且最外层电子数相同的元素的基态原子共有两种、这些元素分别为K 、Cr;
(5)在发生焰色反应时,W的4s电子会跃迁到4p轨道,写出此激发态W原子的价层电子排布式:3d10 4p1;
(6)与钛位于同一周期即是第四周期,钛元素含有的未成对电子数是两个,则同周期且含有相同未成对电子数的过渡元素为Ni ;
(7)基态砷原子价电子排布式是4s24p3,则N电子层中的成对电子与单电子的数量比为2:3。
易错点二 分子结构与性质
【易错典例】
例2(1)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键。从原子结构角度分析,原因是_______________。Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为________________________,微粒之间存在的作用力是________________。比较下列锗卤化物的熔点和沸点,分析其变化规律及原因_____________________。
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。[Ni(NH3)6]SO4中阴离子的立体构型是________。在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为________,提供孤电子对的成键原子是________。氨的沸点________(填“高于”或“低于”)膦(PH3),原因是________;氨是________分子(填“极性”或“非极性”),中心原子的轨道杂化类型为________。
(3)AsCl3分子的立体构型为________,其中As的杂化轨道类型为________。
【答案】(1)Ge原子半径大,原子间形成的σ单键较长,p-p轨道肩并肩重叠程度很小或几乎不能重叠,难以形成π键; QUOTE sp3 ;共价键;GeCl4、GeBr4、GeI4的熔、沸点依次增高。原因是分子结构相似,分子量依次增大,分子间相互作用力逐渐增强(2)正四面体;配位键;N;高于;NH3分子间可形成氢键;极性;sp3(3)三角锥形;sp3
【解析】1)Ge与C是同族元素,C原子原子半径较小,原子之间可以形成双键、三键;但Ge原子之间难以形成双键或三键,从原子结构角度分析,这是由于锗的原子半径大,原子之间形成的ρ单键较长,p-p轨道肩并肩重叠的程度很小或几乎不能重叠,难以形成π
键;Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为1个s轨道与3个p轨道进行的sp3 QUOTE 杂化;由于是同一元素的原子通过共用电子对结合,所以微粒之间存在的作用力是非极性共价键(或写为共价键);锗元素的卤化物在固态时都为分子晶体,分子之间通过微弱的分子间作用力结合。对于组成和结构相似的物质来说,相对分子质量越大,分子间作用力越大,熔沸点越高。由于相对分子质量:GeCl4<GeBr4<GeI4,所以它们的熔沸点由低到高的顺序是:GeCl4<GeBr4<GeI4。(2)根据价层电子对互斥理论,SO42-的σ键电子对数等于4,孤电子对数为(6+2-2×4)÷2=0,则阴离子的立体构型是正四面体形;根据配位键的特点,在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为配位键,提供孤电子对的成键原子是N;氨分子间存在氢键,分子间作用力强,所以氨的沸点高于膦(PH3);根据价层电子对互斥理论,氨中心原子N的σ键电子对数等于3,孤电子对数为(5-3)÷2=1,则中心原子是sp3杂化,分子成三角锥形,正负电荷重心不重叠,氨是极性分子。(3)AsCl3分子的价层电子对数=3+=4,即含有一对孤对电子,所以立体构型为三角锥形,其中As的杂化轨道类型为sp3。
【解题必备】
在高考中的常见命题角度有围绕某物质判断共价键的类型和数目、分子的极性、中心原子的杂化方式、微粒的立体构型、氢键的形成及对物质的性质影响等,考查角度较多,但各个角度独立性大,难度不大。
(1)σ键和π键的判断方法:有些题目常考查物质所含σ键和π键,需正确书写物质的结构式进行分析。单键均为σ键,双键、三键中只有一个为σ键,其余为π键。共价单键全为σ键,双键中有一个σ键和一个π键,三键中有一个σ键和两个π键。
(2) 分子或离子中中心原子的杂化轨道类型的判断方法:看中心原子有没有形成双键或三键。如果有1个三键,则其中有2个π键,用去了2个p轨道,则为sp杂化,如果有1个双键则其中有1个π键,则为sp2杂化,如果全部是单键,则为sp3杂化;由分子的空间构型结合价电子对互斥理论判断,没有填充电子的空轨道一般不参与杂化,1对孤电子对占据1个杂化轨道。如NH3为三角锥形,且有一对孤电子对,即4条杂化轨道应呈正四面体形,为sp3杂化。分子中心原子的杂化方式CH4:sp3;NH3:sp3;H2O:sp3;(金刚石):sp3;(单层石墨):sp2;CH3CHO中甲基碳:sp3;醛基碳:sp2;BCl3:sp2;NCl3:sp3;CH3OH中C原子:sp3;HC≡CH中C原子:sp
(3)常见杂化轨道类型与分子构型如下:
(4) 分子组成和分子极性的关系:对于ABm型分子,A为中心原子,若A上有未成键电子对(孤对电子),则ABm分子为极性分子,如H2O、NH3中O、N上分别有2对、1对孤对电子;若A上无未成键电子对(孤对电子),则ABm分子为非极性分子,如CH4、CO2、BF3中C、C、B上均无孤对电子;多原子分子中,若中心原子的化合价的绝对值等于该元素的价电子数(最高正价)时,该分子为非极性分子。
(5)等电子原理:运用等电子体知识,理解物质中原子的杂化方式和空间结构,以及电子式的书写方法等。
(6)影响分子中键角大小的因素
①中心原子杂化类式是决定键角大小的最根本的原因,如CH4、BF3、CO2这一分子序列,中心原子分别为sp3、sp2和sp杂化,它们对应的键角为109°28′、120°、180°,键角会依次增大。
②由于中心原子的孤对电子对成键电子对有较大的排斥力,所以孤对电子能使成键电子对彼此离得更近,键角被压缩而变小,且中心原子的孤电子对数越多,键角会变得越小,如H2O、NH3、CH4分子系列。这3个分子的中心原子采取的都是sp3杂化,但孤电子对数不同。其孤电子对数分别为2、1、0,在H2O分子中,键角要受2个孤电子对的压缩,键角应该会最小。
③当同一种原子中心原子种类相同、杂化类型也相同,而配原子种类不同时,由于配原子的电负性不同,会使键角有区别,因为当相邻的两个成键电子对更靠近中心原子时、相互间的斥力会增大。反之,当相邻的两个成键电子对远离近中心原子时、相互间的斥力会变小。如NF3与NH3的中心原子都是N原子、且都为sp3杂化,但因为F原子的电负性大于H原子,使成键电子离N原子更远,两个N-F键间的斥力减小、可以靠的更近,所以其键角更小。
④当同主族中心原子种类不同,但杂化类型相同、且配原子种类相同时,中心原子的电负性大,成键电子对更靠近中心原子,成键电子对间的斥力要变大,键角要变大。反之,中心原子电负性小的分子,成键电子对要远离中心原子,成键电子对间的斥力要变小,键角要变小。如H2O与H2S中O与S原子都采取了sp3杂化,都有2个孤电子对,但O原子的电负性大,键角应该H2O比H2S中的键角大。
⑤在同一个分子中,与单键相比较重键的成键电子数目要多一些,对另一单键电子对的斥力也要更大些。重键的存在,可使其相邻的由单键组成的键角变小。如在COCl2分子中,C原子为sp2杂化,虽然等性sp2杂化的键角是120°,但由于C原子与O原子间以双键C=O结合,该双键对C-Cl键的斥力要更大些。所以。∠O-C-Cl键角要大于∠Cl-C-Cl键角。
⑥当配体基团的体积较大时,基团电子云占据的空间也会相应增大,对相邻的键也会有很强的排斥作用。如NH3、NH2OH、NH2(CH3)的∠H-N-H键角依次减小,而NF3与NF2(CH3)也是后者的∠F-N-F键角更小。
【变式突破】
3. (1)6氨基青霉烷酸结构中S原子的杂化方式是________,组成中C、N、O三种元素的第一电离能由大到小的顺序是_______________。
(2)在硼酸[B(OH)3]分子中,B原子与3个羟基相连,B原子杂化轨道的类型是______杂化;NOeq \\al(+,2)的构型为______,氮的杂化方式为______杂化。
(3)H2SeO3的中心原子杂化类型是 ,SeO32-的立体构型是 ,与SeO32-互为等电体的分子有 (写一种物质的化学式即可)。
(4)B(OCH3)3中B采用的杂化类型是____________。写出两个与B(OCH3)3具有相同空间构型的分子或离子__________。
(5)松脂酸铜中π键的个数____;加“*”碳原子的杂化方式为__________________。
【答案】(1)sp3 N>O>C(2)sp2 sp 直线形(3)sp3 三角锥形 PCl3(4)sp2 SO3、COeq \\al(2-,3)(其他合理答案均可)(5)6 sp3
【解析】(4)B(OCH3)3中B最外层有3个电子,采用的轨道杂化类型是sp2,发生sp2 杂化的分子或离子有 SO3、COeq \\al(2-,3)。(5)一个碳碳双键或碳氧双键含有一个π键,1个松脂酸铜的结构单元中含有三个双键,因此一个松脂酸铜含有六个π键。加“*”碳原子形成四个单键,需要四个杂化轨道,因此该碳原子的杂化方式为sp3。
4. (1)X、Y两者物理性质有差异的主要原因是__________。
(2) CO(NH2)2分子中C原子的杂化方式为_____,1 ml 该分子中σ键的数目为__________,该物质易溶于水的主要原因是_______________________________________________。
(3)F2与其他卤素单质反应可以形成卤素互化物,例如ClF3、BrF3等。已知反应Cl2(g)+3F2(g)===2ClF3(g) ΔH=-313 kJ·ml-1,F—F键的键能为159 kJ·ml-1,Cl—Cl键的键能为242 kJ·ml-1,则ClF3中Cl—F键的平均键能为________kJ·ml-1。ClF3的熔、沸点比BrF3的________(填“高”或“低”)。
(4)一定条件下,CH4、CO2都能与H2O形成笼状结构(如下图所示)的水合物晶体,其相关参数见下表。CH4与H2O形成的水合物晶体俗称“可燃冰”。
“可燃冰”中分子间存在的2种作用力是________。为开采深海海底的“可燃冰”,有科学家提出用CO2置换CH4的设想。已知上图中笼状结构的空腔直径为0.586 nm,根据下述图表,从物质结构及性质的角度分析,该设想的依据是______________________。
(5)维生素B1的结构式如图,晶体溶于水的过程中要克服的微粒间作用力有________。
【答案】(1)N、O、F X物质形成分子内氢键,Y物质形成分子间氢键,分子间氢键使分子间作用力增大(2)sp2 7NA CO(NH2)2分子与水分子之间能形成氢键(3)172 低(4)氢键、范德华力 CO2的分子直径小于笼状结构空腔直径,且与H2O的结合能大于CH4(5)离子键、氢键、范德华力
【解析】设Cl—F键的平均键能为x。根据反应的焓变=反应物的键能总和-生成物的键能总和可知,Cl2(g)+3F2(g)===2ClF3(g)的ΔH=242 kJ·ml-1+159 kJ·ml-1×3-6x=-313 kJ·ml-1,则x=172 kJ·ml-1。ClF3和BrF3为结构相似的分子晶体,相对分子质量越大,其熔、沸点越高,因ClF3的相对分子质量小于BrF3,故ClF3的熔、沸点低于BrF3。(4)可燃冰中存在分子间作用力即范德华力,另外水分子间还存在氢键。分子与H2O的结合能越大表明越容易与H2O结合。
考点精练
1.(2024·山西晋中·二模)已知反应。设为阿伏加德罗常数的值,下列说法错误的是
A.的空间构型为直线形B.电负性:
C.在熔融状态下均可导电D.冰中含有氢键数目为
2.(2024·湖北·三模)下列比较中前者大于后者的是
A.由镁原子核形成的微粒电离一个电子所需最低能量:与
B.基态氟原子:未成对电子数与成对电子数
C.H-O-H键角:与
D.分子的极性:与HCN
3.(2024·江西萍乡·二模)氧化二氯(Cl2O)是净化饮用水的一种有效的净水剂,制备反应为,下列说法错误的是
A.Cl2O的结构式为B.键角
C.中心原子的杂化方式为D.Cl2的电子云轮廓图为
4.(2024·重庆·一模)下列关于物质结构和性质的说法正确的是
A.的球棍模型为
B.二氯化二硫的电子式为
C.的模型与空间结构名称均为正四面体形
D.酸性:
5.(2024·云南曲靖·二模)离子液体有独特的优良性能。某离子液体的结构如图所示,下列说法正确的是
A.第一电离能:B.原子的杂化轨道类型均为
C.中所含键的数目为D.最简单氢化物的沸点:
6.(2024·河南·三模)M、N、P、Q、R是原子序数依次增大的前四周期主族元素,组成的化合物R4N(PM4)4Q2是某种荧光粉中的成分。M的一种单质是极性分子,N基态原子核外无未成对电子,P元素存在于航空、信息和新能源等高技术领域必需的材料中,Q是一种重要的成盐元素。下列说法错误的是
A.N、Q、R三种元素简单离子的半径:Q>R>N
B.N、P、Q、R四种元素的第一电离能:Q>P>N>R
C.M元素与氢元素形成的两种微粒的键角:
D.N、P、R三种氧化物的熔点:P>R>N
7.(2024·山西晋中·二模)如图所示的两种物质,是冠醚、是稳定的超分子。下列说法正确的是
A.基态氧原子价层电子排布图为B.进入W空腔中也可形成稳定的超分子
C.W、M中的碳原子均为杂化D.中存在离子键和共价键
8.(2024·北京东城·一模)下列对事实的分析正确的是
9.(2024·河北·二模)吲哚(化合物Z)主要用作香料、染料、氨基酸、农药的原料。以邻硝基苯甲醇(化合物X)为原料合成吲哚的反应如下:
下列说法正确的是
A.基态原子未成对电子数:
B.X分子间、Y分子间、Z分子间均不存在氢键
C.基态原子的简化电子排布式为
D.分子中原子和原子都是杂化
10.(2024·广西·二模)W、X、Y、Z、Q是原子序数依次增大的短周期主族元素,分别占据三个不同的周期。X的一种简单氢化物常用作制冷剂,Y在地壳中含量最高,Z的基态原子价层电子排布式为ns1,Q的基态原子轨道中有2个未成对电子。下列说法错误的是
A.原子半径:Z>Q>W
B.第一电离能:X>Y>Z
C.Q的最高价氧化物对应的水化物可能是强酸
D.X、Y最简单氢化物的稳定性:X>Y
11.(2024·江西萍乡·二模)X、Y、Z、W、Q为原子半径依次增大的短周期主族元素,基态Y原子核外电子排布的L层中只有两对成对电子,基态W原子核外s能级和p能级电子数相等,基态Z原子核外电子的空间运动状态数比基态W原子多2。下列说法一定正确的是
A.第一电离能:W>Z>Q
B.Q与X形成的化合物一定是离子化合物
C.工业上通过电解W和Y形成的化合物来制得W单质
D.元素电负性:X>Y>Z
12.(2024·河北邢台·一模)某离子液体,由原子序数依次增大的短周期主族元素X、Y、Z、W组成,其结构如图,X、Y元素的原子序数之和与Z元素的相等,Y的最外层电子数是内层电子总数的2倍,W的单质可用于自来水的消毒,下列说法正确的是
A.第一电离能:
B.Y、W组成的化合物易溶于水
C.最简单氢化物的键角:
D.的最高价氧化物的水化物为强酸
13.(2024·海南·一模)锌在工业中有重要作用,也是人体必须的微量元素。人体内碳酸酐酶可以使CO2水合和脱水反应速率分别加快13000和25000倍。碳酸酐酶的部分结构如图所示:
回答下列问题:
(1)Zn基态原子核外电子排布式 。
(2)碳酸酐酶的部分结构中与Zn2+配位的原子是 (填元素符号),该物质中碳原子的轨道杂化类型是 ,碳酸酐酶中H—O—H键角比H2O中H—O—H键角 (填“大于”“小于”或“等于”)。
(3)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成,第二电离能I2(Zn) I2(Cu)(填“大于”或“小于”),原因是 。
(4)硒化锌是一种重要的半导体材料,其晶胞结构如图1所示。
①与原子距离最近且等距离的的个数为 。
②1号原子的坐标为,图2是晶胞沿z轴的投影图,2号原子的坐标为 。
③晶胞中距离最近的两个Se的距离为a nm,设为阿伏加德罗常数的值,该晶体密度为 。
14.(2024·陕西西安·一模)镓、铟都是典型的稀有分散元素。回答下列问题:
(1)基态原子的核外价电子排布式为 ,最高能级电子的电子云形状为 。
(2)一种含镓药物的合成方法如图所示:
①化合物Ⅰ中环上原子的杂化方式为 ,化合物中含有的键的物质的量为 。化合物Ⅰ中所含元素的电负性由大到小的顺序为 (用元素符号表示)。
②化合物Ⅱ中的配位数为 , 。
(3)一种由组成的晶体属四方晶系,晶胞棱边夹角均为,其晶胞结构如图。
①A点、B点原子的分数坐标分别为。则C点原子的分数坐标为 。
②表示阿伏加德罗常数的值,该晶体的密度为 (用含的代数式表示)。
15.(2024·内蒙古呼和浩特·二模)硒(Se是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光(AIE)效应以来,AIE在发光材料、生物医学等领域引起广泛关注。一种含Se的新型AIE分子的合成路线如下:
回答下列问题:
(1)基态硒原子的价电子排布式为 。
(2)比较沸点 (填“>”或“<”),并解释原因 。
(3)关于Ⅰ~Ⅳ物质,下列说法正确的有
A.Ⅰ中Se原子为杂化,碳原子不都是杂化
B.Ⅱ是由极性键和非极性键组成的弱极性分子
C.Ⅲ含有的所有元素中,O的电负性最大
D.Ⅳ中含有2个手性碳原子
(4)分子Ⅲ的价电子中,有 ml孤电子对。
(5)适量的硒酸钠可减轻重金属铊引起的中毒,的立体构型为 。结合无机含氧酸的酸性变化规律,比较酸性: (填“>”或“<”)。
(6)由铁、钾、硒形成的一种超导材料,其晶胞结构如图1所示。
①该晶胞在xy平面投影如图2所示,在晶体中,每个Fe周围紧邻的Se有 个。
②该晶胞参数、,该晶体密度 。(用表示阿伏加德罗常数,写出计算表达式即可)
16.(2024·陕西·二模)铜及其化合物在生活、生产中用途广泛。以黄铜矿为原料冶炼铜涉及多个反应,其中一个反应为。回答下列问题:
(1)基态铜原子的价层电子的轨道表示式(电子排布图)为 ,基态铜原子核外电子的空间运动状态(原子轨道)有 种。
(2)高温下CuO能转化为的原因是 (从原子结构角度分析)。
(3)、、、四种含硫微粒中,中心原子为杂化的是 ,属于极性分子的是 ,、、、四种含硫微粒的空间结构分别为 、 、 、 。
(4)、FeO的熔点是下列两个数值中的一个:1360℃、1565℃。、FeO两种氧化物的晶体类型都是 ,1360℃是 的熔点。
(5)晶体的晶胞结构如图1所示。晶胞中Fe的投影位置如图2所示。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标,例如图1中原子1(硫原子)的分数坐标为,则原子2(铁原子)的分数坐标为 。晶胞参数分别为a pm,a pm、2a pm,晶体的密度为 (列出计算表达式,设阿伏加德罗常数的值为)。
参考答案
1.A【解析】A.中氧原子形成了2个键,另外还有2对㧓电子对,的空间构型为形,项错误;
B.同周期元素,从左往右电负性逐渐增大,同族元素,从上到下电负性逐渐减小,电负性:,B项正确;
C.均是离子化合物,熔融状态下均可导电,C项正确;
D.冰中每个水分子与另外4个水分子形成4个氢键,故冰中含有氢键数目为,D项正确;
故选A。
2.A【解析】A.激发态Mg原子不稳定,容易失去电子,且基态Mg原子失去一个电子是镁的第二电离能,第二电离能大于第一电离能,故电离所需能量大于,A正确;
B.基态氟原子未成对电子数有1个,成对电子数大于1,故B错误;
C.在与中,中心原子都采用sp3杂化。分子中有两对孤电子对,而中只有一对孤电子对。由于孤电子对之间的排斥力随着孤电子对数量的减少而减小,因此中的H-O-H键角会比中的H-O-H键角大,C错误;
D.白磷分子的构型是正四面体,四个磷原子位于正四面体的四个顶点上,这种结构是对称的,分子是非极性分子,HCN是极性分子,D错误;
故选A。
3.B【解析】A.Cl2O分子中,中心O原子的价层电子对数为4,发生sp3杂化,其最外层还有2个孤电子对,则结构式为,A正确;
B.中,中心原子的价层电子对数都为4,都发生sp3杂化,但Cl原子吸引共用电子对的能力比H强,S原子吸收共用电子对的能力比O弱,则共用电子对最靠近H2O中的O原子,成键电子对间的排斥作用最大,键角最大,所以键角、,B错误;
C.中心C原子的价层电子对数为=3,发生杂化方式为,C正确;
D.形成Cl2时,两个Cl原子发生3p电子云的重叠,p电子云呈哑铃形,则电子云轮廓图为,D正确;
故选B。
4.D【解析】A.中C原子是sp3杂化,空间构型为四面体形,氯原子半径大于氢原子半径,球棍模型为:,A错误;
B.二氯化二硫是共价化合物,电子式为:,B错误;
C.离子中一个硫原子相当于氧原子﹐中心硫原子孤电子对数为=0,价层电子数为0+4=4,模型与空间结构名称均为四面体形,C错误;
D.与羧酸(-COOH)相连的C-X(X为卤素原子)的极性越大,羧酸的酸性越大,这是由于元素的非金属性(电负性):F>Cl>H,所以吸引电子对能力F比Cl更强,Cl比H更强,即极性依次减弱,从而使CF3COOH 中的-COOH的羟基H原子具有更大的活性,更容易发生电离,所以酸性:,D正确;
故选D。
5.D【解析】A.同周期元素,从左到右第一电离能呈增大趋势,则氟元素的第一电离能大于氮元素,故A错误;
B.由离子液体的结构可知,饱和氮原子的杂化方式为sp3杂化,双键氮原子的杂化方式为sp2杂化,
C.由离子液体的结构可知,离子中单键为σ键,双键中含有1个σ键和1个π键,则1mlY中所含σ键的数目为1ml×28×NAml—1=28NA,故C错误;
D.氟化氢和氨分子都能形成氢键,氟化氢分子形成的分子间氢键强于氨分子,沸点高于氨分子;磷化氢不能形成分子间氢键,分子间作用力小于氨分子,沸点低于氨分子;磷化氢是极性分子,甲烷是非极性分子,磷化氢的分子间作用力大于甲烷分子,沸点高于甲烷分子,所以最简单氢化物的沸点高低顺序为,故D正确;
故选D。
6.D【分析】已知M、N、P、Q、R是原子序数依次增大的前四周期主族元素;常见的物质中,氧元素的其中一种单质O3是极性分子,故M为O元素;N基态原子核外无未成对的电子,且N的原子序数必须要大于氧元素的原子序数8,故N为Mg元素;P存在于航空、信息和新能源等高技术领域必需的材料中,故P为Si元素;Q是一种重要的成盐元素,故Q为Cl元素;由荧光粉的化学式R4N(PM4)4Q2可知,R显+2价,且为第四周期主族元素,故R为Ca元素;
A.N(Mg)、Q(Cl)、R(Ca)三种元素简单离子的半径由大到小为:Q(Cl-)>R(Ca2+)>N(Mg2+),故A正确;
B.第一电离能由大到小为:Cl>Si>Mg>Ca,即Q>P>N>R,故B正确;
C.H3M+为H3O+,电子式为,中心原子O形成3个σ键,最外层还有一个孤电子对,所以O的价层电子对数=3+1=4,O采取sp3杂化、H3O+为三角锥形;而H2M为H2O,O形成2个σ键,且O的最外层还有2个孤电子对,H2O为V形结构,孤电子对越多,对成键电子排斥作用越强,键角越小,因此H3O+的键角大于H2O,即,故C正确;
D.N、P、R的氧化物分别为MgO(离子晶体)、SiO2(共价晶体)、CaO(离子晶体),且离子半径r(Mg2+)<r(Ca2+),所以几种氧化物的熔点由大到小为SiO2>MgO>CaO,即:P>N>R,故D错误;
故选D。
7.C【解析】A.基态氧原子价层电子2s22p4,排布图为,A项错误;
B.较小许多,无法形成稳定结构,B项错误;
C.中碳原子均形成了4个键,故均为杂化,C项正确;
D.中不存在离子键,D项错误;
故选C。
8.C【解析】A.CH4分子中的中心原子C的价层电子对数为4,无孤电子对,NH3分子中的中心原子N的价层电子对数为4,孤电子对数为1、H2O分子中的中心原子O的价层电子对数为4,孤电子对数为2,由于孤电子对对成键电子对的斥力大于成键电子对对成键电子对的斥力,所以键角大小为,故A错误;
B.P、S位于第二周期,同一周期主族元素,从左往右第一电离能有增大的趋势,但P的3p轨道半充满,比较稳定,其第一电离能高于同周期相邻的两种元素,故B错误;
C.CO和N2结构相似,相对分子质量相等,但CO为极性分子,N2为非极性分子,因此CO的沸点高于N2的沸点,故C正确;
D.F、Cl位于同一主族,同一主族从上到下,原子半径增大,元素非金属性减弱,对应氢化物的稳定性减弱,所以热稳定性:HF>HCl,故D错误;
故答案为:C。
9.D【解析】A.C、N、O的价层电子排布分别为2s22p2、2s22p3、2s22p4,未成对电子数分别为2、3、2,基态原子未成对电子数:,A错误;
B.X分子间、Y分子间均不存在氢键,Z分子含有N-H键,Z分子间存在氢键,B错误;
C.基态原子的简化电子排布式为,C错误;
D.分子中原子和原子周围都是3个σ键,都是杂化,D正确;
故选D。
10.D【分析】W、X、Y、Z、Q是原子序数依次增大的短周期主族元素,分别占据三个不同的周期,故W是H,X的一种简单氢化物常用作制冷剂即氨气,则X为N元素,Y在地壳中含量最高即Y为O元素,Z的基态原子价层电子排布式为ns1,即第IA族,故Z为Na,Q的基态原子轨道中有2个未成对电子,则价电子排布应为3s23p2或3s23p4,故Q 是Si或S;
A.同周期从左至右,原子半径减小,原子半径:Z(Na)>Q(Si或S)>W(H),A正确;
B.同一周期元素,第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族第一电离能大于其相邻元素,则第一电离能X(N)>Y(O)>Z(Na),B正确;
C.Q 是Si或S,最高价氧化物对应的水化物可能是H2SO4为强酸,C正确;
D.同周期主族元素,从左到右非金属性增强,非金属性:Y(O)>X(N),简单气态氢化物的热稳定性:H2O>NH3,D错误;
故选D。
11.B【分析】X、Y、Z、W、Q为原子半径依次增大的短周期主族元素,基态Y原子核外电子排布的L层中只有两对成对电子,Y的电子排布式为1s22s22p4,Y为O元素;基态W原子核外s能级和p能级电子数相等,W的电子排布式为1s22s22p63s2,W为Mg元素;Mg核外电子的空间运动状态有6种,基态Z原子核外电子的空间运动状态数比基态W原子多2,即有8种,Z的电子排布式为1s22s22p63s23p2,Z为Si元素,X的原子半径比O小,可能为F或者H,Q的原子半径比Mg大,为Na。
A.同一周期元素从左到右第一电离能呈增大趋势,故第一电离能:Z>W>Q,故A错误;
B.Na和H、F形成的化合物为NaH、NaF,二者都是离子化合物,故B正确;
C.工业上通过电解Mg和Cl形成的化合物MgCl2来制得Mg单质,故C错误;
D.X如果是H,电负性:O>H>Si,故D错误;
故选B。
12.D【分析】X、Y、Z、W为原子序数依次增大的短周期主族元素,W的单质可用于自来水的消毒,则W为Cl元素;Y的最外层电子数是内层电子总数的2倍,则Y为C元素;离子液体中X、Y、Z形成共价键的数目分别为1、4、3,X、Y元素的原子序数之和与Z元素的相等,则X为H元素、Z为N元素。
A.同周期元素,从左到右第一电离能呈增大趋势,则氮元素的第一电离能大于碳元素,故A错误;
B.四氯化碳是非极性分子,由相似相溶原理可知,四氯化碳难溶于极性分子水,故B错误;
C.甲烷和氨分子中的中心原子均为sp3杂化,甲烷分子的孤对电子数为0、氨分子的孤对电子数为1,孤对电子数越多,对成键电子对的斥力越大,键角越小,所以甲烷分子的键角大于氨分子,故C错误;
D.氯元素的最高价氧化物的水化物是高氯酸,高氯酸为强酸,故D正确;
故选D。
13.(1)[Ar]3dl04s2
(2) O、N sp3、 sp2 大于
(3) 小于 Zn和Cu失去一个电子后的价电子分别为和,Cu失去的第二个电子在3d的全满轨道上,Zn失去的第二个电子在4s半满轨道上,而3d全满比4s半满能量低,结构也更稳定,所以需要更多能量
(4) 4
【解析】(1)锌是30号元素,Zn基态原子核外电子排布式[Ar]3dl04s2。
(2)锌提供空轨道,氮、氧提供孤电子对,则碳酸酐酶的部分结构中与Zn2+配位的原子是O、N,该物质中饱和碳为sp3杂化、双键碳为sp2杂化,故碳原子的轨道杂化类型是sp3、 sp2;碳酸酐酶中氧的1对孤电子对形成配位键,孤电子对与成键电子对间的排斥作用比成键电子对之间的排斥作用强,孤电子对数目越多,对成键电子对的排斥作用越强,键角越小,故H—O—H键角比H2O中H—O—H键角大;
(3)Zn和Cu失去一个电子后的价电子分别为和,Cu失去的第二个电子在3d的全满轨道上,Zn失去的第二个电子在4s半满轨道上,而3d全满比4s半满能量低,结构也更稳定,所以需要更多能量,故第二电离能I2(Zn) 小于I2(Cu);
(4)①由晶胞结构可知,与原子距离最近且等距离的的个数为4;
②1号原子的坐标为号原子的坐标为,图2是晶胞沿轴的投影图,则2号原子在xyz轴上的投影坐标分别为、、,故其坐标为;
③晶胞中距离最近的两个Se的距离为面对角线的二分之一为a nm,则晶胞边长为,该晶胞中,位于晶胞内部的Zn原子个数为4,位于顶点和面心的Se原子个数为,则。
14.(1) 哑铃形(或纺锤形)
(2) 6 1
(3)
【解析】(1)Ga为31号元素,则基态原子的核外价电子排布式为;最高能级为4p能级,其电子云形状为哑铃形(或纺锤形);
(2)①吡啶环的结构与苯环相似,故C原子采用杂化;化合物Ⅰ除了环上6个键,其他键如图所示:
,1 ml化合物Ⅰ中总共有17 ml键;Ⅰ中含有四种元素O、N、C、H,同周期元素,从左到有,半径减小,电负性增大,所以电负性由大到小的顺序为O>N>C>H;
②化合物Ⅱ中Ga的配位数为6,其中4个COOH失去H后显-1,化合物Ⅱ整体带1单位负电荷,所以;
(3)①由位于顶点A点和体心B点原子的分数坐标分别为:(0,0,0)、(,,),可知C点的Z轴坐标为,x、y轴的坐标都是,则C点的分数坐标为:();
②由晶胞结构可知,铟原子形成的四面体空隙有8个,形成的八面体空隙也有8个,则四面体空隙的占有率为,晶胞中位于顶点、面上和体内的铜原子个数为,位于棱上、面心和面上的铟原子个数为,位于体内的碲原子个数为8,则铜、铟、碲的原子个数为4∶4∶8=1∶1∶2,晶体的化学式为CuInTe2,该晶体的密度=。
15.(1)
(2) > 二者均为分子晶体,相对分子质量更大,分子间作用力更大,沸点更高
(3)BC
(4)6
(5) 正四面体 <
(6) 4
【解析】(1)Se元素为第四周期元素第VIA族元素,因此基态硒原子价电子排布式为4s24p4;
(2)H2Se和H2S两者都是分子晶体,由于分子间都不能形成氢键,比较沸点直接看他们的相对分子量大小,故沸点:H2Se>H2S,因为二者均为分子晶体,H2Se相对分子质量更大,分子间作用力更大,沸点更高;
(3)A.I中有苯环,苯环中C原子一定是sp2杂化,故A错误;
B.Ⅱ中碳碳之间为非极性键,碳氢之间为极性键,物质类别属于烃类,难溶于水,极性较小,故B正确;
C.根据同周期从左到右电负性逐渐增大,同主族从上到下电负性逐渐减小,因此Ⅲ含有的元素中,O电负性最大,故C正确;
D.Ⅳ中无饱和碳原子,手性碳原子一定是饱和碳原子,故Ⅳ中无手性碳原子,故D错误;
故选:BC;
(4)分子Ⅲ中,每个N原子上有1对孤电子对,每个O原子上有2对孤电子对,故共有6对孤电子对,即1ml分子Ⅲ的价电子中,有6ml孤电子对;
(5)中心原子Se原子层电子对数为4,为sp3杂化,离子的立体构型为正四面体形,同种元素对应的无机含氧酸,元素价态越高,非羟基氧越多,酸性越强,可以类比硫酸酸性强于亚硫酸,酸性:H2SeO3
16.(1) 15
(2)的价层电子排布式为,较不稳定,的价层电子排布式为全充满的,比较稳定,故高温下CuO能转化为
(3) 、 V形 平面三角形 三角锥形 正四面体形
(4) 离子晶体 FeO
(5)
【分析】S原子位于晶胞内部,共有8个硫原子,结合化学式可知1个晶胞内含有4个Fe原子,4个Cu原子,据此回答。
(1)①铜的价电子为3d104s1,价层电子的轨道表示式(电子排布图)为:;
②铜的电子排布式为1s22s22p63s23p63d104s1,则基态铜原子核外电子的空间运动状态(原子轨道)有15种;
(2)高温下CuO能转化为Cu2O的原因是:Cu2+的价层电子排布式为3d9,较不稳定,Cu+的价层电子排布式为全充满的3d10,比较稳定,故高温下CuO能转化为Cu2O;
(3)SO22个σ键,孤电子对数为1,sp2杂化,SO33个σ键,孤电子对数为0,sp2杂化,3个σ键,孤电子对数为1,sp3杂化,4个σ键,孤电子对数为0,sp3杂化,中心原子为sp3杂化的是与;属于极性分子的是SO2;二氧化硫为V形,SO3为平面三角形,为三角锥,为正四面体;
(4)①两种物质的熔点都比较高,因此两种氧化物的晶体类型都是离子晶体,由于氧化铁中的带三个单位正电荷,而氧化亚铁中的带两个单位正电荷,因此氧化铁中离子键强于氧化亚铁中的离子键,因此氧化亚铁的熔点较低;
②则1360℃是FeO的熔点;
(5)①根据图1与图2可知,则原子2(铁原子)的分数坐标为(,1,);
②根据分析可知,1个晶胞质量为,晶胞的体积为,该晶体的密度为。
符号
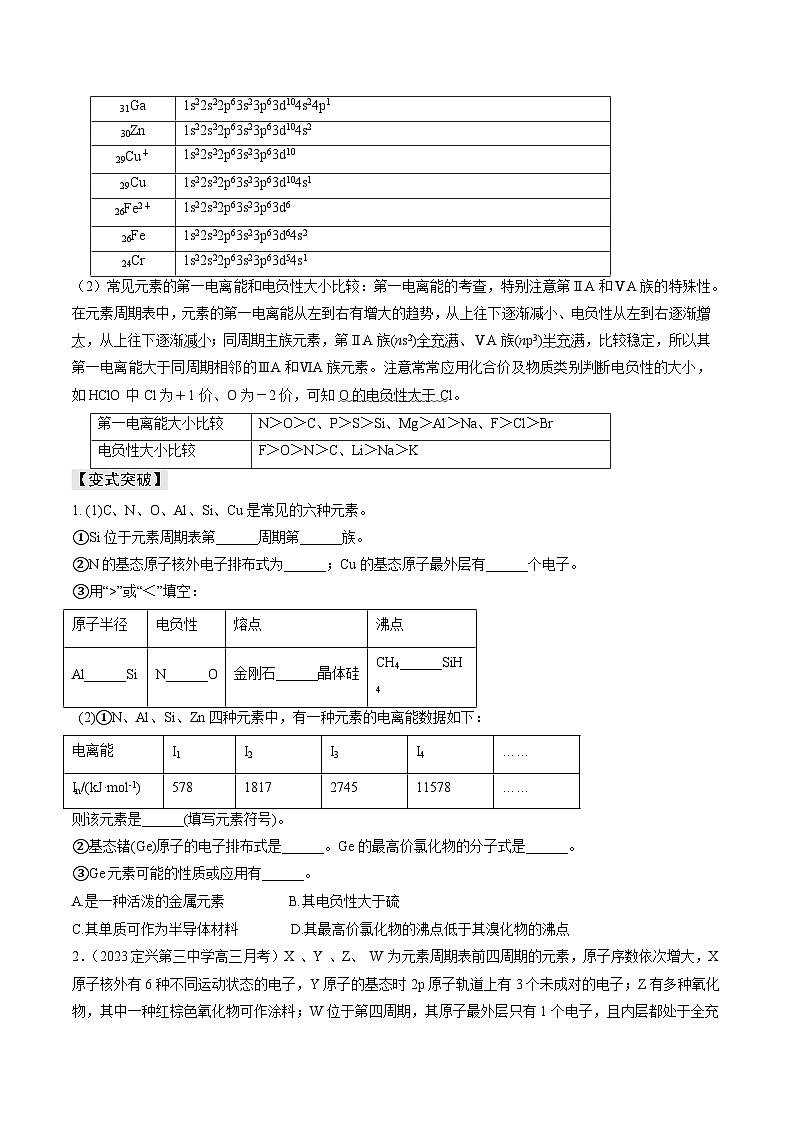
电子排布式
25Mn2+
1s22s22p63s23p63d5
25Mn
1s22s22p63s23p63d54s2
34Se
1s22s22p63s23p63d104s24p4
28Ni2+
1s22s22p63s23p63d8
28Ni
1s22s22p63s23p63d84s2
31Ga
1s22s22p63s23p63d104s24p1
30Zn
1s22s22p63s23p63d104s2
29Cu+
1s22s22p63s23p63d10
29Cu
1s22s22p63s23p63d104s1
26Fe2+
1s22s22p63s23p63d6
26Fe
1s22s22p63s23p63d64s2
24Cr
1s22s22p63s23p63d54s1
第一电离能大小比较
N>O>C、P>S>Si、Mg>Al>Na、F>Cl>Br
电负性大小比较
F>O>N>C、Li>Na>K
原子半径
电负性
熔点
沸点
Al______Si
N______O
金刚石______晶体硅
CH4______SiH4
电离能
I1
I2
I3
I4
……
In/(kJ·ml-1)
578
1817
2745
11578
……
GeCl4
GeBr4
GeI4
熔点/℃
−49.5
26
146
沸点/℃
83.1
186
约400
杂化轨道类型
分子构型
示例
sp
直线形
CO2、BeCl2、HgCl2
sp2
平面三角形
BF3、BCl3、SO3、HCHO
平面形
C2H4
Ⅴ形
SO2
sp3
等性杂化
正四面体
CH4、CCl4、NHeq \\al(+,4)
不等性杂化
三角锥形
NH3、PCl3
Ⅴ形
H2S、H2O
分子组成
极性分子
非极性分子
三原子分子
H2O、SO2
极性键
V形
CS2、CO2
极性键
直线形
四原子分子
NH3
极性键
三角锥形
BF3
极性键
平面正三角形
五原子分子
CH3Cl
极性键
四面体
CH4、CCl4
极性键
正四面体
等电子体的条件
构成微粒的原子总数和价电子总数相同
空间结构
等电子体的性质相似,结构上也存在某些相似性,如NHeq \\al(+,4)、CH4互为等电子体,其结构皆为正四面体形。常利用等电子原理判断一些简单分子或离子的立体构型及轨道杂化方式。如CO2、N2O、OCN-、SCN-为等电子体,结构相似,为直线形,中心原子轨道杂化方式为sp杂化
10电子
分子和原子:Ne、HF、H2O、NH3、CH4等;离子:F-、OH-、H3O+、NH2—、NHeq \\al(+,4)、N3-、O2-、Na+、Mg2+、Al3+等,其中HF与OH-、H2O与NH2—、NH3与H3O+、CH4与NHeq \\al(+,4)互为等电子体
14电子
分子和原子:Si、N2、CO、C2H2等,离子:C22— (CaC2)等,其中N2、CO、C22—互为等电子体
18电子
分子和原子:Ar、HCl、H2S、PH3、SiH4、F2、H2O2、N2H4(肼)、C2H6(乙烷)、CH3OH等,离子:Cl-、HS-、S2-、K+、Ca2+等,其中HCl与HS-互为等电子体
代号
结构简式
水中溶解度/g(25 ℃)
熔点/ ℃
沸点/ ℃
X
0.2
45
100
Y
1.7
114
295
参数
分子
分子直径/nm
分子与H2O的结合能
E/kJ·ml-1
CH4
0.436
16.40
CO2
0.512
29.91
选项
事实
分析
A
键角:
电负性:C
第一电离能:P>S
原子半径:P>S
C
沸点:CO>
CO为极性分子,为非极性分子
D
热稳定性:HF>HCl
HF中存在氢键,HCl中不存在氢键
新高考化学三轮复习考前冲刺练习易错专题10 反应机理(2份打包,原卷版+解析版): 这是一份新高考化学三轮复习考前冲刺练习易错专题10 反应机理(2份打包,原卷版+解析版),文件包含新高考化学三轮复习考前冲刺练习易错专题10反应机理原卷版docx、新高考化学三轮复习考前冲刺练习易错专题10反应机理解析版docx等2份试卷配套教学资源,其中试卷共49页, 欢迎下载使用。
新高考化学三轮复习考前冲刺练习易错专题09 反应热的表示与计算(2份打包,原卷版+解析版): 这是一份新高考化学三轮复习考前冲刺练习易错专题09 反应热的表示与计算(2份打包,原卷版+解析版),文件包含新高考化学三轮复习考前冲刺练习易错专题09反应热的表示与计算原卷版docx、新高考化学三轮复习考前冲刺练习易错专题09反应热的表示与计算解析版docx等2份试卷配套教学资源,其中试卷共40页, 欢迎下载使用。
新高考化学三轮复习考前冲刺练习易错专题08 晶体结构和晶胞计算(2份打包,原卷版+解析版): 这是一份新高考化学三轮复习考前冲刺练习易错专题08 晶体结构和晶胞计算(2份打包,原卷版+解析版),文件包含新高考化学三轮复习考前冲刺练习易错专题08晶体结构和晶胞计算原卷版docx、新高考化学三轮复习考前冲刺练习易错专题08晶体结构和晶胞计算解析版docx等2份试卷配套教学资源,其中试卷共45页, 欢迎下载使用。












