



所属成套资源:新高考化学一轮复习讲义课件 (含解析)
新高考化学一轮复习讲义课件第4章 第21讲 必做实验提升(四) 不同价态含硫物质的转化(含解析)
展开
这是一份新高考化学一轮复习讲义课件第4章 第21讲 必做实验提升(四) 不同价态含硫物质的转化(含解析),共18页。PPT课件主要包含了硫和铁粉,除去混合物中的硫粉,CS2,反应是放热的,溴水褪色,生成浅黄色沉淀,S↓+3H2O,溶液褪色,NaOH溶液,酸性氧化物等内容,欢迎下载使用。
1.-2价S→0价S实验步骤:在两支试管中分别加入1 mL硫化钠溶液,向其中一支边振荡边滴加亚硫酸溶液,另一支边振荡边滴加酸性高锰酸钾溶液,用浸有氢氧化钠溶液的棉团塞住试管口,观察并记录实验现象。
答案 硫化钠转化为单质硫,硫元素化合价由-2价转化为0价,观察到的现象是有淡黄色沉淀生成。
2.根据硫元素的化合价分析H2SO3具有氧化性还是还原性?怎样利用实验验证H2SO3具有的性质?
答案 硫元素的最高正价是+6价,最低负价是-2价,H2SO3中硫元素为+4价,因此H2SO3既有氧化性又有还原性。可以利用H2SO3与Na2S或H2S反应,验证H2SO3具有氧化性;利用H2SO3与酸性KMnO4溶液反应,验证H2SO3具有还原性。
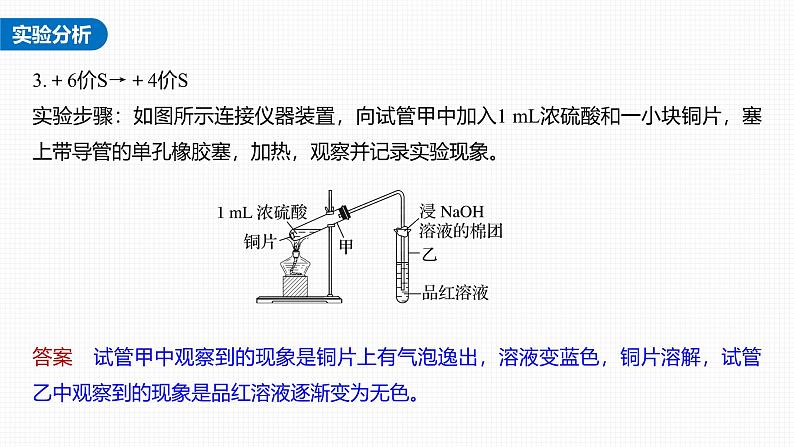
3.+6价S→+4价S实验步骤:如图所示连接仪器装置,向试管甲中加入1 mL浓硫酸和一小块铜片,塞上带导管的单孔橡胶塞,加热,观察并记录实验现象。
答案 试管甲中观察到的现象是铜片上有气泡逸出,溶液变蓝色,铜片溶解,试管乙中观察到的现象是品红溶液逐渐变为无色。
4.0价S→-2价S实验步骤:将0.5 g硫粉和1.0 g铁粉均匀混合,放在石棉网(或陶土网)上堆成条状。用灼热的玻璃棒触及混合粉末的一端,当混合物呈红热状态时,移开玻璃棒,观察并记录实验现象。
答案 硫转化为硫化亚铁,观察到的现象是混合物继续保持红热,最后生成黑色固体。
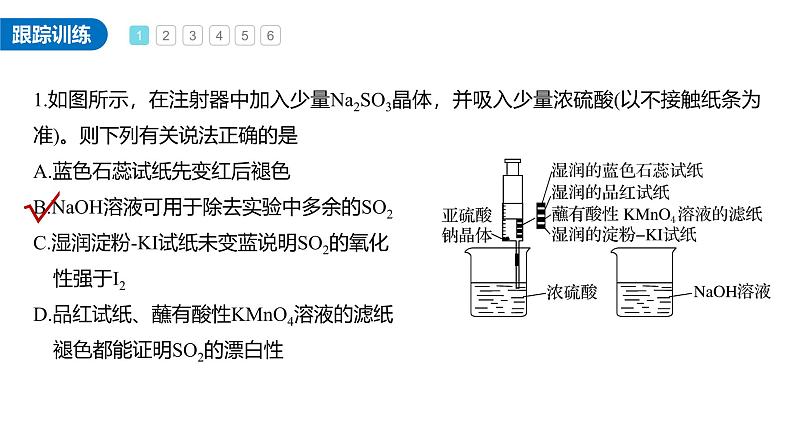
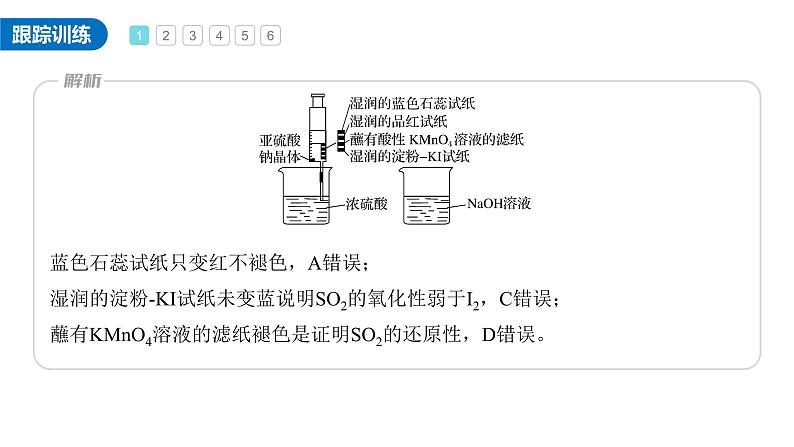
1.如图所示,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准)。则下列有关说法正确的是A.蓝色石蕊试纸先变红后褪色B.NaOH溶液可用于除去实验中多余的SO2C.湿润淀粉-KI试纸未变蓝说明SO2的氧化 性强于I2D.品红试纸、蘸有酸性KMnO4溶液的滤纸 褪色都能证明SO2的漂白性
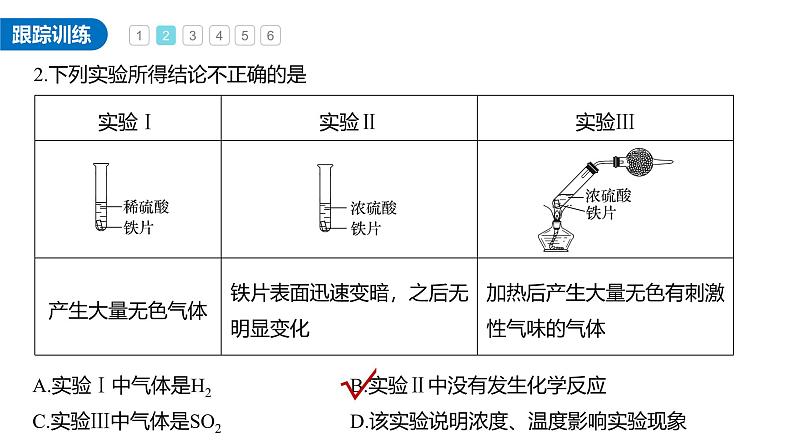
2.下列实验所得结论不正确的是
A.实验Ⅰ中气体是H2B.实验Ⅱ中没有发生化学反应C.实验Ⅲ中气体是SO2D.该实验说明浓度、温度影响实验现象
3.已知SO2通入BaCl2溶液无明显现象。某同学利用如图装置探究SO2与BaCl2溶液反应生成白色沉淀的条件。下列判断正确的是
A.e、f两管中的试剂可以分别是浓氨水和NaOH固体B.乙中产生的一定为氧化性气体,将BaSO3氧化为 BaSO4沉淀C.玻璃管的作用是连通大气,使空气中的氧气进入广 口瓶,参与反应D.c、d两根导管都必须插入BaCl2溶液中,保证气体与Ba2+充分接触
玻璃管的作用是连通大气,平衡压力,以便左右两边产生的气体顺利导入,故C错误;如果产生氨气,氨气极易溶于水,为防止倒吸,所以导管不能插入BaCl2溶液中,故D错误。
4.为了证明铁和硫反应产物中铁的化合价,下面是某同学设计的实验过程的一部分:
请回答以下问题:(1)混合粉末A中硫粉过量的原因是__________________________________________________________________________。(2)反应在“惰性气体环境”中进行的原因是__________________________。
防止因铁粉过量而使滤渣C中含铁粉,剩余铁粉
与H2SO4反应生成Fe2+干扰实验
防止空气中的O2参与反应
(3)操作①是用烧热的玻璃棒点触混合粉末,反应即可持续进行,说明__________________________。(4)操作②的作用是_____________________,也可改用______。(5)操作③稀H2SO4煮沸的目的是__________________________________________。
防止稀H2SO4溶液溶解的氧气氧化生成的Fe2+
5.亚硫酸钠中有+4价的硫,它既有氧化性又有还原性。现有试剂:溴水、Na2S溶液、Na2SO3溶液、稀H2SO4、NaOH溶液、氨水。(1)要证明Na2SO3具有还原性,应选用的试剂有____________________,看到的现象是____________,反应的化学方程式为______________________________________。(2)要证明Na2SO3具有氧化性,应选用的试剂有_____________________________,看到的现象是_________________,反应的离子方程式为____________________________________。
Na2SO3溶液、溴水
Na2SO3+Br2+H2O===Na2SO4+2HBr
Na2SO3溶液、Na2S溶液和稀硫酸
6.某小组同学设计如下实验实现几种价态硫元素间的转化。任务Ⅰ.从以下试剂中选择合适的试剂实现S(+6)→S(+4)的转化。试剂:①浓H2SO4 ②稀H2SO4 ③酸性KMnO4溶液 ④Na2SO3溶液 ⑤Cu ⑥品红溶液(1)写出实现转化的化学方程式:___________________________________________。(2)设计实验,证明实现了该转化(写出操作和现象):______________________________________。
将产生的气体通入品红溶液中,
(3)①中加入的物质是____________,该转化利用的是SO2____________的性质。(4)写出③的离子方程式:___________________________________。
任务Ⅱ.实现硫元素化合价在0、+2、+4价之间的转化。查阅资料:+2价硫元素在酸性条件下不稳定,自身易发生氧化还原反应。
相关课件
这是一份新高考化学一轮复习讲义课件第4章 第21讲 硫酸 含硫物质的转化(含解析),共60页。PPT课件主要包含了复习目标,硫酸盐多硫含氧酸盐,一重要的硫酸盐,真题演练明确考向,课时精练等内容,欢迎下载使用。
这是一份人教版 (2019)必修 第二册第一节 硫及其化合物课堂教学课件ppt,共23页。PPT课件主要包含了学习目标,SO2,H2SO4等内容,欢迎下载使用。
这是一份新高考化学一轮复习课件 第4章 第21讲 必做实验提升(四) 不同价态含硫物质的转化,共20页。PPT课件主要包含了高考化学一轮复习策略,必做实验提升四等内容,欢迎下载使用。









