





所属成套资源:新高考化学一轮复习讲义课件 (含解析)
新高考化学一轮复习讲义课件第5章 第31讲 晶体结构与性质(含解析)
展开
这是一份新高考化学一轮复习讲义课件第5章 第31讲 晶体结构与性质(含解析),共60页。PPT课件主要包含了复习目标,晶体与晶胞,周期性有序,相对无序,不固定,各向异性,各向同性,X射线衍射,熔融态,任何间隙等内容,欢迎下载使用。
1.了解晶体的类型,了解不同类型晶体中结构微粒、微粒间作用力的区别。2.了解分子晶体、共价晶体、离子晶体、金属晶体结构与性质的关系。3.了解晶胞的概念,能根据晶胞确定晶体的组成并进行相关的计算。
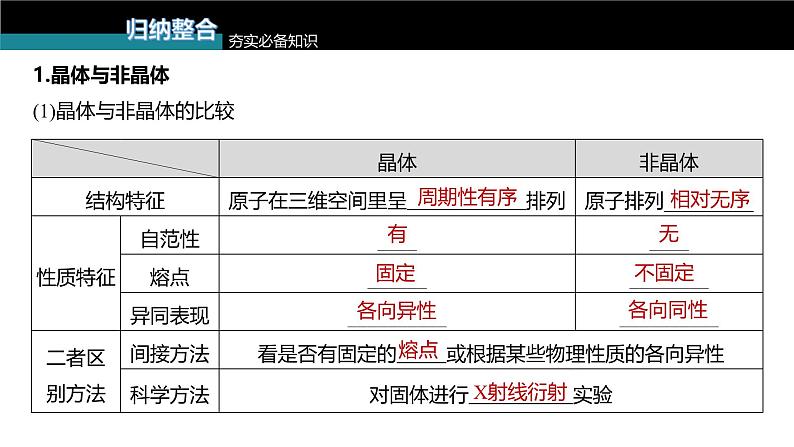
1.晶体与非晶体(1)晶体与非晶体的比较
(2)获得晶体的途径① 物质凝固。② 物质冷却不经液态直接凝固(凝华)。③溶质从溶液中 。
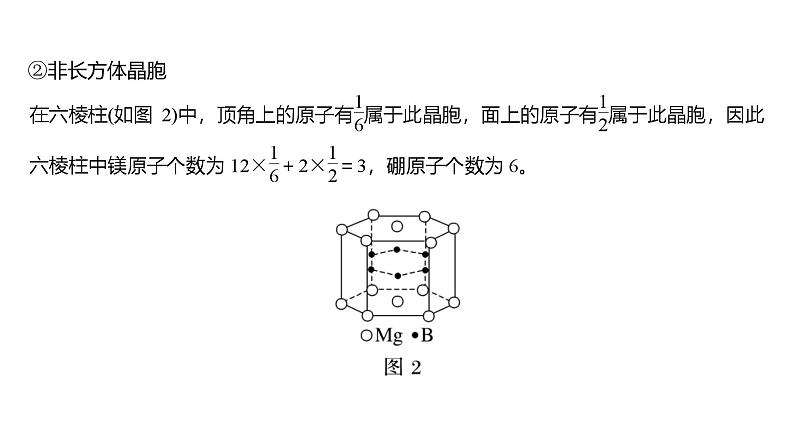
2.晶胞(1)概念:晶胞是描述晶体结构的基本单元,是从晶体中“截取”出来具有代表性的最小重复单元。(2)晶体中晶胞的排列——无隙并置①无隙:相邻晶胞之间没有 。②并置:所有晶胞 排列、 相同。(3)晶胞中微粒数的计算方法——均摊法①长方体(包括立方体)晶胞中不同位置的粒子数的计算:如某个粒子为N个晶胞所共有,则该粒子有 属于这个晶胞。中学中常见的晶胞为立方晶胞,立方晶胞中微粒数的计算方法如图1。
平行 取向
1.冰和碘晶体中相互作用力相同( )2.晶体内部的微粒按一定规律周期性排列( )3.凡有规则外形的固体一定是晶体( )4.固体SiO2一定是晶体( )5.缺角的NaCl晶体在饱和NaCl溶液中会慢慢变为完美的立方体块( )6.晶胞是晶体中最小的“平行六面体”( )7.区分晶体和非晶体最可靠的方法是对固体进行X射线衍射实验( )
1.CaTiO3的晶胞如图所示,其组成元素的电负性大小顺序是__________;金属离子与氧离子间的作用力为________,Ca2+的配位数是_____。
一、晶胞及微粒配位数的判断
2.C、N元素能形成一种类石墨的聚合物半导体g-C3N4,其单层平面结构如图1,晶胞结构如图2。
根据图2,在图1中用平行四边形画出一个最小重复单元。
晶胞中粒子配位数的计算
一个粒子周围最邻近的粒子的数目称为配位数(1)晶体中原子(或分子)的配位数:若晶体中的微粒为同种原子或同种分子,则某原子(或分子)的配位数指的是该原子(或分子)最接近且等距离的原子(或分子)的数目。(2)离子晶体的配位数:指一个离子周围最接近且等距离的异种电性离子的数目。
3.如图是甲、乙、丙三种晶体的晶胞,则甲晶体中x与y的个数比是______,乙中a与b的个数比是______,丙中一个晶胞中有____个c粒子和_____个d粒子。
二、晶胞中微粒数及化学式的计算
4 4
4.下图为离子晶体空间结构示意图:(●阳离子,○阴离子)以M代表阳离子,N表示阴离子,写出各离子晶体的组成表达式:
A_____、B_____、C_____。
MN MN3 MN2
5.(1)硼化镁晶体在39 K时呈超导性。在硼化镁晶体中,镁原子和硼原子是分层排布的,如图是该晶体微观结构的透视图,图中的硼原子和镁原子投影在同一平面上。则硼化镁的化学式为________。
每个Mg周围有6个B,而每个B周围有3个Mg,所以其化学式为MgB2。
(2)在硼酸盐中,阴离子有链状、环状等多种结构形式。如图是一种链状结构的多硼酸根,则多硼酸根的离子符号为________。
(1)运用均摊法计算出一个晶胞中的微粒数目。(2)求出不同微粒数目比值,得化学式。
1.四种晶体类型的比较
范德华力(某些含氢键)
2.过渡晶体大多数晶体是这四种晶体类型之间的过渡晶体,以离子晶体和共价晶体之间的过渡为例,如Na2O、Al2O3中既有离子键成分,也有共价键成分,Na2O中离子键成分占62%,因而通常当作离子晶体来处理,Al2O3中离子键成分占41%,因而通常当作共价晶体来处理。
3.常见晶体结构模型(1)共价晶体
①金刚石晶体中,每个C与相邻 个C形成共价键,C—C—C夹角是109°28′,最小的环是 元环。含有1 ml C的金刚石中,形成的共价键是 ml。②SiO2晶体中,每个Si原子与 个O原子成键,每个O原子与 个Si原子形成共价键,最小的环是 元环,在“硅氧”四面体中,处于中心的是 原子,1 ml SiO2中含有 ml Si—O。
(2)分子晶体①干冰晶体中,每个CO2分子周围等距且紧邻的CO2分子有 个。
②冰晶体中,每个水分子与相邻的 个水分子以氢键相连接,含1 ml H2O的冰中,最多可形成 ml氢键。
①NaCl型:在晶体中,每个Na+同时吸引 个Cl-,每个Cl-同时吸引 个Na+,配位数为 。每个晶胞含 个Na+和 个Cl-。②CsCl型:在晶体中,每个Cl-吸引 个Cs+,每个Cs+吸引 个Cl-,配位数为 。
石墨层状晶体中,层与层之间的作用是 ,平均每个正六边形拥有的碳原子个数是 ,C原子采取的杂化方式是 。
1.在晶体中只要有阳离子就一定有阴离子( )2.分子晶体的熔点一定比金属晶体的低( )3.离子晶体一定都含有金属元素( )4.金属元素和非金属元素组成的晶体不一定是离子晶体( )5.1 ml金刚石和SiO2中含有的共价键数目均为4NA( )6.氯化钠晶体中,每个Na+周围距离相等且最近的Na+共有6个( )7.冰中包含的作用力有范德华力、氢键和共价键( )8.金属晶体能导电是因为金属晶体在外加电场作用下可失去电子( )
1.下列性质适合于分子晶体的是A.熔点为1 070 ℃,易溶于水,水溶液导电B.熔点为3 500 ℃,不导电,质硬,难溶于水和有机溶剂C.能溶于CS2,熔点为112.8 ℃,沸点为444.6 ℃D.熔点为97.8 ℃,质软,导电,密度为0.971 g·cm-3
依据性质判断晶体类型的方法
(1)依据晶体的熔点判断。(2)依据导电性判断。(3)依据硬度和机械性能判断。
2.下列各组物质中,按熔点由低到高的顺序排列正确的是①O2、I2、Hg ②PH3、AsH3、NH3 ③Na、K、Rb ④Na、Mg、AlA.①③ B.①④ C.②③ D.②④
二、晶体熔、沸点的比较
3.回答下列问题:(1)氯酸钾熔化,粒子间克服了________的作用力;二氧化硅熔化,粒子间克服了________的作用力;碘的升华,粒子间克服了________作用力。三种晶体的熔点由高到低的顺序是_________________(填化学式)。(2)下列六种晶体:①CO2 ②NaCl ③Na ④Si ⑤CS2 ⑥金刚石。它们的熔点从低到高的顺序为______________(填序号)。
SiO2>KClO3>I2
1.不同类型晶体的熔、沸点高低的一般规律:共价晶体>离子晶体>分子晶体。2.相同类型晶体(1)金属晶体:金属阳离子半径越小,所带电荷越多,则金属键越强,金属的熔、沸点就越高。(2)离子晶体:阴、阳离子的电荷数越多,离子半径越小,熔、沸点就越高。(3)共价晶体:原子半径越小,键长越短,熔、沸点越高。(4)分子晶体:①组成和结构相似的分子晶体,相对分子质量越大,熔、沸点越高;具有分子间氢键的分子晶体的熔、沸点反常地高。②组成和结构不相似的分子晶体(相对分子质量接近),其分子的极性越大,熔、沸点越高。
4.(1)铜是第四周期最重要的过渡元素之一,已知CuH晶体结构单元如图甲所示。该化合物的密度为ρ g·cm-3,阿伏加德罗常数的值为NA,则该晶胞中Cu原子与H原子之间的最短距离为______________ cm(用含ρ和NA的式子表示)。
三、晶体结构的有关计算
(2)CuFeS2的晶胞如图乙所示,晶胞参数a=0.524 nm,b=0.524 nm,c=1.032 nm;CuFeS2的晶胞中每个Cu原子与_______个S原子相连,列式计算晶体密度ρ=_____________________________________________________________(保留两位小数)。
(3)NaH具有NaCl型晶体结构,已知NaH晶体的晶胞参数a=488 pm,Na+半径为102 pm,H-的半径为________,NaH的理论密度是______ g·cm-3(保留两位小数)。
(4)金刚石晶胞结构如图丙所示,则金刚石晶体含有______个碳原子。若碳原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,则r=______a,列式表示碳原子在晶胞中的空间占有率:________________(不要求计算结果)。
(1)晶胞计算公式(立方晶胞)a3ρNA=NM(a:棱长;ρ:密度;NA:阿伏加德罗常数的值;N:1 ml晶胞所含基本粒子或特定组合的物质的个数;M:基本粒子或特定组合的摩尔质量)。(2)金属晶体中体心立方堆积、面心立方堆积中的几组公式(设棱长为a)
1.(2021·辽宁,7)单质硫和氢气在低温高压下可形成一种新型超导材料,其晶胞如图。下列说法错误的是A.S位于元素周期表p区B.该物质的化学式为H3SC.S位于H构成的八面体空隙中D.该晶体属于分子晶体
2.(2021·天津,2)下列各组物质的晶体类型相同的是A.SiO2和SO3 B.I2和NaClC.Cu和Ag D.SiC和MgO
3.(2020·山东等级模拟考,4)下列关于C、Si及其化合物结构与性质的论述错误的是A.键能:C—C>Si—Si、C—H>Si—H,因此C2H6稳定性大于Si2H6B.立方型SiC是与金刚石成键、结构均相似的共价晶体,因此具有很高的硬度C.SiH4中Si的化合价为+4,CH4中C的化合价为-4,因此SiH4还原性小于CH4D.Si原子间难形成双键而C原子间可以,是因为Si的原子半径大于C,难形成p-p π键
4.[2021·全国乙卷,35(4)]在金属材料中添加AlCr2颗粒,可以增强材料的耐腐蚀性、硬度和机械性能。AlCr2具有体心四方结构,如图所示。处于顶角位置的是____原子。设Cr和Al原子半径分别为rCr和rAl,则金属原子空间占有率为__________________% (列出计算表达式)。
5.[2021·天津,13(2)]用X射线衍射测定,得到Fe的两种晶胞A、B,其结构如图所示。晶胞A中每个Fe原子紧邻的原子数为_____。每个晶胞B中含Fe原子数为_____。
6.[2021·浙江6月选考,26(1)]已知3种共价晶体的熔点数据如下表:
金刚石熔点比晶体硅熔点高的原因是______________________________________________________________________________________________________________。
共价晶体中,原子半径越小,共价键键能越
大,熔点越高,原子半径:C<Si(或键长:C—C<Si—Si),键能:C—C>Si—Si
7.[2019·全国卷Ⅰ,35(3)(4)](3)一些氧化物的熔点如表所示:
解释表中氧化物之间熔点差异的原因:_________________________________________________________________________________________________。
Li2O、MgO为离子晶体,P4O6、SO2为分子
晶体。离子键强度:MgO>Li2O。分子间作用力(分子量):P4O6>SO2
(4)图(a)是MgCu2的拉维斯结构,Mg以金刚石方式堆积,八面体空隙和半数的四面体空隙中,填入以四面体方式排列的Cu。图(b)是沿立方格子对角面取得的截图。可见,Cu原子之间最短距离x=______ pm,Mg原子之间最短距离y=_______ pm。设阿伏加德罗常数的值为NA,则MgCu2的密度是______________g·cm-3(列出计算表达式)。
1.(2022·湖南汩罗市模拟)下列关于晶体的说法不正确的是①晶体中原子呈周期性有序排列,有自范性;而非晶体中原子排列相对无序,无自范性 ②含有金属阳离子的晶体一定是离子晶体 ③共价键可决定分子晶体的熔、沸点 ④晶胞是晶体结构的基本单元,晶体内部的微粒按一定规律作周期性重复排列 ⑤晶体尽可能采取紧密堆积方式,以使其变得比较稳定 ⑥干冰晶体中,一个CO2分子周围有12个CO2分子紧邻;CsCl和NaCl晶体中阴、阳离子的配位数都为6A.①②③ B.②③④C.④⑤⑥ D.②③⑥
2.(2021·湖北1月选考模拟,13)已知NixMg1-xO晶体属立方晶系,晶胞边长a。将Li+掺杂到该晶胞中,可得到一种高性能的p型太阳能电池材料,其结构单元如下图所示。假定掺杂后的晶胞参数不发生变化,下列说法正确的是A.该结构单元中O原子数为3B.Ni和Mg间的最短距离是C.Ni的配位数为4D.该物质的化学式为
由晶胞结构可知,Ni的配位数为6,C错误;
3.(2021·辽宁1月适应性测试,6)我国科学家合成了富集11B的非碳导热材料立方氮化硼晶体,晶胞结构如图。下列说法正确的是A.11BN和10BN的性质无差异B.该晶体具有良好的导电性C.该晶胞中含有14个B原子,4个N原子D.N原子周围等距且最近的N原子数为12
11B和10B互为同位素,形成的化合物在化学性质上无差异,但其物理性质不同,A错误;该晶体结构中无自由移动的电子,不具有导电性,B错误;由图可知,该晶胞含4个N原子,B原子位于晶胞的顶角和
由晶胞示意图,1个N原子与4个B原子成键,1个B原子可以和3个N原子成键,这些N原子距中心N原子等距且最近,总数为12个,D正确。
A.SiCl4是分子晶体B.晶体硼是共价晶体C.AlCl3是分子晶体,加热能升华D.金刚石中的C—C键能比晶体硅中的Si—Si键能弱
4.根据下表中给出的有关数据,判断下列说法错误的是
SiCl4、AlCl3的熔、沸点低,都是分子晶体,AlCl3的沸点低于其熔点,即在未熔化的温度下它就能汽化,故AlCl3加热能升华,A、C正确;晶体硼的熔、沸点高,是共价晶体,B正确;由金刚石与晶体硅的熔、沸点相对高低可知:金刚石中的C—C键能比晶体硅中的Si—Si键能强,D错误。
5.下列说法错误的是A.分子晶体中一定存在分子间作用力B.共价晶体中只含有共价键C.任何晶体中,若含有阳离子就一定含有阴离子D.单质的晶体中一定不存在离子键
6.解释下列物质性质的变化规律与物质结构间的因果关系时,与化学键强弱无关的变化规律是A.HF、HCl、HBr、HI的热稳定性依次减弱B.NaF、NaCl、NaBr、NaI的熔点依次降低C.F2、Cl2、Br2、I2的熔、沸点逐渐升高D.Li、Na、K、Rb 的熔点逐渐降低
7.(2022·沈阳模拟)下列有关晶体的叙述中,错误的是A.金刚石的网状结构中,由共价键形成的最小碳环上有6个碳原子B.在CaF2晶体中每个Ca2+周围紧邻8个F-,每个F-周围紧邻4个Ca2+C.白磷晶体中,微粒之间通过共价键结合,键角为60°D.离子晶体在熔化时,离子键被破坏;而分子晶体熔化时,化学键不被破坏
8.下列各物质中,按熔点由高到低的顺序排列正确的是A.CH4>SiH4>GeH4>SnH4B.KCl>NaCl>MgCl2>MgOC.MgBr2>SiCl4>BND.金刚石>晶体硅>钠
9.金晶体是面心立方最密堆积,已知立方体的每个面上5个金原子紧密堆积,金原子半径为r cm,则金晶体的空间利用率为
10.非整比化合物Fe0.95O具有NaCl型晶体结构,由于n(Fe)∶n(O)
相关课件
这是一份新高考化学一轮复习讲义课件第5章 第31讲 热点强化11 晶胞参数 坐标参数的分析与应用(含解析),共23页。PPT课件主要包含了原子分数坐标参数,CaTiO3,Ti4+,sp3等内容,欢迎下载使用。
这是一份(人教版)高考化学一轮复习讲义课件第10章第43讲 电解原理应用新拓展(含解析),共49页。PPT课件主要包含了课时精练等内容,欢迎下载使用。
这是一份(人教版)高考化学一轮复习讲义课件第7章第31讲 原子结构 核外电子排布规律(含解析),共60页。PPT课件主要包含了练真题明考向,课时精练等内容,欢迎下载使用。









