


所属成套资源:新高考化学一轮复习讲义课件 (含解析)
新高考化学一轮复习讲义课件第7章 第45讲 实际工业生产中图像问题分类突破(含解析)
展开
这是一份新高考化学一轮复习讲义课件第7章 第45讲 实际工业生产中图像问题分类突破(含解析),共60页。PPT课件主要包含了复习目标,m1m2m3,选择最佳反应条件,该反应放,℃左右,真题演练明确考向,选择合适催化剂等,课时精练,当氨碳比相同时,升高温度等内容,欢迎下载使用。
1.加深外因对化学反应速率和化学平衡影响的理解。2.认识化学反应速率和化学平衡的综合调控在生活、生产和科学研究领域中的 重要作用。3.能正确解答实际工业生产中有关图像的问题。
1.控制反应条件的目的(1)促进有利的化学反应:通过控制反应条件,可以加快化学反应速率,提高反应物的转化率,从而促进有利的化学反应进行。(2)抑制有害的化学反应:通过控制反应条件,也可以减缓化学反应速率,减少甚至消除有害物质的产生或控制副反应的发生,从而抑制有害的化学反应继续进行。2.控制反应条件的基本措施(1)控制化学反应速率的措施通过改变反应体系的温度、溶液的浓度、气体的压强(或浓度)、固体的表面积以及使用催化剂等途径调控反应速率。
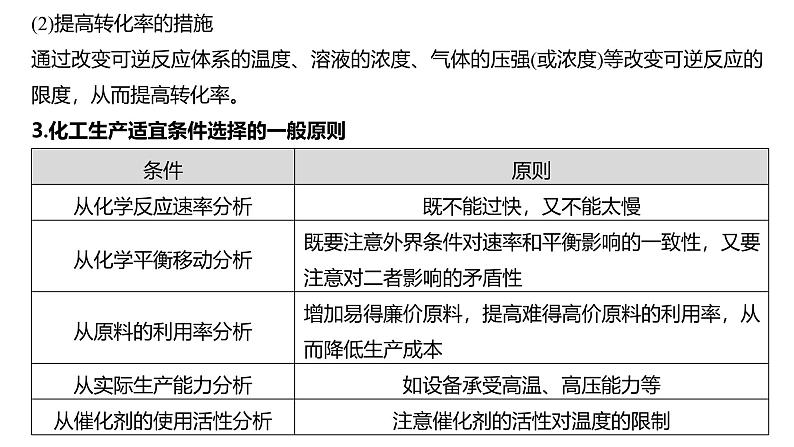
(2)提高转化率的措施通过改变可逆反应体系的温度、溶液的浓度、气体的压强(或浓度)等改变可逆反应的限度,从而提高转化率。3.化工生产适宜条件选择的一般原则
4.平衡类问题需考虑的几个方面(1)原料的来源、除杂,尤其考虑杂质对平衡的影响。(2)原料的循环利用。(3)产物的污染处理。(4)产物的酸碱性对反应的影响。(5)气体产物的压强对平衡造成的影响。(6)改变外界条件对多平衡体系的影响。
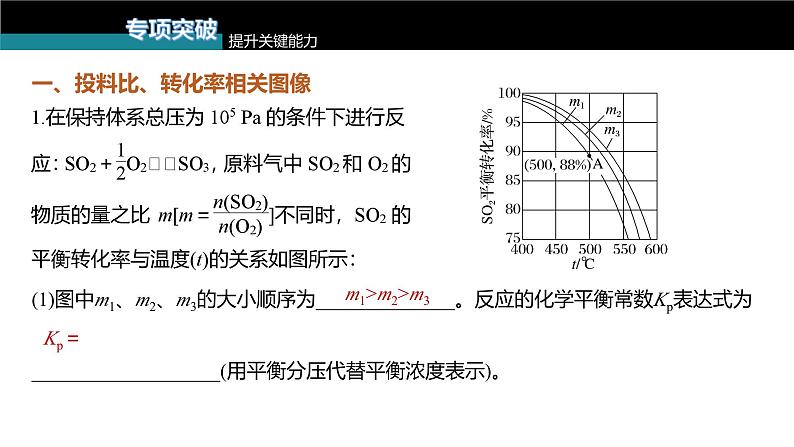
一、投料比、转化率相关图像
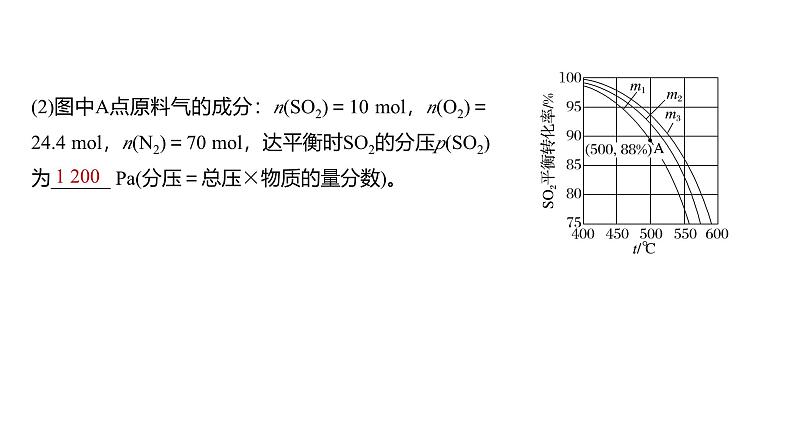
(1)图中m1、m2、m3的大小顺序为______________。反应的化学平衡常数Kp表达式为___________________(用平衡分压代替平衡浓度表示)。
(2)图中A点原料气的成分:n(SO2)=10 ml,n(O2)=24.4 ml,n(N2)=70 ml,达平衡时SO2的分压p(SO2)为______ Pa(分压=总压×物质的量分数)。
2.采用一种新型的催化剂(主要成分是Cu—Mn合金),利用CO和H2制备二甲醚(DME)。
测得反应体系中各物质的产率或转化率与催化剂的关系如图所示。
3.汽车尾气是雾霾形成的原因之一。研究氮氧化物的处理方法可有效减少雾霾的形成,可采用氧化还原法脱硝:
根据右图判断提高脱硝效率的最佳条件是__________________________________;氨氮比一定时,在400 ℃时,脱硝效率最大,其可能的原因是_________________________________________________________________________。
氨氮物质的量之比为1,温度为400 ℃
在400 ℃时催化剂的
活性最好,催化效率最高,同时400 ℃温度较高,反应速率快
三、解释曲线发生某种变化的原因
4.汽车使用乙醇汽油并不能减少NOx的排放,某研究小组在实验室以耐高温试剂Ag-ZSW-5催化,测得NO转化为N2的转化率随温度变化情况如下图所示。
(1)在 =1条件下,最佳温度应控制在________________________________左右。(2)若不使用CO,温度超过775 K,发现NO的分解率降低,其可能的原因为______________________________________________。(3)用平衡移动原理解释为什么加入CO后NO转化为N2的转化率增大:_____________________________________________________________________________________________。
870 K(860~880 K范围内都可以)
热,升高温度,反应向逆反应方向进行
加入的CO会与NO的分解产物O2发生反应,促进NO分解平衡
向生成N2的方向移动,导致NO的转化率增大
5.下图是在一定时间内,使用不同催化剂Mn和Cr在不同温度下对应的脱氮率,由图可知工业使用的最佳催化剂为______、相应温度为____________;使用Mn作催化剂时,脱氮率b~a段呈现如图变化的可能原因是______________________________________________________________________________________________________________________________________________________________。
b~a段,开始温度较低,催化剂活性较低,脱氮反应速率较慢,反应还没达到化学平衡,随着温度升高反应速率变大,一定时间参与反应的氮氧化物变多,导致脱氮率逐渐增大
1.[2021·全国甲卷,28(2)]二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。其总反应可表示为CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49 kJ·ml-1。回答下列问题:合成总反应在起始物 =3时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为x(CH3OH),在t=250 ℃下的x(CH3OH)~p、在p=5×105 Pa下的x(CH3OH)~t如图所示。
①用各物质的平衡分压表示总反应的平衡常数,表达式Kp=________________;
②图中对应等压过程的曲线是____,判断的理由是_____________________________________________________________________;③当x(CH3OH)=0.10时,CO2的平衡转化率α=______,反应条件可能为__________________或________________。
总反应ΔH
相关课件
这是一份新高考化学一轮复习讲义课件第7章 第44讲 化学反应速率、平衡的常规图像(含解析),共60页。PPT课件主要包含了复习目标,常规图像题的解题步骤,ACDF,n1-n3,n2-n3,Kb>Kc>Kd,真题演练明确考向,p1>p2>p3,课时精练,曲线a等内容,欢迎下载使用。
这是一份(人教版)高考化学一轮复习讲义课件第12章第56讲 溶液中的粒子平衡曲线分类突破(含解析),共60页。PPT课件主要包含了CH3COOH,CH3COONa,cNa+,NaOH,类型二分布系数曲线,读图解题要领,课时精练,NH3+H2O,ZnSO3等内容,欢迎下载使用。
这是一份(人教版)高考化学一轮复习讲义课件第11章第45讲 过渡态理论 催化剂对化学反应的影响(含解析),共60页。PPT课件主要包含了基元反应过渡态理论,练真题明考向,课时精练等内容,欢迎下载使用。










