





新高考化学一轮复习讲义课件第8章 第51讲 反应过程溶液粒子浓度变化的图像分析(含解析)
展开1.能正确识别图像,能从图像中找到曲线指代、趋势、关键点。2.利用溶液中的平衡关系,学会分析不同类型图像中各粒子浓度之间的关系。
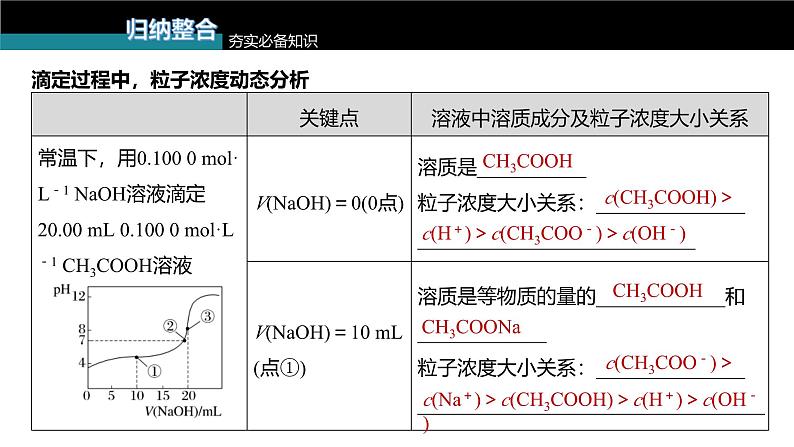
滴定图像中的粒子浓度关系
滴定过程中,粒子浓度动态分析
c(CH3COOH)>
c(H+)>c(CH3COO-)>c(OH-)
c(CH3COO-)>
c(Na+)>c(CH3COOH)>c(H+)>c(OH-)
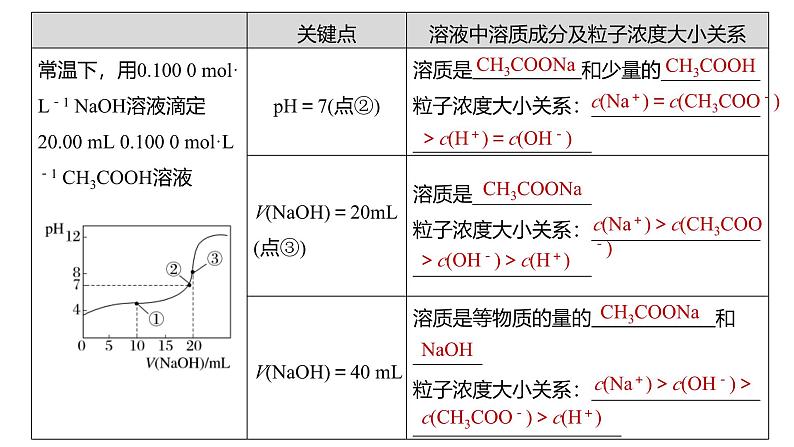
c(Na+)=c(CH3COO-)
>c(H+)=c(OH-)
c(Na+)>c(CH3COO-)
>c(OH-)>c(H+)
c(Na+)>c(OH-)>
c(CH3COO-)>c(H+)
1.常温下,用0.10 ml·L-1 NaOH溶液分别滴定20.00 mL浓度均为0.10 ml·L-1 CH3COOH溶液和HCN溶液所得滴定曲线如图所示。下列说法正确的是
A.点①和点②所示溶液中:c(CH3COO-)<c(CN-)B.点③和点④所示溶液中:c(Na+)>c(OH-)>c(CH3COO-) >c(H+)C.点①和点②所示溶液中:c(CH3COO-)-c(CN-)=c(HCN) -c(CH3COOH)D.点②和点③所示溶液中都有:c(CH3COO-)+c(OH-)= c(CH3COOH)+c(H+)
2.25 ℃时,用0.25 ml·L-1 NaOH溶液分别滴定同浓度的三种稀酸溶液,滴定曲线如图所示。下列判断不正确的是
A.同浓度的稀酸中:c(A-)>c(B-)>c(D-)B.滴定至P点时,溶液中:c(B-)>c(HB)C.pH=7时,三种溶液中:c(A-)>c(B-)>c(D-)D.当中和百分数达到100%时,将三种溶液混合后:c(HA)+ c(HB)+c(HD)=c(OH-)-2c(H+)
3.25 ℃,将0.01 ml·L-1 NaOH溶液滴入20 mL 0.01 ml·L-1 CH3COOH溶液的过程中,溶液中由水电离出的c(H+)与加入NaOH溶液体积的关系如图所示。下列说法正确的是A.x=20,a点的纵坐标为1.0×10-12B.b点和d点所示溶液的pH相等C.e点所示溶液中,c(Na+)=2c(CH3COO-)+ 2c(CH3COOH)D.滴定过程中,c(CH3COO-)与c(OH-)的比值 逐渐增大
1.透析分布曲线 遵定思维方向分布曲线是指以pH为横坐标、分布系数(即组分的平衡浓度占总浓度的分数)为纵坐标的关系曲线。
2.明确解题要领 快速准确作答(1)读“曲线”——每条曲线所代表的粒子及变化趋势;(2)“读浓度”——通过横坐标的垂线,可读出某pH时的粒子浓度;(3)“用交点”——交点是某两种粒子浓度相等的点,可计算电离常数K;(4)“可替换”——根据溶液中的元素质量守恒进行替换,分析得出结论。
D.用浓度大于1 ml·L-1的H3PO4溶液溶解 Li2CO3,当pH达到4.66时,H3PO4几乎全部转化为LiH2PO4
2.常温下,将盐酸滴加到联氨(N2H4)的水溶液中,混合溶液中的微粒的物质的量分数δ(X)随-lg c(OH-)变化的关系如图所示。下列叙述错误的是
3.(2020·全国卷Ⅰ,13)以酚酞为指示剂,用0.100 0 ml·L-1的NaOH溶液滴定20.00 mL未知浓度的二元酸H2A溶液。溶液中,pH、分布系数δ随滴加NaOH溶液体积VNaOH的变化关系如图所示。[比如A2-的分布系数:δ(A2-)=
下列叙述正确的是A.曲线①代表δ(H2A),曲线②代表δ(HA-)B.H2A溶液的浓度为0.200 0 ml·L-1C.HA-的电离常数Ka=1.0×10-2D.滴定终点时,溶液中c(Na+)<2c(A2-)+c(HA-)
对数图像中的粒子浓度关系
2.破解对数图像的步骤(1)识图像:观察横坐标、纵坐标的含义,看清每条曲线代表的粒子种类以及曲线的变化趋势,计算电离常数时应利用两种粒子浓度相等的点,如 =0。(2)找联系:根据图像中的坐标含义和曲线的交点,分析所给电解质的电离平衡常数或pH与纵、横坐标之间的联系。(3)想原理:涉及电离平衡常数,写出平衡常数表达式,在识图像、想原理的基础上,将图像与原理结合起来思考。(4)用公式:运用对数计算公式分析。
1.某浓度的二元弱酸H2B溶液在不同pH下,测得pC(M)变化如图所示,[已知: pC(M)=-lg c(M),M代指H2B或HB-或B2-],下列说法正确的是A.曲线 Ⅱ 表示pC(HB-)与pH关系B.pH=5时,c(HB-)
由图可知,pH=5时,此时pC(H2B)>pC(B2-)>pC(HB-),即c(HB-)>c(B2-)>c(H2B),故B项错误;
调节溶液pH的过程中,随着溶液体积的增大,H2B、HB-、B2-总物质的量之和不变,浓度之和逐渐减小,故D项错误。
2.(2020·山东,15改编)25 ℃时,某混合溶液中c(CH3COOH)+c(CH3COO-)=0.1 ml·L-1,lg c(CH3COOH)、lg c(CH3COO-)、lg c(H+)和lg c(OH-)随pH变化的关系如图所示。Ka为CH3COOH的电离常数,下列说法正确的是A.O点时,c(CH3COOH)=c(CH3COO-)B.N点时,pH=lg Ka
D.pH由7到14的变化过程中,CH3COO-的水解程度始终增大
3.常温下,二元弱酸H2Y溶液中滴加KOH溶液,所得混合溶液的pH与离子浓度变化的关系如图所示,下列说法错误的是
B.Ka2(H2Y)=10-4.3C.a点溶液中:c(H+)-c(OH-)=2c(Y2-)+c(HY-)-c(K+)D.交点c的溶液中:c(H2Y)=c(Y2-)>c(HY-)>c(H+)
a点溶液中存在电荷守恒:c(H+)+c(K+)=2c(Y2-)+c(HY-)+c(OH-),故c(H+)-c(OH-)=2c(Y2-)+c(HY-)-c(K+),C项正确;
常考对数图像关系的含义与变化规律
1.(2021·湖南1月适应性考试,9)常温下,用0.100 0 ml·L-1的盐酸分别滴定20.00 mL浓度均为0.100 0 ml·L-1的三种一元弱酸的钠盐(NaX、NaY、NaZ)溶液,滴定曲线如图所示。下列判断错误的是A.该NaX溶液中:c(Na+)>c(X-)>c(OH-)>c(H+)B.三种一元弱酸的电离常数:Ka(HX)>Ka(HY)>Ka(HZ)C.当pH=7时,三种溶液中:c(X-)=c(Y-)=c(Z-)D.分别滴加20.00 mL盐酸后,再将三种溶液混合:c(X-)+c(Y-) +c(Z-)=c(H+)-c(OH-)
M点存在电荷守恒:c(R-)+c(OH-)+c(Cl-)=2c(H3R2+)+c(H2R+)+c(H+)+c(Na+),此时c(H3R2+)=c(H2R+),因此c(R-)+c(OH-)+c(Cl-)=3c(H2R+)+c(H+)+c(Na+),故B错误;
P点溶质为NaCl、HR、NaR,此时溶液呈碱性,因此c(OH-)>c(H+),溶质浓度大于水解和电离所产生的微粒浓度,因此c(Na+)>c(Cl-)>c(OH-)>c(H+),故D错误。
3.(2021·海南,13改编)25 ℃时,向10.00 mL 0.100 0 ml·L-1的NaHCO3溶液中滴加0.100 0 ml·L-1的盐酸,溶液的pH随加入的盐酸的体积V变化如图所示。下列有关说法正确的是
c点,溶质为碳酸氢钠、氯化钠、碳酸,溶液中的H+主要来自H2CO3的电离,C项错误;d点,碳酸氢钠和盐酸恰好反应,c(Na+)=c(Cl-)=0.050 0 ml·L-1,D项错误。
电离平衡常数仅是温度的函数,Kb2(M)=Kb2(N)=Kb2(P),D项错误。
C.水的电离程度:b>c>a>dD.25 ℃时 ,NH4Cl 水解平衡常数为(n-1)×10-7 (用n表示)
2.在某温度时,将n ml·L-1氨水滴入10 mL1.0 ml·L-1盐酸中,溶液 pH 和温度随加入氨水体积变化曲线如图所示。下列有关说法错误的是
b点溶液温度最高,说明此时两溶液恰好反应生成氯化铵,铵根离子水解促进了水的电离,而a、d两点都抑制了水的电离,所以b点水的电离程度最大;由于d点混合液的pH不知,则无法判断a、d两点水的电离程度大小,C错误;
3.(2022·山东省实验中学高三质检)室温下,向20 mL 0.10 ml·L-1的CH3COOH溶液中逐滴加入0.10 ml·L-1的NaOH溶液,溶液中由水电离出的H+浓度的负对数[-lg c水(H+)]与所加NaOH溶液体积关系如图所示(忽略溶液混合引起的体积变化)。下列说法正确的是A.b点溶液中:c(CH3COO-)<c(CH3COOH)B.c、e两点溶液:c点显中性,e点显碱性C.d点溶液中,c(Na+)+c(CH3COO-)+c(CH3COOH) >0.10 ml·L-1D.f点溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
b点,CH3COOH和CH3COONa的物质的量相等,但溶液的pH<7,则表明CH3COOH的电离程度大于CH3COO-的水解程度,所以c(CH3COO-)>c(CH3COOH),A项不正确;
c点时,溶质为CH3COOH和CH3COONa,且水的电离不受影响,则溶液呈中性;e点时,溶质为CH3COONa和NaOH,二者都呈碱性,所以溶液显碱性,B项正确;
f点,若CH3COO-不发生水解则溶质组成为等物质的量的CH3COONa和NaOH,但因CH3COO-发生水解,导致c(CH3COO-)减小、c(OH-)增大,所以溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+),D项不正确。
下列说法错误的是A.常温下,MOH的电离常数约为1×10-5B.E、F、G和P点中,G点水电离程度最大C.G点对应的溶液中:c(Cl-)>c(M+)>c(H+)>c(OH-)D.P点溶液中:c(Cl-)=2c(MOH)+2c(M+)
5.(2022·湖南湘潭一模)H2CO3和H2C2O4都是二元弱酸,常温下,不同pH环境下它们不同形态的粒子的组成百分率如图所示。下列说法错误的是
A.由图可知,草酸酸性比碳酸的强
a→b的过程中pH增大,溶液酸性减弱,水的电离程度增大,故C项错误;
7.(2022·山东模拟)常温下,用不同浓度的NaOH溶液分别滴定20 mL与其同浓度的某弱酸HA(电离常数为Ka)溶液,滴定曲线如图所示。下列说法不正确的是
B.Ka1(H2X)=1.0×10-溶液中c(OH-)>c(H+)D.当pH=7时,混合溶液中c(Na+)=c(HX-)+2c(X2-)+c(Cl-)
根据B可知HX-的电离平衡常数为1.0×10-10.3;
说明HX-的水解程度大于其电离程度,则NaHX溶液呈碱性,c(H+)<c(OH-),C项正确;当溶液呈中性时,c(H+)=c(OH-),根据电荷守恒可知:c(Na+)=c(HX-)+2c(X2-)+c(Cl-),D项正确。
新高考化学一轮复习课件第9章 第56讲 反应过程中溶液粒子浓度变化的图像分析(含解析): 这是一份新高考化学一轮复习课件第9章 第56讲 反应过程中溶液粒子浓度变化的图像分析(含解析),共60页。PPT课件主要包含了滴定过程pH变化曲线,必备知识,关键能力,分布系数曲线,真题演练明确考向,课时精练等内容,欢迎下载使用。
备战2025届新高考化学一轮总复习第8章水溶液中的离子反应与平衡第43讲反应过程中微粒浓度变化及图像分析课件: 这是一份备战2025届新高考化学一轮总复习第8章水溶液中的离子反应与平衡第43讲反应过程中微粒浓度变化及图像分析课件,共55页。PPT课件主要包含了课标指引,目录索引,素养发展进阶,必备知识•梳理,关键能力•提升,⑤④③①②,③②④①,②①③,④②③①等内容,欢迎下载使用。
新高考化学一轮复习精品课件 第9章 第56讲 反应过程中溶液粒子浓度变化的图像分析 (含解析): 这是一份新高考化学一轮复习精品课件 第9章 第56讲 反应过程中溶液粒子浓度变化的图像分析 (含解析),共60页。PPT课件主要包含了内容索引,滴定过程pH变化曲线,必备知识,CH3COOH,CH3COONa,cNa+,NaOH,关键能力,分布系数曲线,真题演练明确考向等内容,欢迎下载使用。












