

所属成套资源:新高考化学一轮复习考点过关练 (含解析)
新高考化学一轮复习考点过关练考向01 物质的量 气体摩尔体积(含解析)
展开
这是一份新高考化学一轮复习考点过关练考向01 物质的量 气体摩尔体积(含解析),共13页。
【2022广东卷】我国科学家进行了如图所示的碳循环研究。下列说法正确的是
A.淀粉是多糖,在一定条件下能水解成葡萄糖
B.葡萄糖与果糖互为同分异构体,都属于烃类
C.中含有个电子
D.被还原生成
【答案】A
【解析】A.淀粉是由葡萄糖分子聚合而成的多糖,在一定条件下水解可得到葡萄糖,故A正确;
B.葡萄糖与果糖的分子式均为C6H12O6,结构不同,二者互为同分异构体,但含有O元素,不是烃类,属于烃的衍生物,故B错误;
C.一个CO分子含有14个电子,则1mlCO中含有14×6.02×1023=8.428×1024个电子,故C错误;
D.未指明气体处于标况下,不能用标况下的气体摩尔体积计算其物质的量,故D错误;
答案选A。
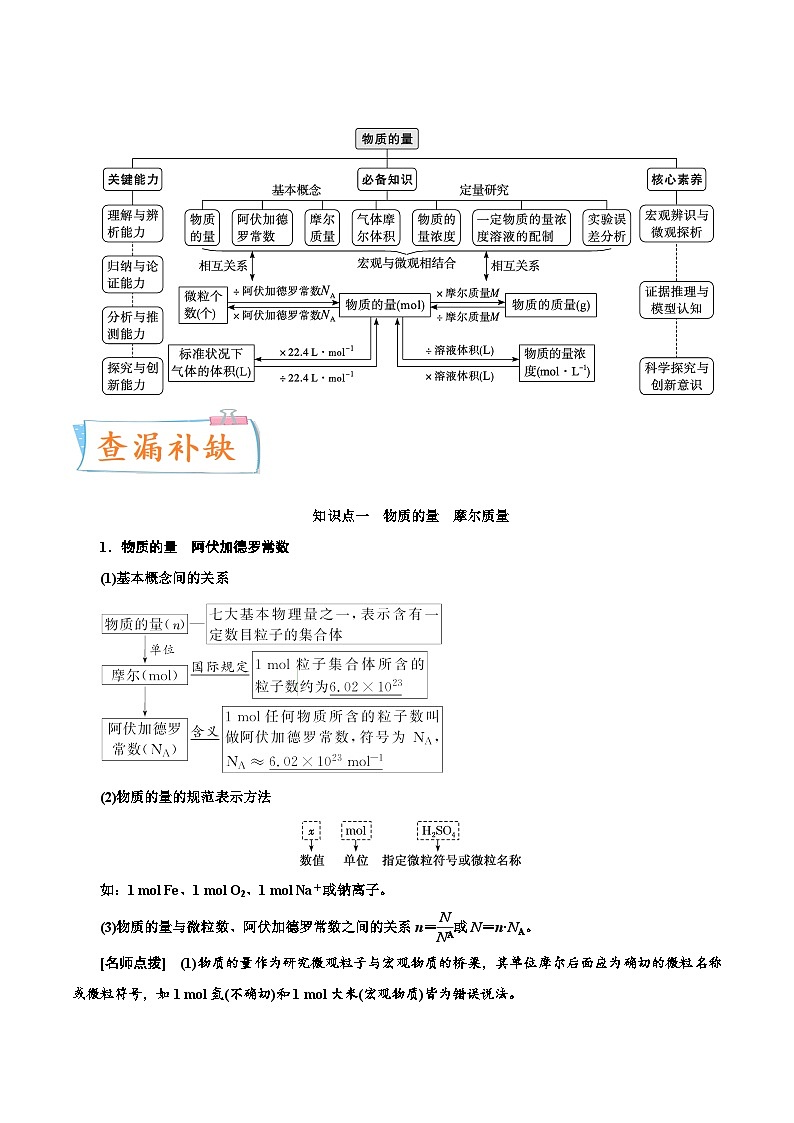
知识点一 物质的量 摩尔质量
1.物质的量 阿伏加德罗常数
(1)基本概念间的关系
(2)物质的量的规范表示方法
如:1 ml Fe、1 ml O2、1 ml Na+或钠离子。
(3)物质的量与微粒数、阿伏加德罗常数之间的关系n= eq \f(N,NA) 或N=n·NA。
[名师点拨] (1)物质的量作为研究微观粒子与宏观物质的桥梁,其单位摩尔后面应为确切的微粒名称或微粒符号,如1 ml氢(不确切)和1 ml大米(宏观物质)皆为错误说法。
(2)物质的量描述的对象只能是微观粒子,如电子、质子、中子、原子、分子、离子、原子团等,不能用于描述宏观物质。
2.摩尔质量
(1)概念:单位物质的量的物质所具有的质量,单位:g·ml-1。
(2)数值:当微粒的摩尔质量以g·ml-1为单位时,在数值上等于该微粒的相对分子(原子)质量。
(3)物质的量、物质的质量与摩尔质量的关系为n= eq \f(m,M) 。
[名师点拨] 摩尔质量、相对分子质量、1 ml物质的质量在数值上是相同的,但三者的含义不同,单位不同。摩尔质量的单位是g·ml-1,相对原子(分子)质量的单位是1,1 ml物质的质量单位是g。
3.求解气体摩尔质量“五方法”
(1)根据物质的质量(m)和物质的量(n):M= eq \f(m,n) 。
(2)根据一定质量(m)的物质中微粒数目(N)和阿伏加德罗常数(NA):M=NA· eq \f(m,N) 。
(3)根据标准状况下气体的密度(ρ):
M=ρ×22.4(g·ml-1)。
(4)根据同温同压下气体的相对密度 eq \b\lc\(\rc\)(\a\vs4\al\c1(D=\f(ρ1,ρ2))) : eq \f(M1,M2) =D。
(5)对于混合气体,求其平均摩尔质量,上述计算式仍然成立;还可以用下式计算:M=M1×a%+M2×b%+M3×c%……a%、b%、c%指混合物中各成分的物质的量分数(或体积分数)。
知识点二 气体的摩尔体积 阿伏加德罗定律
1.影响物质体积大小的因素
2.气体摩尔体积(Vm)
(1)概念:单位物质的量的气体所占的体积,单位为L·ml-1(或L/ml)和m3/ml(或m3·ml-1)。
(2)特例:标准状况(0_℃,101_kPa)下,Vm为22.4_L·ml-1。
(3)气体摩尔体积与物质的量、气体体积之间的关系为n= eq \f(V,Vm) 。
[名师点拨] 抓“两看”,突破气体与状况陷阱
一看:气体是否处于标准状况(0 ℃、101 kPa)。
二看:标准状况下,物质是否是气态。常见干扰物质:
①无机物Br2、SO3、H2O、HF等;②有机物中碳原子数大于4的烃,如苯、己烷等;③有机物中烃的衍生物CCl4、氯仿、乙醇等。
若题中给出非标准状况下的气体,切勿直接判断为错误说法,气体的物质的量或质量与温度、压强无关,可直接计算。
3.阿伏加德罗定律及其推论
(1)阿伏加德罗定律:在同温同压下,相同体积的任何气体都含有相同数目的分子。
(2)推论
1.设阿伏加德罗常数的值为NA,下列说法正确的是( )
A.标准状况下,2.24 L CH3OH分子中共价键的数目为0.5NA
B.1 ml Na2O2与足量CO2充分反应,转移的电子数为2NA
C.用浓盐酸分别和KMnO4、KClO3反应制备1 ml氯气,转移的电子数均为2NA
D.5.6 g Fe粉与足量S粉加热充分反应转移的电子数为0.2NA
2.下列说法中正确的是(NA为阿伏加德罗常数的值)( )
A.O2-的电子式为,则O2-核外有8个电子
B.1 ml NH4Cl中含有的H—Cl键的数目为NA
C.CrO5中Cr元素的化合价为+6价,每个CrO5分子中存在两个过氧键
D.20 g Na2O和Na2O2的混合物中,所含阴、阳离子数目之比无法确定
3.据央视新闻报道,在政府工作报告中指出,建设一批光网城市,推进5万个行政村通光纤,让更多城乡居民享受数字化生活。光缆的主要成分为SiO2。下列叙述正确的是( )
A.SiO2的摩尔质量为60
B.标准状况下,15 g SiO2的体积为5.6 L
C.SiO2中Si与O的质量比为7∶8
D.相同质量的SiO2和CO2中含有的氧原子数相同
4.用NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
A.1 ml甲基(—CH3)所含的电子数为10NA
B.常温常压下,1 ml分子式为C2H6O的有机物中,含有C—O键的数目为NA
C.14 g由乙烯和环丙烷()组成的混合气体中,含有的原子总数为3NA
D.标准状况下,22.4 L四氯化碳中含有共用电子对的数目为4NA
5.空气中二氧化碳含量的持续增加,会产生温室效应,一种处理二氧化碳的重要方法是将二氧化碳还原:CO2(g)+4H2(g) eq \(,\s\up7(Ru)) CH4(g)+2H2O(g)。下列说法(NA代表阿伏加德罗常数的值)正确的是( )
A.2.24 L CO2含有双键的数目为0.2NA
B.1 ml CO2和2 ml H2充分反应生成CH4的分子数为0.5NA
C.通常状况下,0.1 ml CH4中含有的电子数为NA
D.生成18 g H2O转移电子数为8NA
1.设NA为阿伏加德罗常数的值。下列说法正确的是
A.2.0 g D2中含有的中子数目为0.8NA
B.4.6 g C2H6O中含有C-H键的数目一定为0.6NA
C.常温下,将2.8 g Fe置于足量的浓硝酸中,转移的电子数目一定为0.15NA
D.11.2 L(标准状况)由甲烷和乙烯组成的混合气体中含有氢原子数目为2NA
2.(广东省汕头市2022届高三下学期第一次模拟考试)2021年,我国科学家首次在实验室实现到淀粉的全合成,其合成路线如下:设为阿伏伽德罗常数,下列有关说法不正确的是
A.标况下,11.2L 中含有共用电子对数目为2
B.反应②、③无法在高温下进行
C.反应②中,3.2g 生成HCHO时转移电子数目为0.2
D.1ml DHA与乙酸发生取代反应,可消耗乙酸分子数目为
3.(广东省汕头市潮阳黄图盛中学2021-2022学年高三下学期一模检验)设阿伏加德罗常数的数值为NA,下列说法正确的是
A.1L 1 ml·L-1 的NaHCO3溶液中含有的离子数为3NA
B.22.4 L的CO2与过量Na2O2充分反应转移的电子数为NA
C.常温下,2.7 g铝片投入足量的浓硫酸中,铝失去的电子数为0.3NA
D.常温常压下,14g由N2与CO组成的混合气体含有的原子数目为NA
4.设NA为阿伏加德罗常数的值,下列说法不正确的是
A.1L0.1ml·L-1Fe2(SO4)3溶液中含有的阳离子数目小于0.2NA
B.0.24g Mg在O2和CO2的混合气体中完全燃烧,转移电子数为0.02NA
C.3g由CO2和SO2组成的混合气体中含有的质子数为1.5NA
D.1mlNa2O2与SO2完全反应,转移电子数为2NA
5.设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.14.0gFe发生吸氧腐蚀生成Fe2O3·xH2O,电极反应转移的电子数为0.5NA
B.标准状况下,11.2LH2S溶于水,溶液中含硫粒子的数目大于0.5NA
C.常温下,0.5LpH=14的Ba(OH)2溶液中Ba2+的数目为0.5NA
D.向100mL0.5ml·L-1Fe(NO3)3溶液中通入足量SO2气体,转移电子数为0.05NA
1.(2022·全国甲卷)为阿伏加德罗常数的值,下列说法正确的是
A.25℃,下,氢气中质子的数目为
B.溶液中,的数目为
C.苯甲酸完全燃烧,生成的数目为
D.电解熔融,阴极增重,外电路中通过电子的数目为
2.(2022·浙江卷6月)为阿伏加德罗常数的值,下列说法正确的是
A.中含有个阳离子
B.乙烷和丙烯的混合气体中所含碳氢键数为
C.含有中子数为
D.和于密闭容器中充分反应后,分子总数为
3.(2022·浙江卷1月)设NA为阿伏加德罗常数的值,下列说法正确的是
A.在25℃时,1LpH为12的Ba(OH)2溶液中含有OH-数目为0.01NA
B.1.8g重水(D2O)中所含质子数为NA
C.足量的浓盐酸与8.7gMnO2反应,转移电子的数目为0.4NA
D.32g甲醇的分子中含有C—H键的数目为4NA
4.(2021广东)设为阿伏加德罗常数的值。下列说法正确的是
A.含有键的数目为
B.的盐酸含有阴离子总数为
C.与混合后的分子数目为
D.与足量反应生成的分子数目为
5.(2021全国甲卷)为阿伏加德罗常数的值。下列叙述正确的是
A.重水()中含有的质子数为
B.的与完全反应时转移的电子数为
C.环状()分子中含有的键数为
D.的溶液中离子数为
1.【答案】D
【解析】标准状况下,CH3OH是液体,2.24 L CH3OH的物质的量不是0.1 ml,故A错误;Na2O2与CO2的反应中,Na2O2既是氧化剂又是还原剂,1 ml Na2O2与足量CO2充分反应,转移的电子数为NA,故B错误;浓盐酸和KMnO4反应制备氯气,氯气是氧化产物,生成1 ml氯气转移2 ml电子;浓盐酸和KClO3反应制备氯气,氯气既是氧化产物又是还原产物,生成1 ml氯气转移 eq \f(5,3) ml电子,故C错误;Fe粉与足量S粉反应生成硫化亚铁,5.6 g Fe粉与足量S粉加热充分反应转移的电子数为0.2NA,故D正确。
2.【答案】C
【解析】O2-的电子式为,表示O2-的最外层有8个电子,但其核外有10个电子,A错误;NH4Cl是离子化合物,NH eq \\al(\s\up11(+),\s\d4(4)) 与Cl-间形成离子键,无H—Cl共价键存在,B错误;根据化合物中所有元素化合价的代数和为0原则,CrO5中5个O共为-6价,说明以-1价氧存在的共有两个过氧根,一个氧化合价为-2价,C正确;Na2O和Na2O2都是离子化合物,其中含有的阴、阳离子数目之比都是1∶2,与物质质量的多少无关,D错误。
3.【答案】C
【解析】摩尔质量的单位为g·ml-1,A项错误;标准状况下SiO2为固体,B项错误;SiO2中Si与O的质量比为28∶32=7∶8,C项正确;SiO2和CO2的摩尔质量不同,D项错误。
4.【答案】C
【解析】1个甲基中含有9个电子,则1 ml甲基(—CH3)所含的电子数为9NA,A错误;分子式为C2H6O的有机物可能是乙醇(CH3CH2OH),1个乙醇分子中含1个C—O键,也可能是二甲醚(CH3—O—CH3),1个二甲醚分子中含2个C—O键,故不能确定其中含有的C—O键的数目,B错误;乙烯和环丙烷()的最简式都是CH2,1个最简式中含有3个原子,14 g由乙烯和环丙烷()组成的混合气体中含有最简式的物质的量是1 ml,因此含有的原子总数为3NA,C正确;在标准状况下四氯化碳呈液态,不能用气体摩尔体积计算四氯化碳的物质的量,D错误。
5.【答案】C
【解析】A项,没有指明是在标准状况下,错误;B项,该反应为可逆反应,不能进行到底,1 ml CO2和2 ml H2充分反应不能生成0.5 ml CH4,即CH4分子数小于0.5NA,错误;C项,由于1个CH4中含有10个电子,则0.1 ml CH4中含有的电子数为NA,与条件无关,正确;D项,分析化学方程式知,每生成2 ml 水转移8 ml电子,若生成18 g H2O(即1 ml)则转移电子数为4NA,错误。
1.【答案】D
【详解】
A.D2的相对分子质量是4,其中含有2个中子,2.0 g D2的物质的量是0.5 ml,则其中含有的中子数目为NA,A错误;
B.4.6 g C2H6O的物质的量是0.1 ml,由于C2H6O表示的物质可能是乙醇,也可能是而甲醚,因此不能根据其质量计算其中含有的C-H键的数目,B错误;
C.浓硝酸具有强氧化性,在常温下浓硝酸遇铁、铝会在金属表面氧化产生一薄层致密的氧化物保护膜,阻止金属的进一步反应,即发生钝化现象,因此不能计算反应过程中转移的电子数目,C错误;
D.标准状况下11.2 L由甲烷和乙烯组成的混合气体的物质的量是0.5 ml,由于CH4、C2H4分子中都含有4个H原子,因此0.5 ml混合气体中含有的H原子数目为2NA,D正确;
故合理选项是D。
2.【答案】D
【详解】
A.的结构式为O=C=O,标况下11.2L 中含有共用电子对数目为,故A正确;
B.反应②、③需要用酶作2催化剂,反应②、③无法在高温下进行,故B正确;
C.反应②中,3.2g 生成HCHO时转移电子数目为,故C正确;
D.DHA含有2个羟基,1ml DHA与乙酸发生取代反应,可消耗2ml乙酸,故D错误;
选D。
3.【答案】D
【详解】
A.HCO3-不能完全电离,部分发生水解,因此1L、1 ml·L-1的NaHCO3溶液中含有的离子数小于3NA,故A错误;
B.未注明气体的状况,无法确定气体的物质的量,故B错误;
C.铝片遇到冷的浓硫酸会钝化,铝失去的电子数小于0.3NA,故C错误;
D.氮气和一氧化碳的摩尔质量都是28g/ml,都是双原子分子,14g由N2与CO组成的混合气体的物质的量为:=0.5ml,含有1ml原子,含有的原子数目为NA,故D正确;
故答案为D。
4.【答案】A
【解析】
A. 铁离子在溶液中水解导致阳离子个数增多,故溶液中阳离子个数多于0.2NA个,故A错误;
B. 0.24g Mg为0.01ml,Mg在O2和CO2的混合气体中完全燃烧生成MgO,失去0.02ml电子,则转移电子数为0.02NA,故B正确;
C. CO2的摩尔质量为44g/ml,含22个质子;SO2的摩尔质量为64g/ml,含32个质子,即两者均是2g中含1ml质子,故3g混合物中含1.5ml质子即1.5NA个质子,故C正确;
D.过氧化钠与二氧化硫反应生成硫酸钠,1ml过氧化钠中的−1价的氧原子变为−2价,故1ml过氧化钠转移2ml电子即2NA个,故D正确;
答案选A。
5.【答案】A
【解析】
A.铁发生吸氧腐蚀电极反应式:Fe−2e−=Fe2+,14.0gFe物质的量为=0.25ml,转移电子数为:0.25ml×2×NA=0.5NA,故A正确;
B.硫化氢为弱电解质,水溶液中不能完全电离,依据原子个数守恒可知:标准状况下,11.2LH2S物质的量为0.5ml,溶液中含硫粒子的数目等于0.5NA,故B错误;
C.pH=14的Ba(OH)2溶液中氢氧根离子浓度为1ml/L,0.5LpH=14的Ba(OH)2溶液含氢氧根离子物质的量为0.5ml,所以钡离子物质的量为0.25NA,故C错误;
D.100mL0.5ml·L-1Fe(NO3)3溶液中n(Fe3+)=0.05ml,n(NO3-)=0.15ml,通入足量SO2气体,Fe3+会被还原为Fe2+,NO3-会被还原为NO,转移电子数大于0.05NA,故D错误;
故答案选A。
1.【答案】C
【解析】A.25℃、101kPa不是标准状况,不能用标况下的气体摩尔体积计算氢气的物质的量,故A错误;
B.Al3+在溶液中会发生水解生成Al(OH)3,因此2.0L 1.0 ml/L的AlCl3溶液中Al3+数目小于2.0NA,故B错误;
C.苯甲酸燃烧的化学方程式为,1ml苯甲酸燃烧生成7mlCO2,则0.2ml苯甲酸完全燃烧生成1.4mlCO2,数目为1.4NA,故C正确;
D.电解熔融CuCl2时,阳极反应为,阴极反应为,阴极增加的重量为Cu的质量,6.4gCu的物质的量为0.1ml,根据阴极反应可知,外电路中通过电子的物质的量为0.2ml,数目为0.2NA,故D错误;
答案选C。
2.【答案】C
【解析】A. 由钠离子和硫酸氢根离子构成,其中的阳离子只有钠离子,的物质的量为0.1ml,因此,其中只含有个阳离子,A说法不正确;
B.没有指明气体的温度和压强,无法确定乙烷和丙烯的混合气体的物质的量是多少,因此,无法确定其中所含碳氢键的数目,B说法不正确;
C.分子中有6个中子,的物质的量为0.5ml,因此,含有的中子数为,C说法正确;
D.和发生反应生成,该反应是可逆反应,反应物不能完全转化为生成物,因此,和于密闭容器中充分反应后,分子总数小于,D说法不正确。
综上所述,本题选C。
3.【答案】A
【详解】
A.1LpH为12的Ba(OH)2溶液中含有OH-的浓度为0.01ml/L,物质的量0.01ml/L 1L=0.01ml,OH-的数目为0.01NA,A正确;
B.1.8g重水(D2O)的物质的量为:0.09ml,所含质子数为0.9NA,B错误;
C.足量的浓盐酸与8.7gMnO2(0.1ml)反应,+4价Mn转化生成Mn2+,转移电子的数目为0.2NA,C错误;
D.甲醇的结构简式为:CH3OH,32g (1ml)的分子中含有C—H键的数目为3NA,D错误;
答案选A。
4.【答案】A
【详解】
A.1个分子中含有3个键,微粒个数与物质的量成正比,故含有3ml键,键的数目为,A正确;
B.盐酸为氯化氢的水溶液,氯化氢会全部电离出阴离子Cl-,水会部分电离出阴离子OH-,水的质量及电离程度未知,故无法计算的盐酸含有阴离子总数,B错误;
C.未提到具体的温度、压强(如标况下),故无法计算与混合后的分子数目,C错误;
D.为1ml,钠与足量的水反应生成氢气的关系式为:,故1ml Na应对应生成0.5ml H2,分子数目应为0.5,D错误;
故选A。
5.【答案】C
【详解】
A.的质子数为10,18g的物质的量为 0.9ml, 则重水()中所含质子数为,A错误;
B.与反应的化学方程式为:3NO2+H2O=2HNO3+NO,该反应消耗3个NO2分子转移的电子数为2个,则有3ml的NO2参与反应时,转移的电子数为,B错误;
C.一个()分子中含有的键数为8个,32gS8的物质的量为ml,则含有的键数为,C正确;
D.酸性溶液中存在:,含Cr元素微粒有和,则的溶液中离子数应小于,D错误;
故选C。
相同条件
结论
公式
语言叙述
T、p相同
eq \f(n1,n2) = eq \f(V1,V2)
同温、同压下,气体的物质的量与其体积成正比
T、p相同
eq \f(ρ1,ρ2) = eq \f(M1,M2)
同温、同压下,气体的密度与其摩尔质量成正比
T、V相同
eq \f(p1,p2) = eq \f(n1,n2)
同温、同体积下,气体的压强与其物质的量成正比
相关试卷
这是一份人教版高考化学一轮复习考点练3物质的量气体摩尔体积含答案,共9页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
这是一份2022年高考化学一轮复习考点分层练专题01 物质的量 气体摩尔体积,共12页。试卷主要包含了NA代表阿伏加德罗常数的值,设NA表示阿伏加德罗常数的值,下列说法正确的是,用NA表示阿伏加德罗常数的值等内容,欢迎下载使用。
这是一份高考化学一轮复习考点规范练1物质的量气体摩尔体积 人教版(含答案解析),共6页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。








