
所属成套资源:新高考化学一轮复习考点过关练 (含解析)
新高考化学一轮复习考点过关练考向20 原电池 化学电源(含解析)
展开
这是一份新高考化学一轮复习考点过关练考向20 原电池 化学电源(含解析),共19页。
【2022·广东卷】科学家基于易溶于的性质,发展了一种无需离子交换膜的新型氯流电池,可作储能设备(如图)。充电时电极a的反应为: 。下列说法正确的是
A.充电时电极b是阴极
B.放电时溶液的减小
C.放电时溶液的浓度增大
D.每生成,电极a质量理论上增加
【答案】C
【解析】A.由充电时电极a的反应可知,充电时电极a发生还原反应,所以电极a是阴极,则电极b是阳极,故A错误;
B.放电时电极反应和充电时相反,则由放电时电极a的反应为可知,NaCl溶液的pH不变,故B错误;
C.放电时负极反应为,正极反应为,反应后Na+和Cl-浓度都增大,则放电时NaCl溶液的浓度增大,故C正确;
D.充电时阳极反应为,阴极反应为,由得失电子守恒可知,每生成1mlCl2,电极a质量理论上增加23g/ml2ml=46g,故D错误;
答案选C。
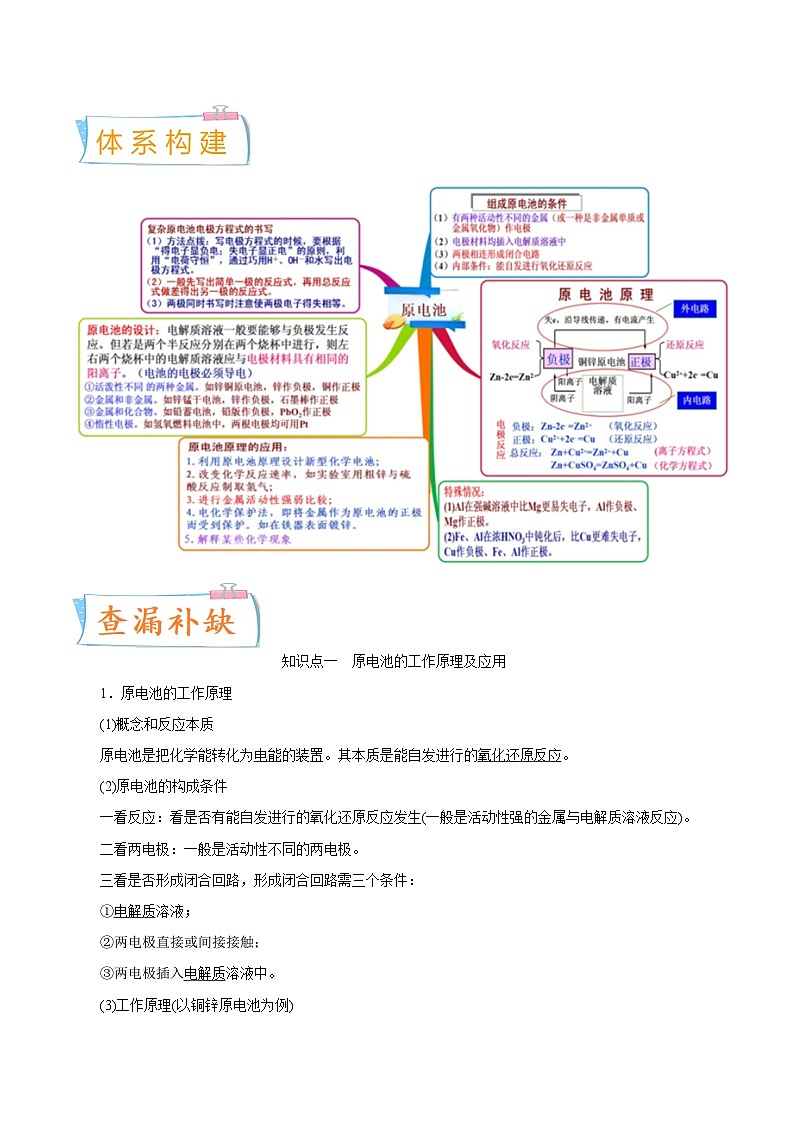
知识点一 原电池的工作原理及应用
1.原电池的工作原理
(1)概念和反应本质
原电池是把化学能转化为电能的装置。其本质是能自发进行的氧化还原反应。
(2)原电池的构成条件
一看反应:看是否有能自发进行的氧化还原反应发生(一般是活动性强的金属与电解质溶液反应)。
二看两电极:一般是活动性不同的两电极。
三看是否形成闭合回路,形成闭合回路需三个条件:
①电解质溶液;
②两电极直接或间接接触;
③两电极插入电解质溶液中。
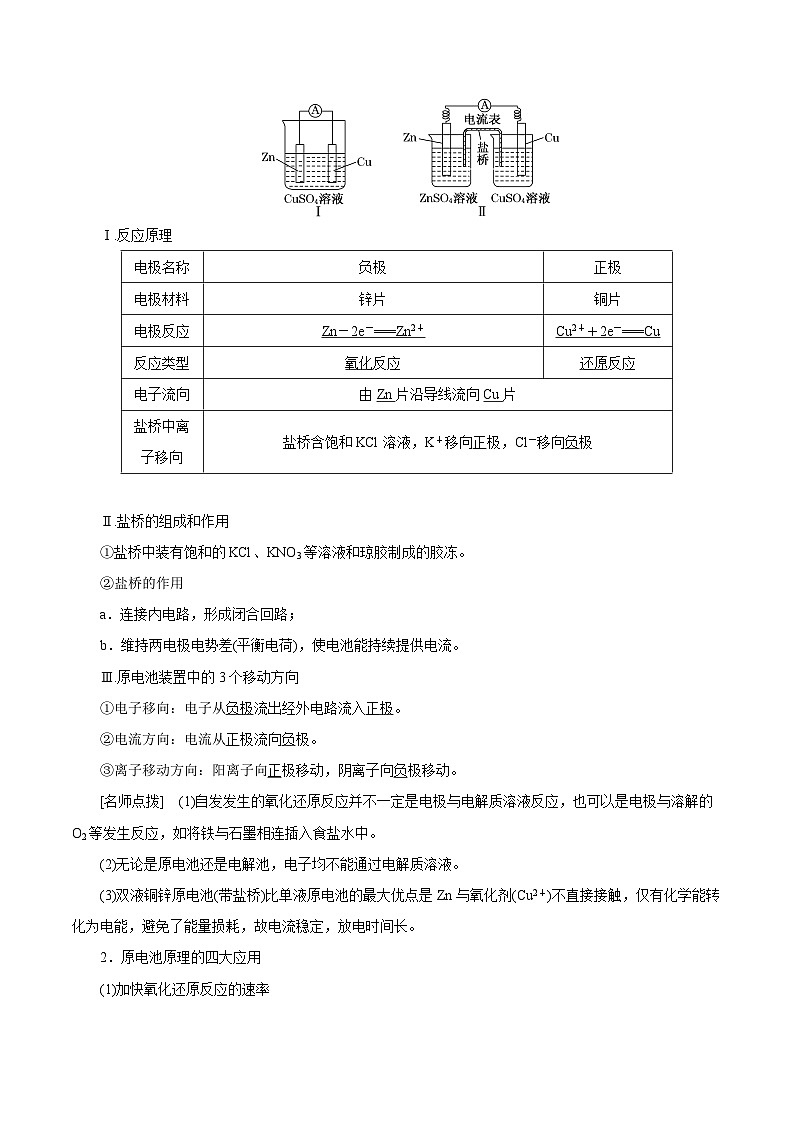
(3)工作原理(以铜锌原电池为例)
Ⅰ.反应原理
Ⅱ.盐桥的组成和作用
①盐桥中装有饱和的KCl、KNO3等溶液和琼胶制成的胶冻。
②盐桥的作用
a.连接内电路,形成闭合回路;
b.维持两电极电势差(平衡电荷),使电池能持续提供电流。
Ⅲ.原电池装置中的3个移动方向
①电子移向:电子从负极流出经外电路流入正极。
②电流方向:电流从正极流向负极。
③离子移动方向:阳离子向正极移动,阴离子向负极移动。
[名师点拨] (1)自发发生的氧化还原反应并不一定是电极与电解质溶液反应,也可以是电极与溶解的O2等发生反应,如将铁与石墨相连插入食盐水中。
(2)无论是原电池还是电解池,电子均不能通过电解质溶液。
(3)双液铜锌原电池(带盐桥)比单液原电池的最大优点是Zn与氧化剂(Cu2+)不直接接触,仅有化学能转化为电能,避免了能量损耗,故电流稳定,放电时间长。
2.原电池原理的四大应用
(1)加快氧化还原反应的速率
一个自发进行的氧化还原反应,形成原电池时会使反应速率加快。例如,在Zn与稀H2SO4反应时加入少量CuSO4溶液置换出的Cu能与Zn形成原电池使产生H2的反应速率加快。
(2)比较金属活动性强弱
如有两种金属A和B,用导线将A和B连接后,插入到稀硫酸中,一段时间后,若观察到A溶解,而B上有气体放出,则说明A作负极,B作正极,即可以断定金属活动性:A eq \a\vs4\al(>) B。
(3)设计制作化学电源
实例:根据Cu+2Ag+===Cu2++2Ag设计电池:
(4)用于金属的防护(牺牲阳极的阴极保护法)
使被保护的金属制品作原电池正极而得到保护。例如,要保护一个铁质的输水管道或钢铁桥梁等,可用导线将其与一块锌块相连,使锌作原电池的负极。
知识点二 常见的化学电源
1.一次电池——不能充电复原继续使用
(1)碱性锌锰干电池
正极反应:2MnO2+2H2O+2e-===2MnO(OH)+2OH-;
负极反应:Zn+2OH--2e-===Zn(OH)2;
总反应:Zn+2MnO2+2H2O===2MnO(OH)+Zn(OH)2。
(2)锌银电池
负极反应:Zn+2OH--2e-===Zn(OH)2;
正极反应:Ag2O+H2O+2e-===2Ag+2OH-;
总反应:Zn+Ag2O+H2O===Zn(OH)2+2Ag。
(3)锂电池
LiSOCl2电池可用于心脏起博器,该电池的电极材料分别为锂和碳,电解液是LiAlCl4SOCl2,电池总反应可表示为4Li+2SOCl2===4LiCl+SO2↑+S。其中负极材料是Li,电极反应为4Li-4e-===4Li+,正极反应为2SOCl2+4e-===SO2↑+S↓+4Cl-。
2.二次电池——放电后能充电复原继续使用
铅蓄电池是最常见的二次电池,负极材料是 eq \a\vs4\al(Pb) ,正极材料是PbO2。总反应为Pb(s)+PbO2(s)+2H2SO4(aq) eq \(,\s\up7(放电),\s\d5(充电)) 2PbSO4(s)+2H2O(l)。
[名师点拨] 可充电电池充电时原来的负极发生还原反应(生成原来消耗的物质),即作阴极,连接电源的负极;同理,原来的正极连接电源的正极作阳极,简记为负连负,正连正。
3.“高效、环境友好”的燃料电池
氢氧燃料电池是目前最成熟的燃料电池,分为酸性和碱性两种。
[名师点拨] (1)燃料电池的电极不参与反应,有很强的催化活性,起导电作用。
(2)书写燃料电池的电极反应时,要注意溶液的酸、碱性,介质的酸碱性对半反应及总反应书写的影响。
知识点三 电极反应式的书写
1.原电池电极反应式的书写
书写电极反应式时,首先要根据原电池的工作原理准确判断正、负极,然后结合电解质溶液的环境确定电极产物,最后再根据质量守恒和电荷守恒写出电极反应式。
(1)书写步骤
(2)书写方法
①拆分法
a.写出原电池的总反应,如2Fe3++Cu===2Fe2++Cu2+。
b.把总反应按氧化反应和还原反应拆分为两个半反应,注明正、负极,并依据质量守恒、电荷守恒及电子得失守恒配平两个半反应:
正极:2Fe3++2e-===2Fe2+
负极:Cu-2e-===Cu2+
②加减法
a.写出总反应,如Li+LiMn2O4===Li2Mn2O4。
b.写出其中容易写出的一个半反应(正极或负极),如Li-e-===Li+(负极)。
c.利用总反应式与上述的一极反应式相减,即得另一个电极的反应式,即LiMn2O4+Li++e-===Li2Mn2O4(正极)。
2.燃料电池电极反应式的书写
第一步:写出燃料电池反应的总反应式
燃料电池的总反应与燃料的燃烧反应一致,若产物能和电解质反应则总反应为加和后的反应。
如甲烷燃料电池(电解质为NaOH溶液)的反应式为
CH4+2O2===CO2+2H2O①
CO2+2NaOH===Na2CO3+H2O②
①式+②式得燃料电池总反应式为
CH4+2O2+2NaOH===Na2CO3+3H2O。
第二步:写出电池的正极反应式
根据燃料电池的特点,一般在正极上发生还原反应的物质是O2,随着电解质溶液的不同,其电极反应式有所不同,大致有以下四种情况:
①酸性电解质溶液环境下电极反应式:
O2+4H++4e-===2H2O;
②碱性电解质溶液环境下电极反应式:
O2+2H2O+4e-===4OH-;
③固体电解质(高温下能传导O2-)环境下电极反应式:O2+4e-===2O2-;
④熔融碳酸盐(如熔融K2CO3)环境下电极反应式:
O2+2CO2+4e-===2CO eq \\al(\s\up1(2-),\s\d1(3)) 。
第三步:根据电池总反应式和正极反应式,写出负极反应式,电池反应的总反应式-电池正极反应式=电池负极反应式。因为O2不是负极反应物,因此两个反应式相减时要彻底消除O2。
[名师点拨] 燃料电池中产物的判断:
碱性介质:C―→CO eq \\al(\s\up1(2-),\s\d1(3)) ,其余介质:C―→CO2;
酸性介质:H―→H+,其余介质:H―→H2O。
1.某原电池装置如图所示。下列有关叙述中正确的是( )
A.电池工作时,盐桥中的Cl-向负极移动
B.负极反应式:2H++2e-===H2↑
C.工作一段时间后,两烧杯中溶液pH均不变
D.Fe作正极,发生氧化反应
2.锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过。下列有关叙述中正确的是( )
A.铜电极上发生氧化反应
B.电池工作一段时间后,甲池中的c(SO eq \\al(\s\up1(2-),\s\d1(4)) )减小
C.电池工作一段时间后,乙池溶液的总质量增加
D.阴、阳离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡
3.某学习小组的同学查阅相关资料得到氧化性:Cr2O eq \\al(\s\up1(2-),\s\d1(7)) >Fe3+,设计了如图所示的盐桥原电池。盐桥中装有含琼脂的饱和K2SO4溶液。下列叙述中正确的是( )
A.甲烧杯的溶液中发生还原反应
B.外电路的电流方向是从b极到a极
C.电池工作时,盐桥中的SO eq \\al(\s\up1(2-),\s\d1(4)) 移向乙烧杯
D.乙烧杯中的电极反应式为2Cr3++7H2O-6e-===Cr2O eq \\al(\s\up1(2-),\s\d1(7)) +14H+
4.某原电池以银、铂为电极,用含Ag+的固体作电解质,Ag+可在固体电解质中自由移动。电池总反应式为2Ag+Cl2===2AgCl。利用该电池可以测定空气中Cl2的含量。下列说法中错误的是( )
A.空气中c(Cl2)越大,消耗Ag的速率越快
B.铂极的电极反应式为Cl2+2e-+2Ag+===2AgCl
C.电池工作时电解质中Ag+总数保持不变
D.电子移动方向:银→固体电解质→铂
5.最近科学家研制的一种新型“微生物电池”可以将污水中的有机物转化为H2O和CO2,同时产生电能,其原理示意如图。下列有关该电池的说法中正确的是( )
A.氧化银电极上的反应为Ag2O+2e-===2Ag+O2-
B.石墨电极上的反应为C6H12O6+6H2O+24e-===6CO2↑+24H+
C.每转移4 ml电子,氧化银电极产生22.4 L CO2气体(标准状况)
D.每30 g C6H12O6参与反应,有4 ml H+经质子交换膜进入正极区
1.(广东省茂名市五校联盟2021-2022学年高三下学期第三次联考)新型化学电池Zn-、能量密度大、体积小、重量轻、寿命长、无污染。下列关于其放电时的说法错误的是
A.负极发生失电子的氧化反应B.将化学能转化为电能
C.在正极得电子D.阳离子向负极移动
2.(河南省大联考2022届高三第三次模拟)我国科学家成功研制出二次电池,在潮湿条件下的放电原理为,模拟装置如图所示(已知放电时,由负极向正极迁移)。下列说法正确的是
A.放电时,电流由镁极经外电路流向石墨极
B.放电时,正极的电极反应式为
C.充电时,阴极上放出,发生还原反应
D.充电时,当阳极质量净减12g时,转移了4ml电子
3.(甘肃省2022届高三第二次高考诊断考试)钠离子电池有耐低温。价格低廉,对环境友好等特点,因而具有巨大的市场前景。某水系钠离子二次电池反应为:2NaFePO4F+Na3Ti2(PO4)32Na2FePO4F+NaTi2(PO4)3,其装置如图所示。下列说法不正确的是
A.充电时a为阴极
B.放电时b极上的电极反应为NaFePO4F+e-+Na+=Na2FePO4F
C.理论上,该电池在充电或放电过程中溶液中的c(Na+)不变
D.当电路中有0.2mle-通过时,通过交换膜的离子数目为0.1NA
4.(广东省佛山市2021-2022学年高三上学期普通高中第一次教学质量检测)一款新型-空气电池装置如图所示、该电池利用“多孔”石墨电极形成空气通道,放电时生成的NaOx填充在“空位”中,当“空位”填满后,放电终止。下列说法正确的是
A.a极为电池正极
B.b极发生电极反应:
C.选用“多孔”石墨电极是为了增加“空位”,提高电池能量存储
D.理论上a极每减重46 g,则b极消耗氧气约22.4 L
5.(广东省珠海市2022届高三上学期摸底测试) 肼(N2H4)燃料电池是一种理想的电池,产物无污染,其工作原理如图所示,下列叙述正确的是
A.当消耗lmlO2时,负极生成1ml气体
B.电池工作时,负极的pH升高
C.正极反应为O2+4e-+4H+=2H2O
D.X最好用阴离子交换膜
1.(2022·湖南卷)海水电池在海洋能源领域备受关注,一种锂-海水电池构造示意图如下。下列说法错误的是
A.海水起电解质溶液作用
B.N极仅发生的电极反应:
C.玻璃陶瓷具有传导离子和防水的功能
D.该锂-海水电池属于一次电池
2.(2022·全国甲卷)一种水性电解液Zn-MnO2离子选择双隔膜电池如图所示(KOH溶液中,Zn2+以Zn(OH)存在)。电池放电时,下列叙述错误的是
A.Ⅱ区的K+通过隔膜向Ⅲ区迁移
B.Ⅰ区的SO通过隔膜向Ⅱ区迁移
C. MnO2电极反应:MnO2+2e-+4H+=Mn2++2H2O
D.电池总反应:Zn+4OH-+MnO2+4H+=Zn(OH)+Mn2++2H2O
3.(2019上海高考真题)关于下列装置,叙述错误的是( )
A.石墨电极反应O2+4H++4e→2H2O
B.鼓入少量空气,会加快Fe的腐蚀
C.加入少量NaCl,会加快Fe的腐蚀
D.加入HCl,石墨电极反应式:2H++2e→H2
4.(2018浙江高考真题)锂(Li)—空气电池的工作原理如图所示下列说法不正确的是
A.金属锂作负极,发生氧化反应
B.Li+通过有机电解质向水溶液处移动
C.正极的电极反应:O2+4e—==2O2—
D.电池总反应:4Li+O2+2H2O==4LiOH
5.(2017浙江高考真题)金属(M)-空气电池的工作原理如图所示。下列说法不正确的是
A.金属M作电池负极
B.电解质是熔融的MO
C.正极的电极反应
D.电池反应
1. 【答案】A
【解析】根据原电池工作原理,阳离子向正极移动,阴离子向负极移动,盐桥的作用是构成闭合回路和平衡两烧杯中的电荷,所以Cl-向负极移动,故A正确;铁作负极,负极反应式为Fe-2e-===Fe2+,正极反应式为2H++2e-===H2↑,故B错误;左烧杯中pH基本不变,右烧杯中消耗H+,c(H+)减小,pH增大,故C错误;电池总反应式为Fe+2H+===Fe2++H2↑,铁作负极,发生氧化反应,故D错误。
2. 【答案】C
【解析】活泼金属锌作负极,铜作正极,铜电极上发生还原反应,故A错误;电池工作一段时间后,甲池中的c(SO eq \\al(\s\up1(2-),\s\d1(4)) )不变,故B错误;铜电极上发生电极反应:Cu2++2e-===Cu,同时Zn2+通过阳离子交换膜从甲池移向乙池,由电荷守恒可知,乙池中每析出1 ml Cu,则有1 ml Zn2+从甲池移向乙池,因为M(Zn)>M(Cu),所以乙池溶液的总质量增加,故C正确;阳离子交换膜只允许阳离子和水分子通过,阴离子不能通过阳离子交换膜,故D错误。
3. 【答案】B
【解析】由于氧化性:Cr2O eq \\al(\s\up1(2-),\s\d1(7)) >Fe3+,即Cr2O eq \\al(\s\up1(2-),\s\d1(7)) 可以将Fe2+氧化为Fe3+,故在原电池中,Fe2+失电子被氧化,则a极为负极;Cr2O eq \\al(\s\up1(2-),\s\d1(7)) 得电子被还原,则b极为正极。Fe2+失电子被氧化,即甲烧杯的溶液中发生氧化反应,A错误;外电路中电流由正极流向负极,即由b极流向a极,B正确;原电池中,阴离子移向负极,则SO eq \\al(\s\up1(2-),\s\d1(4)) 移向甲烧杯,C错误;乙烧杯中Cr2O eq \\al(\s\up1(2-),\s\d1(7)) 得电子被还原,则电极反应式为Cr2O eq \\al(\s\up1(2-),\s\d1(7)) +6e-+14H+===2Cr3++7H2O,D错误。
4. 【答案】D
【解析】c(Cl2)越大,反应速率越快,则消耗银的速率也越快,A正确;银比铂活泼,铂作正极,Cl2在铂上得到电子发生还原反应生成Cl-,再与电解质中的Ag+结合,电极反应式为Cl2+2e-+2Ag+===2AgCl,B正确;根据电池总反应式可知,电解质中Ag+总数保持不变,C正确;原电池中,电子从负极经过外电路的导线流向正极,电子不能通过电解质,故电子移动方向应是银→外电路导线→铂,D错误。
5. 【答案】D
【解析】C6H12O6在微生物作用下转化为CO2和H2O,C6H12O6被氧化,即石墨电极为负极,氧化银电极为正极,Ag2O发生得电子的还原反应,电极反应式为Ag2O+2H++2e-===2Ag+H2O,故A错误;石墨电极为负极,C6H12O6在负极发生失电子的氧化反应:C6H12O6+6H2O-24e-===6CO2↑+24H+,故B错误;根据负极的电极反应式可知,每转移4 ml电子,石墨电极产生22.4 L CO2(标准状况),故C错误;30 g C6H12O6的物质的量为 eq \f(30 g,180 g·ml-1) = eq \f(1,6) ml,根据B项负极的电极反应式可知,每30 g C6H12O6参与反应,有4 ml H+经质子交换膜进入正极区,故D正确。
1. 【答案】D
【详解】
A.原电池放电时,负极发生失电子的氧化反应,A正确;
B.原电池放电过程是将化学能转化为电能,B正确;
C.新型化学电池Zn-中,Zn作负极,在正极得电子,C正确;
D.原电池放电时,电解质中的阳离子向正极移动,D错误;
故答案为:D。
2. 【答案】B
【分析】
该装置为电池装置,根据放电原理,Mg的化合价升高,Mg电极为负极,石墨为正极,据此分析;
【详解】
A.放电属于原电池,电流的方向是由正极经外电路流向负极,即电流由石墨经外电路流向镁极,故A错误;
B.放电时,Mg2+由负极向正极迁移,根据在潮湿条件下的放电原理,正极反应式为3CO2+2Mg2++2H2O+4e-=2MgCO3·H2O+C,故B正确;
C.充电时,电池的正极接电源的正极,电池的负极接电源的负极,充电时,石墨为阳极,阳极电极反应式为2MgCO3·H2O+C-4e-=3CO2+2Mg2++2H2O,故C错误;
D.根据C选项分析,充电时,阳极上质量减少的是2[MgCO3·H2O]和C,即当阳极质量净减(2×102+12)g=216g时,转移电子物质的量为4ml,故D错误;
答案为B。
3.【答案】D
【分析】
由2NaFePO4F+Na3Ti2(PO4)32Na2FePO4F+NaTi2(PO4)3可知Ti元素化合价由+3价变为+4价、Fe元素化合价由+3价变为+2价,所以放电过程中NaFePO4F得电子发生还原反应,电极反应为:NaFePO4F+e-+Na+=Na2FePO4F,Na3Ti2(PO4)3失电子发生氧化反应,电极反应为:Na3Ti2(PO4)3-2e-= Na3Ti2(PO4)3+2Na+,所以左侧电极a为负极、右侧电极b为正极,充电时原来的负极为阴极、原来的正极作阳极,据此分析解题。
【详解】
A.由分析可知,充电时a与电源负极相连为阴极,A正确;
B.由分析可知,放电时b极为正极极,发生还原反应,其电极反应为NaFePO4F+e-+Na+=Na2FePO4F,B正确;
C.由分析可知,正、负极上有Na+的结合和释放,则交换膜为阳离子交换膜,Na+可以自由通过,电路上通过1ml电子,则有1ml的Na+经过交换膜,则理论上,该电池在充电或放电过程中溶液中的c(Na+)不变,C正确;
D.由C项分析可知,交换膜为阳离子交换膜,Na+可以自由通过,则当电路中有0.2mle-通过时,通过交换膜的离子数目为0.2NA,D错误;
故答案为:D。
4.【答案】B
【详解】
A.在a电极上Na失去电子变为Na+,发生氧化反应,所以a电极为负极,A错误;
B.在b电极上O2得到电子,与Na+结合形成NaOx,所以b电极为正极,电极反应式为:,B正确;
C.选用“多孔”石墨电极是为了增加“空位”,增大电势差,而与电池能量存储大小无关,C错误;
D.理论上a极每减重46 g,反应消耗2 ml Na,反应过程中转移2 ml电子,但b电极上未指明通入的O2所处的外界条件,因此不能确定消耗的O2的体积大小,D错误;
故合理选项是B。
5. 【答案】A
【详解】
A.负极N2H4失电子生成N2,当消耗lmlO2时转移4ml电子,根据电子守恒,负极生成1mlN2,故A正确;
B.电池工作时,负极反应式是,负极的pH降低,故B错误;
C.根据图示,正极生成氢氧化钠,正极反应为O2+4e-+2H2O =4OH-,故C错误;
D.负极通入氢氧化钠,正极流出氢氧化钠,X最好用阳离子交换膜,故D错误;
选A。
1. 【答案】B
【解析】锂海水电池的总反应为2Li+2H2O═2LiOH+H2↑, M极上Li失去电子发生氧化反应,则M电极为负极,电极反应为Li-e-=Li+,N极为正极,电极反应为2H2O+2e-=2OH-+H2↑,同时氧气也可以在N极得电子,电极反应为O2+4e-+2H2O=4OH-。
A.海水中含有丰富的电解质,如氯化钠、氯化镁等,可作为电解质溶液,故A正确;
B.由上述分析可知,N为正极,电极反应为2H2O+2e-=2OH-+H2↑,和反应O2+4e-+2H2O=4OH-,故B错误;
C.Li为活泼金属,易与水反应,玻璃陶瓷的作用是防止水和Li反应,并能传导离子,故C正确;
D.该电池不可充电,属于一次电池,故D正确;
答案选B。
2.【答案】A
【解析】根据图示的电池结构和题目所给信息可知,Ⅲ区Zn为电池的负极,电极反应为Zn-2e-+4OH-=Zn(OH),Ⅰ区MnO2为电池的正极,电极反应为MnO2+2e-+4H+=Mn2++2H2O;电池在工作过程中,由于两个离子选择隔膜没有指明的阳离子隔膜还是阴离子隔膜,故两个离子隔膜均可以通过阴、阳离子,因此可以得到Ⅰ区消耗H+,生成Mn2+,Ⅱ区的K+向Ⅰ区移动或Ⅰ区的SO向Ⅱ区移动,Ⅲ区消耗OH-,生成Zn(OH),Ⅱ区的SO向Ⅲ区移动或Ⅲ区的K+向Ⅱ区移动。据此分析答题。
A.根据分析,Ⅱ区的K+只能向Ⅰ区移动,A错误;
B.根据分析,Ⅰ区的SO向Ⅱ区移动,B正确;
C.MnO2电极的电极反应式为MnO2+2e-+4H+=Mn2++2H2O,C正确;
D.电池的总反应为Zn+4OH-+MnO2+4H+=Zn(OH)+Mn2++2H2O,D正确;
故答案选A。
3.【答案】A
【解析】该装置为原电池,铁为负极,石墨为正极。A.石墨电极为正极,溶液为中性,空气中的氧气得到电子,电极反应为O2+2H2O +4e-=4OH-,错误;B.鼓入少量空气,增加氧气的浓度,加快反应速率,正确;C.加入少量氯化钠,溶液导电能力增强,能加快铁的腐蚀,正确;D.加入氯化氢,发生析氢腐蚀,石墨电极上氢离子得到电子生成氢气,电极反应式为:2H++2e→H2,正确;答案选A。
4.【答案】C
【解析】A.在锂空气电池中,金属锂失去电子,发生氧化反应,为负极,正确;B.Li在负极失去电子变成了Li+,会通过有机电解质向水溶液处(正极)移动,正确;C.正极氧气得到了电子后与氢结合形成氢氧根,电极方程式为O2+4e-+2H2O=4OH-,错误;D.负极的反应式为Li-e-= Li+,正极反应式为O2+4e-+2H2O=4OH-,电池的总反应则为4Li+O2+2H2O==4LiOH,正确。综上所述,本题的正确答案为C。
5.【答案】B
【解析】根据图示,金属M为负极,通入空气的电极为正极。A.金属M作电池负极,正确;B.根据图示,电解质是熔融的M(OH)2,错误;C.正极发生还原反应,电极反应,正确;D.负极M失去电子生成M2+,结合C的分析,电池反应,正确;答案选B。
电极名称
负极
正极
电极材料
锌片
铜片
电极反应
Zn-2e-===Zn2+
Cu2++2e-===Cu
反应类型
氧化反应
还原反应
电子流向
由Zn片沿导线流向Cu片
盐桥中离子移向
盐桥含饱和KCl溶液,K+移向正极,Cl-移向负极
种类
酸性
碱性
负极反应式
2H2-4e-===4H+
2H2+4OH--4e-
===4H2O
正极反应式
O2+4H++4e-
===2H2O
2H2O+O2+4e-
===4OH-
电池总反应
2H2+O2===2H2O
相关试卷
这是一份新高考化学一轮复习考点过关练考向16 化学键(含解析),共15页。
这是一份新高考化学一轮复习考点过关练考向05 氧化还原反应(含解析),共19页。
这是一份新高考化学一轮复习考点过关练考向04 离子反应(含解析),共19页。









