

新高考化学一轮复习考点过关练考向22 化学反应速率及影响因素(含解析)
展开【2022·广东卷】在相同条件下研究催化剂I、Ⅱ对反应的影响,各物质浓度c随反应时间t的部分变化曲线如图,则
A.无催化剂时,反应不能进行
B.与催化剂Ⅰ相比,Ⅱ使反应活化能更低
C.a曲线表示使用催化剂Ⅱ时X的浓度随t的变化
D.使用催化剂Ⅰ时,内,
【答案】D
【解析】A.由图可知,无催化剂时,随反应进行,生成物浓度也在增加,说明反应也在进行,故A错误;
B.由图可知,催化剂I比催化剂II催化效果好,说明催化剂I使反应活化能更低,反应更快,故B错误;
C.由图可知,使用催化剂II时,在0~2min 内Y的浓度变化了2.0ml/L,而a曲线表示的X的浓度变化了2.0ml/L,二者变化量之比不等于化学计量数之比,所以a曲线不表示使用催化剂II时X浓度随时间t的变化,故C错误;
D.使用催化剂I时,在0~2min 内,Y的浓度变化了4.0ml/L,则(Y) ===2.0,(X) =(Y) =2.0=1.0,故D正确;
答案选D。
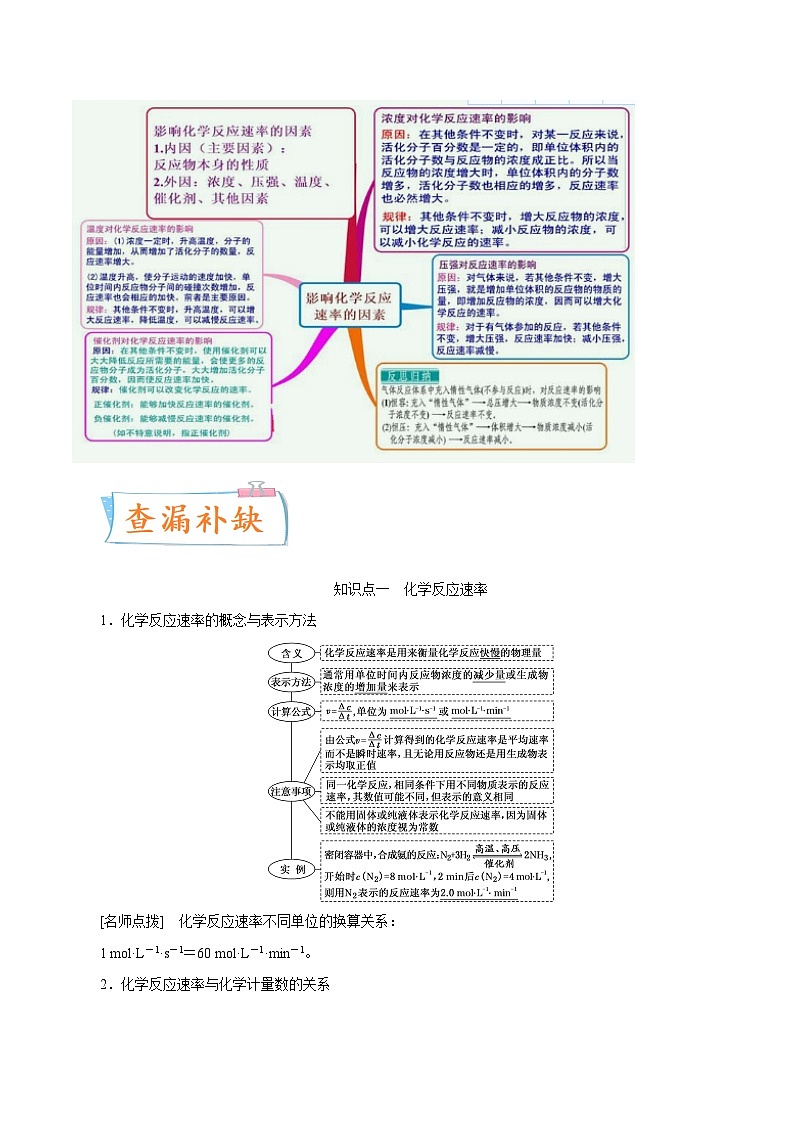
知识点一 化学反应速率
1.化学反应速率的概念与表示方法
[名师点拨] 化学反应速率不同单位的换算关系:
1 ml·L-1·s-1=60 ml·L-1·min-1。
2.化学反应速率与化学计量数的关系
(1)内容:对于已知反应:mA(g)+nB(g)===pC(g)+qD(g),在同一段时间内,用不同物质来表示该反应速率,当单位相同时,反应速率的数值之比等于这些物质在化学方程式中的化学计量数之比。即v(A)∶v(B)∶v(C)∶v(D)=m∶n∶p∶q。
(2)实例:一定温度下,在密闭容器中发生反应:2SO2(g)+O2(g)2SO3(g)。已知v(O2)=0.5 ml·L-1·s-1,则v(SO2)=1_ml·L-1·s-1,v(SO3)=1_ml·L-1·s-1。
[名师点拨] 同一化学反应用不同物质表示的反应速率其数值可能不同,因此,一定要标明是哪种具体物质的反应速率。
3.化学反应速率的计算方法
(1)根据数学表达式 eq \b\lc\(\rc\)(\a\vs4\al\c1(v=\f(Δc,Δt))) 计算
知识点二 影响化学反应速率的因素
1.影响化学反应速率的因素
(1)内因
反应物本身的性质是主要因素。如相同条件下Mg、Al与稀盐酸反应的速率大小关系为Mg>Al。
(2)外因(只改变一个条件,其他条件不变)
[名师点拨] (1)对于固体和纯液体反应物,其浓度可视为常数,改变其用量,反应速率不变,但当固体颗粒变小时,其表面积增大,反应速率增大。
(2)合适的催化剂可以降低正、逆反应的活化能,同等程度的增大正、逆反应速率,但不会改变反应的限度和反应热。
(3)升高温度,正、逆反应的反应速率都增大,但增大的程度不同;降低温度,正、逆反应的反应速率都减小,但减小的程度不同,其中吸热反应受温度影响大。
(4)压强对化学反应速率的影响是通过改变反应物浓度实现的,所以分析压强的改变对反应速率的影响时,要从反应物浓度是否发生改变的角度来分析。若改变总压强而各物质的浓度不改变,则反应速率不变。
2.用图像表示浓度、温度、压强对化学反应速率的影响
3.理论解释——有效碰撞理论
(1)活化分子、活化能、有效碰撞
①活化分子:能够发生有效碰撞的分子。
②活化能:如图
图中:E1为正反应活化能,使用催化剂时的活化能为E3,反应热为E1-E2。(注:E2为逆反应的活化能)
③有效碰撞:活化分子之间能够引发化学反应的碰撞。
(2)活化分子、有效碰撞与反应速率的关系
[名师点拨] 稀有气体对反应速率的影响
A(g)+B(g)C(g),恒温恒容,充入氦气,对反应速率有何影响?恒温恒压,充入氦气,对反应速率又有何影响?
4.有关反应速率的答题方向
(1)解释影响反应速率的因素
(2)催化剂(绝大多数催化剂都有其活性温度范围,温度过高,易使催化剂活性降低)
(3)在工艺流程中,提高矿石酸(碱)浸速率的常见方法
①将矿石粉碎(或粉碎过筛);
②充分搅拌;
③适当升高酸(碱)浸的温度;
④适当增大酸(碱)的浓度。
(4)减小反应速率常用的方法
①减小反应液的浓度;
②将装置置于冰水浴中;
③减慢滴加反应液的速率;
④用大颗粒(或块状)代替小颗粒(或粉末状)物质反应。
1.在实验或生活中为了控制反应速率,下列做法不正确的是( )
A.用过氧化氢制取氧气时可加入少量的二氧化锰以增大反应速率
B.为加快制取氢气的速率可以用锌粒代替锌片
C.为降低浓硫酸与Cu反应制备SO2的速率可以采用稀硫酸代替浓硫酸
D.为了延长疫苗的保质期在运输和保存的过程中最好保持较低的温度
2.H2O2可用于羊毛、生丝、纸浆等的漂白。5% H2O2溶液在常温下分解速率很慢,为了加快H2O2分解,改变某一条件,下列装置与改变的条件相对应的是( )
A.甲—温度、乙—浓度、丙—催化剂
B.甲—浓度、乙—催化剂、丙—温度
C.甲—催化剂、乙—温度、丙—浓度
D.甲—温度、乙—催化剂、丙—浓度
3.一定温度下,向10 mL 0.40 ml·L-1H2O2溶液中加入适量FeCl3溶液,不同时刻测得生成O2的体积(已折算为标准状况)如下表所示。资料显示,反应分两步进行:
①2Fe3++H2O2===2Fe2++O2↑+2H+,②H2O2+2Fe2++2H+===2H2O+2Fe3+,反应过程中能量变化如下图所示。
下列说法不正确的是( )
A.0~6 min的平均反应速率:v(H2O2)≈3.33×10-2 ml·L-1·min-1
B.Fe3+的作用是增大过氧化氢的分解速率
C.反应①是吸热反应,反应②是放热反应
D.反应2H2O2(aq)===2H2O(l)+O2(g)的
ΔH=E1-E2<0
4.叔丁基氯与碱溶液经两步反应得到叔丁基醇,反应(CH3)3CCl+OH-―→(CH3)3COH+Cl-的能量与反应进程如图所示。下列说法正确的是( )
A.该反应为吸热反应
B.(CH3)3C+比(CH3)3CCl稳定
C.反应物的总能量小于生成物的总能量
D.增大碱的浓度和升高温度均可增大反应速率
5.对水样中影响M分解速率的因素进行研究。在相同温度下,M的物质的量浓度c(M)随时间(t)的变化如图所示。下列说法正确的是( )
A.水样pH越大,M的分解速率越快
B.水样中添加Cu2+,能加快M的分解速率
C.由①、③得,反应物浓度越大,M的分解速率越慢
D.在0~20 min内,②中M的分解速率为
0.15 ml·L-1·min-1
1.在一容积可变的密闭容器中加入和进行反应,下列说法不正确的是
A.增加的量,消耗的速率瞬间不变
B.将容器的体积缩小一半,其反应速率加快
C.保持体积不变,充入氩气,其反应速率不变
D.保持压强不变,充入氖气,生成速率减慢
2.(2022·重庆南开中学高三阶段练习)橙子辅导化学小组研究发现雾霾微颗粒中硫酸盐的生成可能存在三个阶段的转化,其主要过程如图所示。下列说法错误的是
A.为转化过程中的催化剂
B.、、均为共价化合物
C.第Ⅰ阶段的反应中被氧化
D.第Ⅱ、Ⅲ阶段总反应的化学方程式为
3.某反应在不同pH下产物A的浓度随时间变化的关系如图所示(其他条件相同),下列有关说法正确的是
A.时,随着反应的进行反应速率逐渐增大
B.若减小压强,该反应的反应速率会减小
C.用调节pH的方法可以使该反应停止
D.一定pH范围内,溶液中浓度越大,反应速率越慢
4.(2022·江苏省包场高级中学高三开学考试)甲醛在木材加工、医药等方面有重要用途。甲醇利用脱氢法可制备甲醛,主要反应为:。是甲醇脱氢制甲醛的催化剂,有研究指出,催化反应的部分机理如下:
历程ⅰ:
历程ⅱ:
历程ⅲ:
历程iv:
如图所示为在体积2L的恒容容器中,投入,在碳酸钠催化剂作用下,经过5min反应,测得甲醇转化率与甲醛的选择性与温度的关系(甲醛的选择性:转化的中生成的百分比),下列有关说法正确的是
A.600℃时,前5min内生成甲醛的平均速率
B.700℃时,反应历程ⅱ的速率大于反应历程ⅲ的速率
C.脱氢法制甲醛中,在高温高压条件下更有利于提高平衡产率
D.反应历程ⅰ的活化能小于的活化能
5.(2022·山东·汶上县第一中学高三开学考试)一定温度下,利用下列装置进行实验,达不到实验目的的是
A.用甲装置测定化学反应速率
B.用乙装置检验分解产生的两种气体
C.用丙装置测定醋酸溶液的浓度
D.用丁装置测定酸碱中和反应的反应热
1.(2022辽宁)某温度下,在恒容密闭容器中发生反应,有关数据如下:
下列说法错误的是
A.时,Z的浓度大于
B.时,加入,此时
C.时,Y的体积分数约为33.3%
D.时,X的物质的量为
2.(2021广东卷)反应X = 2Z经历两步:①X → Y;②Y → 2Z。反应体系中X、Y、Z的浓度c随时间t的变化曲线如图4所示。下列说法不正确的是
a为c(X) 随t的变化曲线
t1时,c(X) = c(Y) = c(Z)
t2时,Y的消耗速率大于生成速率
t3后,c(Z) = 2c0 — c(Y)
(2017浙江4月选考)对水样中溶质M的分解速率影响因素进行研究。在相同温度下,M的物质的量浓度(ml·L-1)随时间(min)变化的有关实验数据见下表。
下列说法不正确的是( )
A.在0~20 min内,Ⅰ中M的分解速率为0.015 ml·L-1·min-1
B.水样酸性越强,M的分解速率越快
C.在0~25 min内,Ⅲ中M的分解百分率比Ⅱ大
D.由于Cu2+存在,Ⅳ中M的分解速率比Ⅰ快
4. (2016海南高考)顺-1,2-二甲基环丙烷和反-1,2-二甲基环丙烷可发生如下转化:
该反应的速率方程可表示为:v(正)=k(正)·c(顺)和v(逆)=k(逆)·c(反),k(正)和k(逆)在一定温度时为常数,分别称作正、逆反应速率常数。回答下列问题:
(1)已知:T1温度下,k(正)=0.006 s-1,k(逆)=0.002 s-1,该温度下反应的平衡常数值K1=________;该反应的活化能Ea(正)小于Ea(逆),则ΔH________0(填“小于”“等于”或“大于”)。
(2)T2温度下,图中能表示顺式异构体的质量分数随时间变化的曲线是________(填曲线编号),平衡常数值K2=________;温度T1________T2(填“小于”“等于”或“大于”),判断理由是___________________________________。
5.(2018课标全国Ⅲ,28(3))对于反应2SiHCl3(g)===SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂,在323 K和343 K时SiHCl3的转化率随时间变化的结果如图所示。
比较a、b处反应速率大小:va________vb(填“大于”“小于”或“等于”)。反应速率v=v正-v逆=k正x2SiHCl3-k逆xSiH2Cl2xSiCl4,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,计算a处的eq \f(v正,v逆)=________(保留1位小数)。
1.【答案】C
【解析】稀硫酸与Cu不反应,而浓硫酸与Cu在加热条件下反应才能制备SO2,故C错误。
2.【答案】A
【解析】由图可知,对照常温下5% H2O2溶液的试管,甲改变的条件是温度;乙改变的条件是浓度;丙改变的条件是催化剂,所以装置与改变的条件相对应的是甲—温度、乙—浓度、丙—催化剂。
3.【答案】D
【解析】 A项,0~6 min由生成的氧气的体积可计算出发生反应的过氧化氢的物质的量为0.002 ml,所以v(H2O2)= eq \f(0.002,0.01×6) ml·L-1·min-1≈0.033 3 ml·L-1·min-1,正确;B项,使用催化剂可以增大反应速率,正确;C项,从图可以看出反应1是吸热反应,反应2是放热反应,正确;D项,反应放出的能量与始态物质的能量和终态物质的能量有关,从图可以看出,E1-E2不是该反应的反应热,错误。
4.【答案】D
【解析】由图可知,反应物总能量大于生成物总能量,为放热反应,A错误;(CH3)3C+比(CH3)3CCl的能量高,则(CH3)3CCl更稳定,B错误;由图可知,反应物的总能量大于生成物的总能量,故C错误;增大浓度、升高温度均增大反应速率,则增大碱的浓度和升高温度均可增大反应速率,D正确。
5.【答案】B
【解析】曲线斜率越大,反应速率越快。pH:①>②、溶液初始浓度相同,斜率:①<②,说明水样pH越大,反应速率越慢,故A错误;初始浓度都为0.20 ml·L-1、pH=4时,③中不加Cu2+,④中加入Cu2+,斜率:③<④,反应速率:③<④,所以水样中添加Cu2+,能加快M的分解速率,故B正确;①、③pH相同,初始浓度:①>③,斜率:①>③,速率:①>③,说明反应物浓度越大,M的分解速率越快,故C错误;0~20 min内,②中M的平均分解速率= eq \f(Δc,Δt) = eq \f(0.40-0.10,20) ml·L-1·min-1=0.015 ml·L-1·min-1,故D错误。
1.A
【详解】A.增加的量,容器体积会增大,的浓度会瞬间减小,则消耗的速率瞬间减小,故A错误;
B.将体积缩小,氢气、的浓度增大,反应速率加快,故B正确;
C.体积不变,充入氩气,、的浓度不变,反应速率不变,故C正确;
D.压强不变,充入氖气,体积增大,、的浓度减小,反应速率减慢,故D正确。
故选A。
2.A
【分析】由图可知,二氧化氮和亚硫酸根离子参与反应最终生成硫酸氢根离子,在反应过程中,二氧化氮只是参与反应,没有生成,是反应物,亚硫酸根离子中的硫元素,逐步被氧化,以此解题。
【详解】A.由图可知,二氧化氮为反应物,不是催化剂,A错误;
B.物质、、中均是通过共价键形成的,都为共价化合物,B正确;
C.由图可知,第Ⅰ阶段的反应中中的硫由+4价被氧化为+5价,则被氧化,C正确;
D.过程Ⅰ中NO2得到失去的电子发生氧化还原反应生成NO、SO,反应的离子方程式:,由得失电子守恒和原子守恒可得总反应:故II、III阶段总反应的化学方程式为,D正确;
故选A。
3.C
【详解】A.图像中表示反应速率的是曲线的斜率,pH=8.5时,随着反应的进行,曲线的斜率逐渐减小,A错误;
B.图像没有给出压强对反应速率的影响,不能确定,B错误;
C..时,基本不变,说明反应停止,C正确;
D.pH越小,浓度越大,反应速率越快,D错误。
4.D
【详解】A.由图可知,600℃时甲醇转化率为55%、甲醛的选择性为60%,则前5min内生成甲醛的平均速率v(HCHO)= =0.033 ml·L-1·min-1,故A错误;
B.由图可知,600℃后,甲醇的转化率增大、甲醛的选择性降低,说明700°C时历程ⅲ的反应程度大,相同时间内反应历程ⅱ的速率小于反应历程ⅲ的速率,故B错误;
C.该反应为气体体积增大的吸热反应,增大压强,平衡向逆反应方向移动,甲醛的产率降低,故C错误;
D.使用催化剂,降低反应的活化能,则使用碳酸钠做反应催化剂的反应历程ⅰ的活化能小于CH3OH(g)HCHO(g)+H2(g)的活化能,故D正确;
故选D。
5.D
【详解】A. 可以通过测定一定时间内产生氢气的量或者生成一定量氢气所用的时间来测定反应速率,故A正确;
B. 五氧化二磷吸收氨气,通过蓝色石蕊试纸变红检验氯化氢,碱石灰吸收氯化氢,通过湿润的酚酞试纸变红检验氨气,故可用乙装置检验分解产生的两种气体,故B正确;
C. 氢氧化钠与醋酸恰好反应生成醋酸钠,溶液显碱性,指示剂选择酚酞,故可用丙装置测定醋酸溶液的浓度,故C正确;
D. 丁装置缺少环形玻璃搅拌棒,不能测定酸碱中和反应的反应热,故D错误;
故选D。
1.【答案】B
【详解】
A.反应开始一段时间,随着时间的延长,反应物浓度逐渐减小,产物Z的平均生成速率逐渐减小,则内Z的平均生成速率大于内的,故时,Z的浓度大于,A正确;
B.时生成的Z的物质的量为,时生成的Z的物质的量为,故反应在时已达到平衡,设达到平衡时生了,列三段式:
根据,得,则Y的平衡浓度为,Z的平衡浓度为,平衡常数,时Y的浓度为,Z的浓度为,加入后Z的浓度变为,,反应正向进行,故,B错误;
C.反应生成的Y与Z的物质的量之比恒等于1∶2,反应体系中只有Y和Z为气体,相同条件下,体积之比等于物质的量之比,,故Y的体积分数始终约为33.3%,C正确;
D.由B项分析可知时反应处于平衡状态,此时生成Z为,则X的转化量为,初始X的物质的量为,剩余X的物质的量为,D正确;
故答案选B。
2.【答案】D
【解析】
A、由图可知,曲线a的浓度随时间一直下降,说明曲线a是反应物浓度随时间的变化曲线,A正确;
B、由图可知,在t1时刻,三种物质的浓度相等,B正确;
C、由反应方程式以及各物质浓度随时间的变化关系可得,物质Y的浓度随时间先增大后减小;在t2时刻之后,物质Y的浓度随反应时间的延长而减小,说明Y的消耗速率大于生成速率,C正确;
D、由图可得,t3后,X反应完全;根据反应方程式X→Y可得,X完全反应后,c(Y)= C0;根据反应方程式Y→2Z,初始时c(Y)= C0;反应中Y的浓度为c(Y);所以t3后,c(Z)= 2[c- c(Y)],D项误。
3. 【答案】D
【解析】v(M)=eq \f((0.40-0.10) ml·L-1,20 min)=0.015 ml·L-1·min-1,A项正确;对比水样Ⅰ、Ⅱ可知,M的起始浓度相同,Ⅰ中酸性强,分解速率快,B项正确;C项,0~25 min内,Ⅲ中M的分解百分率为75%,Ⅱ中分解百分率为60%,C项正确;0~5 min内,Ⅰ中Δc(M)=0.12 ml·L-1,Ⅳ中Δc(M)=0.11 ml·L-1,Ⅰ的分解速率快,D项错误。
【答案】(1)3 小于
【解析】(1)根据v(正)=k(正)·c(顺)=0.006 s-1×c(顺)和v(逆)=k(逆)·c(反)=0.002 s-1×c(反),反应达到平衡时v(正)=v(逆),即0.006 s-1×c(顺)=0.002 s-1×c(反),则该温度下反应的平衡常数值K1=eq \f(c(反),c(顺))=eq \f(0.006 s-1,0.002 s-1)=3;该反应的活化能Ea(正)小于Ea(逆),则ΔH=E1(正反应活化能)-E2(逆反应活化能)=Ea(正)-Ea(逆)<0。
(2)随反应的进行,顺-1,2-二甲基环丙烷的质量分数不断减少,且反应速率减慢,则顺式异构体的质量分数随时间变化的曲线是B;根据顺-1,2-二甲基环丙烷和反-1,2-二甲基环丙烷反应可知,T2温度下,平衡时顺-1,2-二甲基环丙烷的质量分数是30%,则反-1,2-二甲基环丙烷的质量分数是70%,因二者的摩尔质量相同,即反应平衡时顺-1,2-二甲基环丙烷的物质的量分数是30%,则反-1,2-二甲基环丙烷的物质的量分数是70%,代入平衡常数的表达式K2=eq \f(c(反),c(顺))=eq \f(0.7,0.3)=eq \f(7,3);因K1大于K2,此反应为放热反应,升高温度平衡向逆反应方向移动,得T2大于T1。
(2)B eq \f(7,3) 小于 放热反应升高温度时平衡向逆反应方向移动
5. 【答案】大于 1.3
【解析】温度越高,反应速率越大,a点所在曲线对应的温度高于b点所在曲线对应的温度,所以a点反应速率大于b点反应速率。a点所在曲线达到平衡时,v正=v逆,即k正x2SiHCl3=k逆xSiH2Cl2xSiCl4,从题图上可知a点所在曲线平衡时SiHCl3的转化率为22%,设投入SiHCl3 y ml,则根据三段式法得
eq \a\vs4\ac\hs10\c6(,2SiHCl3(g),===,SiH2Cl2(g),+,SiCl4(g),开始/ml,y,,0,,0,转化/ml,0.22y,,0.11y,,0.11y,平衡/ml,0.78y,,0.11y,,0.11y)
代入k正x2SiHCl3=k逆xSiH2Cl2xSiCl4得,k正0.782=k逆0.112,eq \f(k正,k逆)=eq \f(0.112,0.782) ①
在a处SiHCl3的转化率为20%,根据三段式法得
eq \a\vs4\ac\hs10\c6(,2SiHCl3(g),===,SiH2Cl2(g),+,SiCl4(g),开始/ml,y,,0,,0,转化/ml,0.2y,,0.1y,,0.1y,a处/ml,0.8y,,0.1y,,0.1y)
则eq \f(v正,v逆)=eq \f(k正x2SiHCl3,k逆xSiH2Cl2xSiCl4)=eq \f(k正,k逆)×eq \f(0.82,0.12),将①代入计算得出v正/v逆≈1.3。
图像
图像分析
(1)其他反应条件一定,化学反应速率随反应物浓度增大而增大
(2)其他反应条件一定,化学反应速率随温度的升高而增大
(3)有气体参加的反应,化学反应速率随着压强的增大而增大
(4)有气体参加的反应,化学反应速率随着容器容积的增大而减小
(5)分别在较低温度和较高温度下反应,化学反应速率随着压强的增大及温度的升高而增大
条件变化
正常
反常
举例解释
加热
速率增大
速率减小
①有酶参与的反应,温度高酶会失去活性
②有气体参与的反应,升高温度,气体的溶解度减小
③加热易分解的物质(H2O2、NH3·H2O等)分解
④有催化剂参与的反应,升高温度,催化剂活性降低
⑤加热易挥发的物质(浓硝酸、浓盐酸)大量挥发
加压
速率增大
不变
①没有气体参与的反应;
②恒温恒容条件下的气相反应,充入稀有气体
反应速率
原因
活化能
增大
催化剂改变反应的历程,使活化能降低
温度
增大
随着温度升高,催化剂的活性增大
减小
随着温度升高,催化剂的活性减小
接触面积
增大
催化剂与反应物接触面积增大
t/min
0
2
4
6
v(O2)/mL
0
9.9
17.2
22.4
时间段/
产物Z的平均生成速率/
0~2
0.20
0~4
0.15
0~6
0.10
时间
水样
0
5
10
15
20
25
Ⅰ(pH=2)
0.40
0.28
0.19
0.13
0.10
0.09
Ⅱ(pH=4)
0.40
0.31
0.24
0.20
0.18
0.16
Ⅲ(pH=4)
0.20
0.15
0.12
0.09
0.07
0.05
Ⅳ(pH=4,含Cu2+)
0.20
0.09
0.05
0.03
0.01
0
新高考化学一轮复习考点过关练考向16 化学键(含解析): 这是一份新高考化学一轮复习考点过关练考向16 化学键(含解析),共15页。
新高考化学一轮复习考点过关练考向04 离子反应(含解析): 这是一份新高考化学一轮复习考点过关练考向04 离子反应(含解析),共19页。
2024届高考化学一轮总复习课时跟踪练22化学反应速率及影响因素: 这是一份2024届高考化学一轮总复习课时跟踪练22化学反应速率及影响因素,共11页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。












