

所属成套资源:新高考化学一轮复习考点过关练 (含解析)
新高考化学一轮复习考点过关练考向25 弱电解质的电离平衡(含解析)
展开
这是一份新高考化学一轮复习考点过关练考向25 弱电解质的电离平衡(含解析),共18页。
(2022·全国乙卷)常温下,一元酸的。在某体系中,与离子不能穿过隔膜,未电离的可自由穿过该膜(如图所示)。
设溶液中,当达到平衡时,下列叙述正确的是
A.溶液Ⅰ中
B.溶液Ⅱ中的HA的电离度为
C.溶液Ⅰ和Ⅱ中的不相等
D.溶液Ⅰ和Ⅱ中的之比为
【答案】B
【解析】A.常温下溶液I的pH=7.0,则溶液I中c(H+)=c(OH-)=1×10-7ml/L,c(H+)<c(OH-)+c(A-),A错误;
B.常温下溶液II的pH=1.0,溶液中c(H+)=0.1ml/L,Ka==1.0×10-3,c总(HA)=c(HA)+c(A-),则=1.0×10-3,解得=,B正确;
C.根据题意,未电离的HA可自由穿过隔膜,故溶液I和II中的c(HA)相等,C错误;
D.常温下溶液I的pH=7.0,溶液I中c(H+)=1×10-7ml/L,Ka==1.0×10-3,c总(HA)=c(HA)+c(A-),=1.0×10-3,溶液I中c总(HA)=(104+1)c(HA),溶液II的pH=1.0,溶液II中c(H+)=0.1ml/L,Ka==1.0×10-3,c总(HA)=c(HA)+c(A-),=1.0×10-3,溶液II中c总(HA)=1.01c(HA),未电离的HA可自由穿过隔膜,故溶液I和II中的c(HA)相等,溶液I和II中c总(HA)之比为[(104+1)c(HA)]∶[1.01c(HA)]=(104+1)∶1.01≈104,D错误;
答案选B。
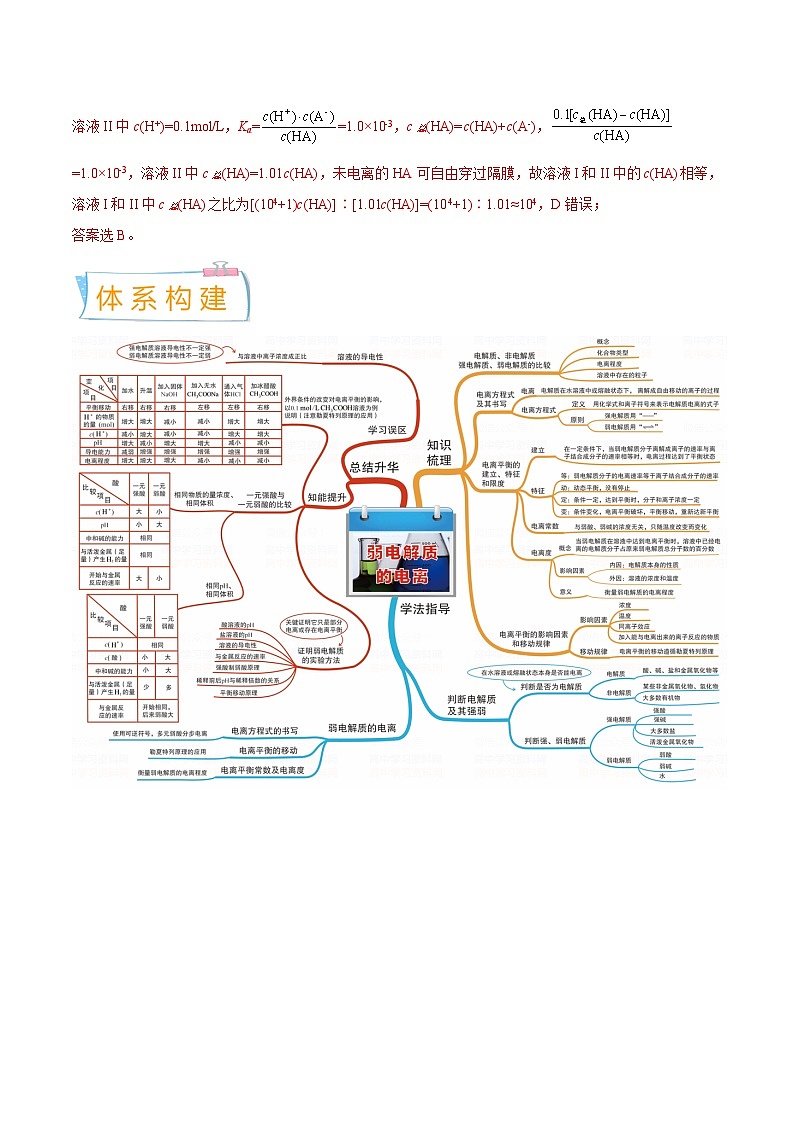
知识点一 弱电解质的电离平衡
1.强、弱电解质
(1)定义与物质类别
(2)电离方程式的书写——“强等号,弱可逆,多元弱酸分步离”
①强电解质:如H2SO4:H2SO4===2H++SO eq \\al(\s\up1(2-),\s\d1(4)) _。
②弱电解质
a.一元弱酸,如CH3COOH:CH3COOHCH3COO-+H+。
b.多元弱酸,分步电离,分步书写且第一步电离程度远大于第二步电离程度,如H2CO3:H2CO3H++HCO eq \\al(\s\up1(-),\s\d1(3)) _、HCO eq \\al(\s\up1(-),\s\d1(3)) H++CO eq \\al(\s\up1(2-),\s\d1(3)) 。
c.多元弱碱,分步电离,一步书写,如Fe(OH)3:Fe(OH)3Fe3++3OH-。
③酸式盐
a.强酸的酸式盐,如NaHSO4在水溶液中:
NaHSO4===Na++H++SO eq \\al(\s\up1(2-),\s\d1(4)) ;熔融时:NaHSO4===Na++HSO eq \\al(\s\up1(-),\s\d1(4)) 。
b.弱酸的酸式盐:“强中有弱”,如NaHCO3:
NaHCO3===Na++HCO eq \\al(\s\up1(-),\s\d1(3)) 、HCO eq \\al(\s\up1(-),\s\d1(3)) H++CO eq \\al(\s\up1(2-),\s\d1(3)) 。
[名师点拨] (1)中学阶段常见的六大强酸是指HCl、H2SO4、HNO3、HBr、HI、HClO4,其他一般是中强酸或弱酸。
(2)中学阶段常见的四大强碱是指NaOH、KOH、Ca(OH)2、Ba(OH)2,其他一般是中强碱或弱碱。
2.弱电解质的电离平衡
(1)电离平衡的建立
在一定条件(如温度、浓度等)下,当弱电解质分子电离成离子的速率和离子结合成弱电解质分子的速率相等时,电离过程就达到平衡状态,即电离平衡。平衡建立过程如图所示:
(2)外因对电离平衡的影响
①浓度:在一定温度下,同一弱电解质溶液,浓度越小,越易电离。
②温度:温度越高,电离程度越大。
③相同离子:加入与弱电解质具有相同离子的电解质时,可使电离平衡向结合成弱电解质分子的方向移动。
④化学反应:加入能与弱电解质电离出的离子反应的物质时,可使电离平衡向电离方向移动。
⑤实例:以0.1 ml·L-1CH3COOH溶液为例,填写外界条件对CH3COOHCH3COO-+H+ ΔH>0的影响。
[名师点拨] (1)稀醋酸加水稀释时,溶液中不一定所有离子的浓度都减小,如醋酸溶液中的c(H+)减小,但c(OH-)增大。
(2)电离平衡右移,电解质分子的浓度不一定减小,如稀醋酸中加入冰醋酸。
(3)电离平衡右移,离子的浓度不一定增大,电离程度也不一定增大,如增大弱电解质的浓度,使电离平衡向右移动,但电离程度减小。
3.电解质溶液的导电能力与溶液中离子的关系
电解质溶液导电能力取决于自由移动离子的浓度和离子所带电荷数,自由移动离子的浓度越大、离子所带电荷数越多,导电能力越强。
4.判断弱电解质的三个思维角度
角度一:弱电解质的定义,即弱电解质不能完全电离。
(1)测定一定浓度的HA溶液的pH。
(2)与同浓度盐酸比较导电性。
(3)与同浓度的盐酸比较和锌反应的快慢。
角度二:弱电解质溶液中存在电离平衡,条件改变,平衡移动。
(1)从一定pH的HA溶液稀释前后pH的变化判断。
(2)从升高温度后pH的变化判断。
(3)从等体积、等pH的HA溶液与盐酸分别与过量的锌反应生成H2的量判断。
角度三:弱电解质形成的盐类能水解。如判断CH3COOH为弱酸可用下面两个现象:
(1)配制某浓度的醋酸钠溶液,向其中加入几滴酚酞溶液。现象:溶液变为浅红色。
(2)用玻璃棒蘸取一定浓度的醋酸钠溶液滴在pH试纸上,测其pH。现象:pH>7。
知识点二 电离平衡常数
1.电离常数
(1)概念:在一定条件下,弱电解质在达到电离平衡时,溶液中电离所生成的各种离子浓度的乘积与溶液中未电离的分子浓度的比值是一个常数,这个常数叫做电离平衡常数,又称电离常数,用K(弱酸用Ka,弱碱用Kb)表示。
(2)表达式
(3)意义
相同条件下,K值越大,表示该弱电解质越易电离,所对应酸或碱的酸性或碱性相对越强。
(4)特点
①电离常数只与温度有关,与电解质的浓度、酸碱性无关,由于电离过程是吸热的,故温度升高,K增大。
②多元弱酸是分步电离的,各级电离常数的大小关系是K1≫K2……所以其酸性主要取决于第一步电离。
(5)电离常数的四大应用
①判断弱酸(或弱碱)的相对强弱,电离常数越大,酸性(或碱性)越强。
②判断盐溶液的酸性(或碱性)强弱
电离常数越大,对应盐的水解程度越小,盐溶液的碱性(或酸性)越弱。
③判断反应能否发生或者判断产物是否正确
通过强酸制弱酸来判断。如H2CO3:Ka1=4.2×10-7,Ka2=5.6×10-11,苯酚(C6H5OH):Ka=1.3×10-10,向苯酚钠(C6H5ONa)溶液中通入的CO2不论是少量还是过量,其化学方程式均为C6H5ONa+CO2+H2O===C6H5OH+NaHCO3。
④判断溶液微粒浓度比值的变化
利用温度不变,电离常数不变来判断。
如把0.1 ml·L-1CH3COOH溶液加水稀释, eq \f(c(CH3COO-),c(CH3COOH)) = eq \f(c(CH3COO-)·c(H+),c(CH3COOH)·c(H+)) = eq \f(Ka,c(H+)) ,稀释时,c(H+)减小,Ka不变,则 eq \f(c(CH3COO-),c(CH3COOH)) 变大。
2.电离度
(1)概念
电离度是在一定条件下的弱电解质在溶液中达到电离平衡时,已经电离的电解质分子数占原电解质分子总数的百分数。
(2)表示方法
α= eq \f(已电离的弱电解质分子数,溶液中原有弱电解质的总分子数) ×100%
也可表示为α= eq \f(弱电解质的离子浓度,弱电解质的浓度) ×100%
(3)影响因素
[名师点拨] (1)浓度为c ml·L-1的一元弱酸(HA)溶液中,c(H+)=c·α= eq \r(Ka·c) 。
(2)浓度为c ml·L-1的一元弱碱(BOH)溶液中,c(OH-)=c·α= eq \r(Kb·c) 。
(3)一元弱酸(HA)溶液中电离度与电离常数的关系为Ka=c·α2或α= eq \r(\f(Ka,c)) 。
1.在0.1 ml·L-1的HCN溶液中存在如下电离平衡:HCNH++CN-。对该平衡,下列叙述正确的是( )
A.加入少量NaOH固体,平衡正向移动
B.加水,平衡逆向移动
C.滴加少量0.1 ml·L-1 HCl溶液,溶液中c(H+)减小
D.加入少量NaCN固体,平衡正向移动
2.在25 ℃时,用蒸馏水稀释1 ml·L-1氨水至0.01 ml·L-1,随溶液的稀释,下列各项中始终保持增大趋势的是( )
A. eq \f(c(OH-),c(NH3·H2O)) B. eq \f(c(NH eq \\al(\s\up1(+),\s\d1(4)) ),c(OH-))
C. eq \f(c(NH3·H2O),c(NH eq \\al(\s\up1(+),\s\d1(4)) )) D.c(OH-)
3.下列有关水电离情况的说法正确的是( )
A.25 ℃,pH=12的烧碱溶液与pH=12的纯碱溶液,水的电离程度相同
B.其他条件不变,CH3COOH溶液在加水稀释过程中, eq \f(c(OH-),c(H+)) 一定变小
C.其他条件不变,稀释氢氧化钠溶液,水的电离程度减小
D.其他条件不变,温度升高,水的电离程度增大,KW增大
4.已知次磷酸(H3PO2)为一元酸,欲证明它是弱电解质,下列操作方法不正确的是( )
A.用物质的量浓度相同的NaCl溶液和NaH2PO2溶液进行导电性实验,比较灯泡的亮度
B.用一定浓度的NaOH溶液分别滴定等体积、等pH的盐酸和次磷酸溶液,比较消耗碱液的体积
C.加热滴有酚酞试液的NaH2PO2溶液,溶液颜色变深
D.常温下,稀释0.1 ml·L-1次磷酸溶液至原溶液体积的100倍,测得pH在4~5之间
5.已知下面三个数据:7.2×10-4、4.6×10-4、4.9×10-10分别是下列有关三种酸的电离常数(25 ℃)。若已知下列反应可以发生:NaCN+HNO2===HCN+NaNO2、NaCN+HF===HCN+NaF、NaNO2+HF===HNO2+NaF。由此可判断下列叙述不正确的是( )
A.K(HF)=7.2×10-4
B.K(HNO2)=4.9×10-10
C.根据两个反应即可得出一元弱酸的强弱顺序:HF>HNO2>HCN
D.K(HCN)HCN,所以亚硝酸的电离平衡常数为4.6×10-4,故B错误。
1.【答案】C
【详解】A.氯化铵促进水电离,pH=5的NH4Cl溶液由水电离出的c(H+)为10-5ml•L-1;醋酸抑制水电离,pH=5的醋酸溶液由水电离出的c(H+)为10-9ml•L-1,故A错误;
B.醋酸是弱酸,常温下,将pH=3的醋酸和pH=11的NaOH溶液等体积混合后,醋酸有剩余,溶液呈酸性,pH
相关试卷
这是一份新高考化学一轮复习考点过关练考向16 化学键(含解析),共15页。
这是一份新高考化学一轮复习考点过关练考向10 氯及其化合物(含解析),共17页。
这是一份新高考化学一轮复习考点过关练考向07 铁及其化合物(含解析),共17页。









