






所属成套资源:新高考化学二轮复习课件专题 (含解析)
新高考化学二轮复习课件专题七 化学反应速率和化学平衡(含解析)
展开
这是一份新高考化学二轮复习课件专题七 化学反应速率和化学平衡(含解析),共60页。PPT课件主要包含了内容索引,核心考点聚焦,专项热考突破,专题体系构建,2外因,角度拓展,催化剂Ⅱ,CuAlO2,逆向移动,CH4等内容,欢迎下载使用。
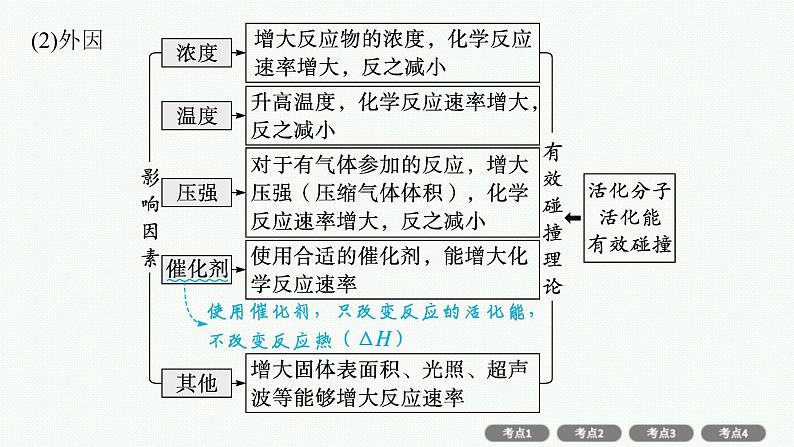
[核心回顾]1.掌握化学反应速率的两种计算方法 注意单位的规范书写(1)依据定义式计算:依据“ ”计算时一定要注意容器的容积或溶液的体积,不能盲目地把Δn当作Δc代入公式进行计算。(2)根据比例关系计算:对于反应“mA(g)+nB(g)pC(g)+qD(g)”,不同物质的化学反应速率与化学计量数的关系:v(A)∶v(B)∶v(C)∶v(D)=m∶n∶p∶q。
2.熟悉影响化学反应速率的因素(1)内因——活化能在相同的条件下,不同化学反应的速率不同,主要是内因——活化能大小不同所致,活化能小的反应速率快,活化能大的反应速率慢。
微点拨:“惰性气体”(非反应气体)对化学反应速率的影响
3.掌握化学反应速率常数(k)及应用(1)速率常数(k)速率常数(k)是指在给定温度下,反应物浓度皆为1 ml·L-1时的反应速率。在相同的浓度条件下,可用速率常数大小来比较化学反应的反应速率。(2)速率方程基元反应的化学反应速率与反应物的浓度数值相应幂次的乘积成正比,其幂次即为各物质前面的化学计量数。对于基元反应:aA(g)+bB(g) gG(g)+hH(g),则v(正)=k(正)ca(A)·cb(B)[其中k(正)为正反应的速率常数],v(逆)=k(逆)cg(G)·ch(H)[其中k(逆)为逆反应的速率常数]。
(3)影响因素 浓度、压强不影响速率常数(k)速率常数是温度的函数。同一反应,温度不同,速率常数不同;温度相同,速率常数相同。(4)速率常数与化学平衡常数之间的关系一定温度下,可逆反应:aA(g)+bB(g) gG(g)+hH(g),v(正)=k(正)ca(A)·cb(B), v(逆)=k(逆)cg(G)·ch(H),达到平衡状态:v(正)=v(逆),则有k(正)ca(A)·cb(B)=k(逆)cg(G)·ch(H),从而可得化学平衡常数:
【典例】 (2022广东卷,15)在相同条件下研究催化剂Ⅰ、催化剂Ⅱ对反应X ―→ 2Y的影响,各物质浓度c随反应时间t的部分变化曲线如图,则( )A.无催化剂时,反应不能进行B.与催化剂Ⅰ相比,催化剂Ⅱ使反应活化能更低C.a曲线表示使用催化剂Ⅱ时X的浓度随t的变化D.使用催化剂Ⅰ时,0~2 min内,v(X)=1.0 ml·L-1·min-1
[命题角度]角度1化学反应速率及影响因素
提示 由题图可知,无催化剂时反应可以进行,A项错误;由题图可知,加入催化剂Ⅱ,在2 min时生成物Y的浓度为2.0 ml·L-1,加入催化剂Ⅰ,在2 min时生成物Y的浓度为4.0 ml·L-1,因此催化剂Ⅰ使反应速率更大,即催化剂Ⅰ使反应活化能更低,B项错误;由题图可知,a曲线表示的是反应物浓度随时间的变化曲线,即表示X的浓度变化的曲线,2 min内,X的浓度减少2.0 ml·L-1,由X ―→ 2Y可知,生成物Y的浓度应增加4.0 ml·L-1,其对应的应是使用催化剂Ⅰ的曲线,因此a曲线表示使用催化剂Ⅰ时X的浓度随时间的变化,C项错误;由题图可知,使用催化剂Ⅰ时,0~2 min内,v(Y)= =2.0 ml·L-1·min-1,v(X)= v(Y)=1.0 ml·L-1·min-1,D项正确。
角度拓展1.(2022山东淄博模拟)某温度下,降冰片烯在钛杂环丁烷催化下聚合,反应物浓度与催化剂浓度及时间关系如图,已知反应物消耗一半所需的时间称为半衰期。判断下列说法是否正确。
(1)其他条件相同时,催化剂浓度越大,反应速率越大。( )(2)条件①,化学反应速率为0.012 ml·L-1·min-1。( )(3)条件②,降冰片烯起始浓度为3.0 ml·L-1时,半衰期为125 min。( )
提示 (3)反应物消耗一半所需的时间称为半衰期,由题干图中数据可知,条件②,降冰片烯起始浓度为3.0 ml·L-1时,半衰期为62.5 min。
2.(2022辽宁本溪模拟)环戊二烯( )是重要的有机化工原料,容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯的浓度(初始浓度为1.5 ml·L-1)与反应时间的关系如图所示。判断下列说法是否正确。
(1)a点的逆反应速率小于b点的逆反应速率。( )(2)其他条件相同,升高温度,正反应速率减小,逆反应速率增大。 ( )(3)b点时,二聚体的浓度为0.9 ml·L-1。( )
提示 (2)温度对正、逆反应速率的影响具有一致性,升高温度,正、逆反应速率均增大。(3)b点时环戊二烯的浓度变化为1.5 ml·L-1-0.6 ml·L-1=0.9 ml·L-1,由于生成环戊二烯的二聚体,则二聚体的浓度为0.45 ml·L-1。
角度2化学反应速率的计算及比较【典例】 取50 mL过氧化氢水溶液,在少量I-存在下分解:2H2O2 ══ 2H2O+O2↑。在一定温度下,测得O2的放出量,转换成H2O2浓度(c)如下表:
下列说法不正确的是( )A.反应20 min时,测得O2的体积为224 mL(标准状况)B.20~40 min,消耗H2O2的平均速率为0.010 ml·L-1·min-1C.第30 min时的瞬时速率小于第50 min时的瞬时速率D.H2O2分解酶或Fe2O3代替I-也可以催化H2O2分解
角度拓展1.(2022河北唐山模拟)氨气去除NO的反应原理为4NH3(g)+6NO(g) 5N2(g)+6H2O(g) ΔH
相关课件
这是一份新高考化学二轮复习课件专题七 化学反应速率和化学平衡(含解析),共60页。PPT课件主要包含了内容索引,核心考点聚焦,专项热考突破,专题体系构建,2外因,角度拓展,催化剂Ⅱ,CuAlO2,逆向移动,CH4等内容,欢迎下载使用。
这是一份新高考化学二轮总复习精品课件 专题七 化学反应速率和化学平衡(含解析),共60页。PPT课件主要包含了内容索引,核心考点聚焦,专项热考突破,专题体系构建,2外因,角度拓展,催化剂Ⅱ,CuAlO2,逆向移动,CH4等内容,欢迎下载使用。
这是一份2023届高考化学二轮复习专题七化学反应速率和化学平衡课件,共60页。PPT课件主要包含了内容索引,核心考点聚焦,专项热考突破,专题体系构建,2外因,ABC,催化剂Ⅱ,CuAlO2,逆向移动,CH4等内容,欢迎下载使用。









