



所属成套资源:新高考化学二轮复习课件专题 (含解析)
新高考化学二轮复习课件专题八电解质溶液(含解析)
展开
这是一份新高考化学二轮复习课件专题八电解质溶液(含解析),共60页。PPT课件主要包含了内容索引,核心考点聚焦,专项热考突破,专题体系构建,答案CD,×10-6,25×103,SiO2和铁粉,答案B,答案D等内容,欢迎下载使用。
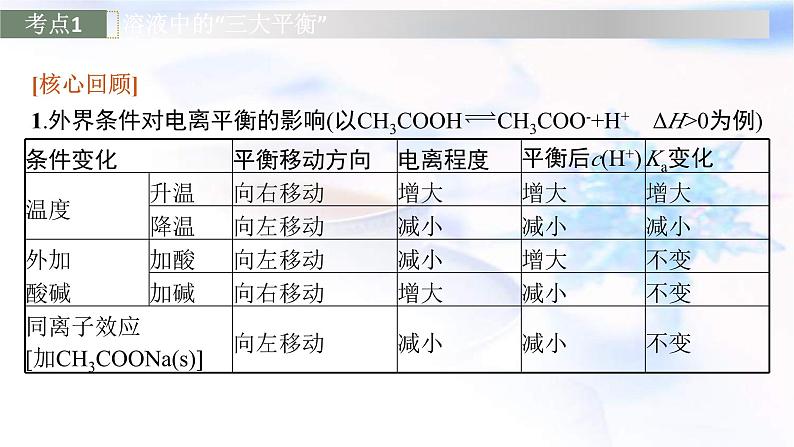
[核心回顾]1.外界条件对电离平衡的影响(以CH3COOH CH3COO-+H+ ΔH>0为例)
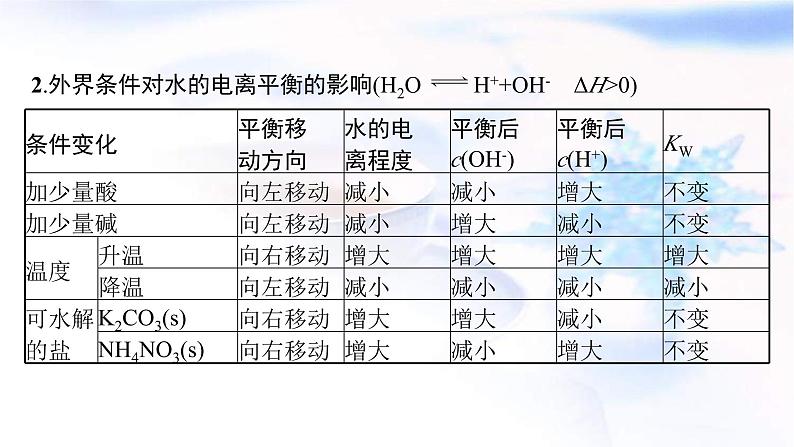
2.外界条件对水的电离平衡的影响(H2O H++OH- ΔH>0)
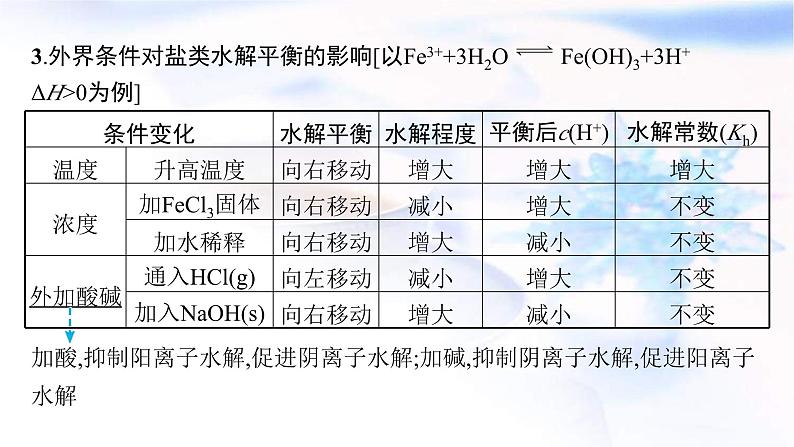
3.外界条件对盐类水解平衡的影响[以Fe3++3H2O Fe(OH)3+3H+ ΔH>0为例]
加酸,抑制阳离子水解,促进阴离子水解;加碱,抑制阴离子水解,促进阳离子水解
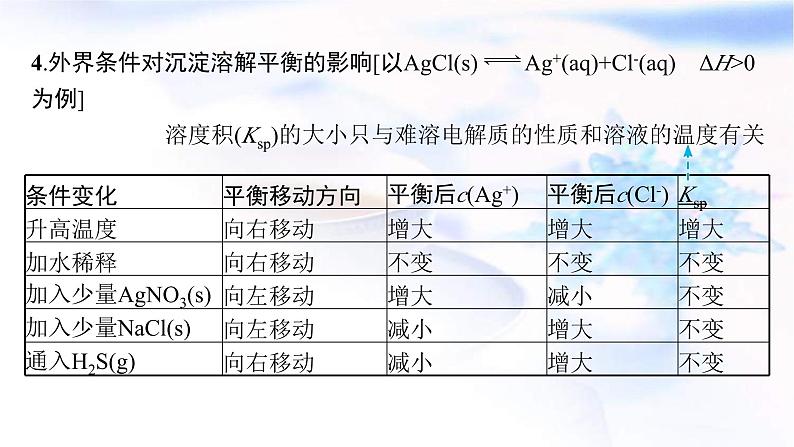
4.外界条件对沉淀溶解平衡的影响[以AgCl(s) Ag+(aq)+Cl-(aq) ΔH>0为例]溶度积(Ksp)的大小只与难溶电解质的性质和溶液的温度有关
[命题角度]角度1电离平衡和溶液的酸碱性【典例】 已知25 ℃时二元酸H2A的 =1.3×10-7, =7.1×10-15。下列说法正确的是( )A.在等浓度的Na2A、NaHA溶液中,水的电离程度前者小于后者B.向0.1 ml·L-1的H2A溶液中通入HCl气体(忽略溶液体积的变化)至pH=3,则H2A的电离度约为0.013%C.向H2A溶液中加入NaOH溶液至pH=11,则c(A2-)>c(HA-)D.取pH=a的H2A溶液10 mL,加蒸馏水稀释至100 mL,则该溶液pH=a+1
角度拓展1.(2022福建莆田模拟)已知,25 ℃时Ka(HNO2)=4.6×10-4。25 ℃时,判断下列说法是否正确。(1)pH=3的HNO2溶液中由水电离出的c(H+)=1×10-3 ml·L-1。( )(2)pH=5的HNO2溶液中:(3)等浓度NaNO2和HNO2的混合溶液呈碱性。( )
提示 (1)HNO2电离产生H+抑制水的电离,25 ℃时pH=3的HNO2溶液中c(H+)=1×10-3 ml·L-1,则由水电离出的c水(H+)=c(OH-)=1×10-11 ml·L-1。
2.(2022辽宁锦州模拟)常温下,浓度均为1 ml·L-1、体积均为V0的两种酸HA和HB,分别加水稀释至体积V,pH的变化曲线如图所示。判断下列说法是否正确。
(1)由图可知,HB是强酸,HA是弱酸。( )(2)相对Y点而言,X点的导电能力更强,X点水的电离程度更大。( )(3)中和等体积1 ml·L-1的两种酸消耗等浓度的NaOH溶液的体积:HB>HA。( )
提示 (2)X、Y点溶液的pH相等,则两点溶液中c(H+)相等,溶液的导电能力相同,水的电离程度相同。(3)HA和HB溶液的浓度均为1 ml·L-1,等体积时n(HA)=n(HB),故消耗等浓度的NaOH溶液的体积相等。
角度2盐类的水解平衡及影响因素【典例】 (2022湖南卷,13)为探究FeCl3的性质,进行了如下实验(FeCl3和Na2SO3溶液浓度均为0.1 ml·L-1)。
依据上述实验现象,结论不合理的是( )A.实验①说明加热促进Fe3+水解反应B.实验②说明Fe3+既发生了水解反应,又发生了还原反应C.实验③说明Fe3+发生了水解反应,但没有发生还原反应D.整个实验说明 对Fe3+的水解反应无影响,但对还原反应有影响
角度拓展1.(2022江苏南京模拟)室温下,通过下列实验探究Na2S溶液的性质。
判断下列说法是否正确。(1)0.1 ml·L-1 Na2S溶液中存在c(OH-)=c(H+)+c(HS-)+c(H2S)。( )(2)实验3得到的溶液中有c(HS-)+2c(S2-)c(Br-)>c(I-)>c(Ag+)
角度拓展1.(2022江西上饶模拟)常温下,向20 mL 1 ml·L-1 CuCl2溶液中滴加2 ml·L-1 Na2S溶液的滴定曲线如图所示。已知:pCu=-lg c(Cu2+),lg 2.5≈0.4,常温下Ksp(FeS)=6.3×10-18; (H2S)=1.2×10-7, (H2S)=7.1×10-15。判断下列说法是否正确。
(1)常温下,S2-的水解常数Kh(S2-)≈8.3×10-8。( )(2)E→F→G的过程中,水的电离程度先减小后增大。( )(3)向1 ml·L-1 FeSO4(aq)中加入足量CuS固体,产生FeS沉淀。( )
(3)F点Na2S和CuCl2恰好完全反应,溶液中c(Cu2+)=c(S2-)=10-17.6 ml·L-1, Ksp(CuS)=c(Cu2+)·c(S2-)=10-35.2,因此向1 ml·L-1 FeSO4溶液中加入足量CuS固体,不会产生FeS沉淀。
2.(2022山东聊城模拟)25 ℃,用NaOH溶液分别滴定HX、CuSO4、FeSO4三种溶液,pM[p表示负对数,M表示 、c(Cu2+)、c(Fe2+)等]随pH变化关系如图所示,已知Ksp[Cu(OH)2]c(X-)>c(OH-)>c(H+)。( )
提示 (1)由于Ksp[Cu(OH)2]c(Na+)>c(H+)>c(OH-);(2)b点:溶质为CH3COONa、CH3COOH,离子浓度关系:c(CH3COO-)=c(Na+)>c(H+)=c(OH-);(3)c点:溶质为CH3COONa,离子浓度关系:c(Na+)>c(CH3COO-)>c(OH-)>c(H+);(4)d点:溶质为等浓度的CH3COONa、NaOH,离子浓度关系:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)。
[命题角度]角度1溶液中微粒浓度的大小关系【典例】 (2021天津卷,10)常温下,下列有关电解质溶液的叙述正确的是( )
角度拓展1.(2022广东汕头模拟)白醋是烹调中的酸味辅料,能调节人体的新陈代谢,其主要成分CH3COOH为一元弱酸。25 ℃时,判断下列说法是否正确。(1)pH=3的CH3COOH溶液中,存在c(H+)=c(CH3COOH)+c(CH3COO-)。( )(2)pH=7的CH3COONH4溶液中,c(CH3COO-)=c( )>c(H+)=c(OH-)。( )(3)pH=10的CH3COONa溶液中,c(CH3COO-)>c(Na+)>c(OH-)>c(H+)。( )
提示 (1)pH=3的CH3COOH溶液中,据电荷守恒可知:c(H+)=c(OH-)+c(CH3COO-)。(3)CH3COONa溶液中CH3COO-发生水解反应而使溶液呈碱性,则有: c(Na+)>c(CH3COO-)>c(OH-)>c(H+)。
2.(2022山东青岛模拟)Na2CO3-NaHCO3缓冲溶液可以将溶液pH控制在9.16~10.83,25 ℃时, (H2CO3)=4×10-7、 (H2CO3)=5×10-11,判断下列说法是否正确。
角度2滴定曲线分析及微粒浓度的比较【典例】 (2021湖南卷,9)常温下,用0.100 0 ml·L-1的盐酸分别滴定20.00 mL浓度均为0.100 0 ml·L-1三种一元弱酸的钠盐(NaX、NaY、NaZ)溶液,滴定曲线如图所示。下列判断错误的是( )
A.该NaX溶液中:c(Na+)>c(X-)>c(OH-)>c(H+)B.三种一元弱酸的电离常数:Ka(HX)>Ka(HY)>Ka(HZ)C.当pH=7时,三种溶液中:c(X-)=c(Y-)=c(Z-)D.分别滴加20.00 mL盐酸后,再将三种溶液混合:c(X-)+c(Y-)+c(Z-)=c(H+)-c(OH-)
角度拓展1.(2022安徽“江南十校”模拟)H3A是一种多元酸,25 ℃时,向1 ml·L-1 H3A溶液中逐滴加入NaOH稀溶液至过量,滴加过程中各种含A微粒的物质的量分数随溶液pH的变化曲线如图所示。判断下列说法是否正确。
(1)H3A溶液中存在:c(H+)=c(OH-)+c(H2A-)+2c(HA2-)+3c(A3-)。( )(2)1 ml·L-1的NaH2A溶液中存在:c(Na+)>c(OH-)>c(H2A-)>c(HA2-)。( )(3)NaH2A溶液中存在:c(H3A)+c(H+)=c(OH-)+c(HA2-)。( )
提示 (1)根据题图有2个交点,可知H3A是二元弱酸,H3A溶液中存在电荷守恒:c(H+)=c(OH-)+c(H2A-)+2c(HA2-)。
2.(2022福建厦门模拟)室温下,向20 mL浓度均为0.1 ml·L-1的HNO3和HNO2混合液中逐滴加入0.1 ml·L-1 NaOH溶液,溶液pH变化曲线如图。判断下列说法是否正确。
——突破一 命题篇——
新教材新高考 滴定曲线及其分析1.滴定曲线中“分布系数”图像及分析分布系数图像是酸碱中和滴定曲线的一种变式,常以pH、分布系数(δ)为横、纵坐标,结合滴定实验数据绘制出关系曲线,这里分布系数(δ)代表组分的平衡浓度占总浓度的分数。一元弱酸和二元弱酸的分布系数图像及分析如下:
典例突破1(2022湖南株洲一模)常温下,已知 (H2CO3)=4.3×10-7, (H2CO3)=5.6×10-11。某二元酸H2R及其钠盐的溶液中,H2R、HR-、R2-三者的物质的量分数随溶液pH变化关系如图所示,下列叙述正确的是( )
A.H2R的二级电离常数 的数量级为10-4B.在pH=4的溶液中:3c(R2-)c(NH3·H2O),B错误;c点为等浓度的醋酸钠和醋酸铵的混合溶液,溶液中存在元素质量守恒关系:c(CH3COO-)+c(CH3COOH)= c(Na+)+c( )+c(NH3·H2O),C正确;a点、b点均抑制水的电离,b点抑制水的电离程度小于a点,c点 和CH3COO-在溶液中水解促进水的电离,则a点到c点过程中,溶液中水的电离程度一直增大,D正确。
针对训练2(双选)(2022湖南娄底二模)常温下,向1 L 1.0 ml·L-1的NaClO溶液中缓慢通入SO2气体,使其充分吸收,溶液的pH与通入SO2的物质的量关系如图所示(忽略溶液体积的变化和NaClO、HClO的分解,以上发生的氧化还原反应均为不可逆反应)。下列说法错误的是( )
A.常温下,HClO电离平衡常数的数量级为10-8B.水的电离程度:ac,B错误;
针对训练3(2022广东汕头二模)甲酸铵常用于电解、电容器行业。25 ℃时,用HCl或NaOH固体改变0.1 ml·L-1的HCOONH4溶液的pH,lg c(HCOOH)、lg c(NH3·H2O)、lg c(H+)和lg c(OH-)随pH变化的关系如图所示。下列说法错误的是( )
[已知:Ka(HCOOH)=1.8×10-4,Kb(NH3·H2O)=1.8×10-5]A.Q点对应溶液pH=7B.曲线①代表lg c(H+),曲线③代表lg c(NH3·H2O)C.0.1 ml·L-1 HCOONH4溶液中,c(H+)+c(HCOOH)=c(OH-)+c(NH3·H2O)D.P点存在c(NH3·H2O)>c(OH-)=c(HCOOH)>c(H+)
答案 A解析 随着溶液pH的增大,c(HCOOH)减小、c(NH3·H2O)增大、c(H+)减小、c(OH-)增大,则lgc(HCOOH)减小、lgc(NH3·H2O)增大、lgc(H+)减小、lgc(OH-)增大,溶液的pH=7时,lgc(H+)=lgc(OH-),根据图示可知,曲线①、②、③、④分别表示lgc(H+)、lgc(HCOOH)、lgc(NH3·H2O)、lgc(OH-)。Q点lgc(HCOOH)=lgc(NH3·H2O),即c(HCOOH)=c(NH3·H2O),根据题意可知,此时溶液的pHlgc(HCOOH)=lgc(OH-)>lgc(H+),则存在c(NH3·H2O)>c(OH-) =c(HCOOH)>c(H+),D正确。
2.中和滴定原理及应用(科学探究与创新意识)新高考湖南卷、河北卷等考查了酸碱中和滴定原理及应用,涉及“双指示剂法”滴定操作,利用标准盐酸滴定Na2CO3、NaHCO3的混合液,先加入酚酞作指示剂,滴定过程Na2CO3+HCl ══ NaHCO3+NaCl,达到滴定终点后,再加入甲基橙,滴定过程NaHCO3+HCl ══ NaCl+H2O+CO2↑,要求考生描述实验现象,处理、分析实验数据和结果,得出相应结论。
典例突破2(2021湖南卷,15节选)碳酸钠俗称纯碱,是一种重要的化工原料。以碳酸氢铵和氯化钠为原料制备碳酸钠,并测定产品中少量碳酸氢钠的含量。过程如下:步骤Ⅰ.Na2CO3的制备
步骤Ⅱ.产品中NaHCO3含量测定①称取产品2.500 g,用蒸馏水溶解,定容于250 mL容量瓶中;②移取25.00 mL上述溶液于锥形瓶,加入2滴指示剂M,用0.100 0 ml·L-1盐酸标准溶液滴定,溶液由红色变至近无色(第一滴定终点),消耗盐酸V1 mL;③在上述锥形瓶中再加入2滴指示剂N,继续用0.100 0 ml·L-1盐酸标准溶液滴定至终点(第二滴定终点),又消耗盐酸V2 mL;④平行测定三次,V1平均值为22.45,V2平均值为23.51。(1)指示剂N为 ,描述第二滴定终点前后颜色变化 ; (2)产品中NaHCO3的质量分数为 (保留三位有效数字); (3)第一滴定终点时,某同学俯视读数,其他操作均正确,则NaHCO3质量分数的计算结果 (填“偏大”“偏小”或“无影响”)。
答案 (1)甲基橙 由黄色变橙色(2)3.56% (3)偏大解析 (1)用盐酸标准溶液滴定含有碳酸氢钠杂质的碳酸钠溶液时,由于开始时溶液呈碱性,且首先发生反应:Na2CO3+HCl ══ NaHCO3+NaCl,此时所用指示剂M为酚酞,终点的现象是:溶液由红色变为近无色。第二个滴定阶段发生的反应为NaHCO3+HCl ══ NaCl+H2O+CO2↑,由于最终溶液呈弱酸性,所以可用甲基橙作指示剂(N)。滴定终点的现象是溶液由黄色变为橙色。
(2)根据滴定过程中的反应原理:Na2CO3+HCl ══ NaHCO3+NaCl、NaHCO3+HCl ══ NaCl+H2O+CO2↑可知,2.500 g产品中碳酸氢钠所消耗的盐酸的体积为(V2-V1) mL×10=(23.51-22.45) mL×10,则样品中n(NaHCO3)=(23.51-22.45) mL×10×10-3 L·mL-1×0.100 0 ml·L-1= 1.06×10-3 ml。所以产品中碳酸氢钠的质量分数为(3)由于滴定管的刻度上小下大,当第一滴定终点时俯视读数,会使所读刻度值偏小,即V1偏小,引起(V2-V1)偏大,则最终所算得的碳酸氢钠的质量分数偏大。
原生态样卷剖析样卷示例A(低分卷)
样卷示例B(高分卷)
方法点拨“双指示剂法”就是分别以酚酞和甲基橙为指示剂,在同一份溶液中用HCl标准溶液作滴定剂进行连续滴定,根据两个终点所消耗的HCl标准溶液的体积计算混合碱中各组分的含量,这里“混合碱”是指NaOH和Na2CO3或Na2CO3和NaHCO3的混合物。(1)先加酚酞,用标准盐酸进行滴定,至溶液由红色恰好褪去,消耗盐酸体积为V1:NaOH+HCl ══ NaCl+H2O、Na2CO3+HCl ══ NaHCO3+NaCl。(2)后加甲基橙,用标准盐酸进行滴定,至溶液由黄色变为橙色,消耗盐酸体积为V2:NaHCO3+HCl ══ NaCl+CO2↑+H2O。(3)分析:若V1>V2,混合碱则为NaOH和Na2CO3的混合物;若V1c(R2-)D.pH=7时,c(Na+)+c(H2R)
相关课件
这是一份新高考化学二轮总复习 专题突破课件 专题八 电解质溶液(含解析),共60页。PPT课件主要包含了a+n,b-n,NaBO2+4H2↑,答案C,答案D,答案CD,答案B,答案A,25×10-4,19×10-7等内容,欢迎下载使用。
这是一份新高考化学二轮复习精品课件专题八电解质溶液(含解析),共60页。PPT课件主要包含了内容索引,核心考点聚焦,专项热考突破,专题体系构建,答案CD,×10-6,25×103,SiO2和铁粉,答案B,答案D等内容,欢迎下载使用。
这是一份2023届高考化学二轮复习专题八电解质溶液课件,共60页。PPT课件主要包含了内容索引,核心考点聚焦,专项热考突破,专题体系构建,答案CD,×10-6,25×103,SiO2和铁粉,答案B,答案D等内容,欢迎下载使用。









