



所属成套资源:新高考化学二轮复习讲与练专题 (2分,原卷版+解析版)
新高考化学二轮复习讲与练专题一0一 化学工艺流程(解析版)
展开
这是一份新高考化学二轮复习讲与练专题一0一 化学工艺流程(解析版),文件包含新高考化学二轮复习讲与练专题十一化学工艺流程原卷版docx、新高考化学二轮复习讲与练专题十一化学工艺流程解析版docx等2份试卷配套教学资源,其中试卷共88页, 欢迎下载使用。
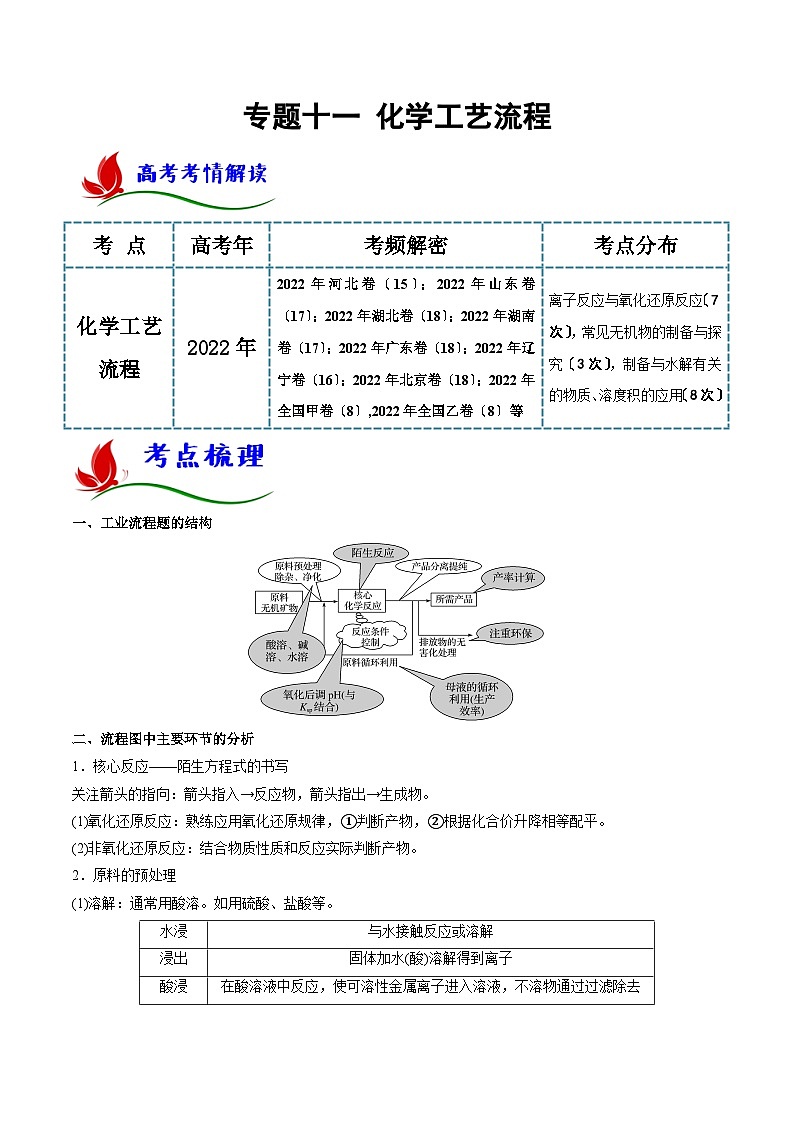
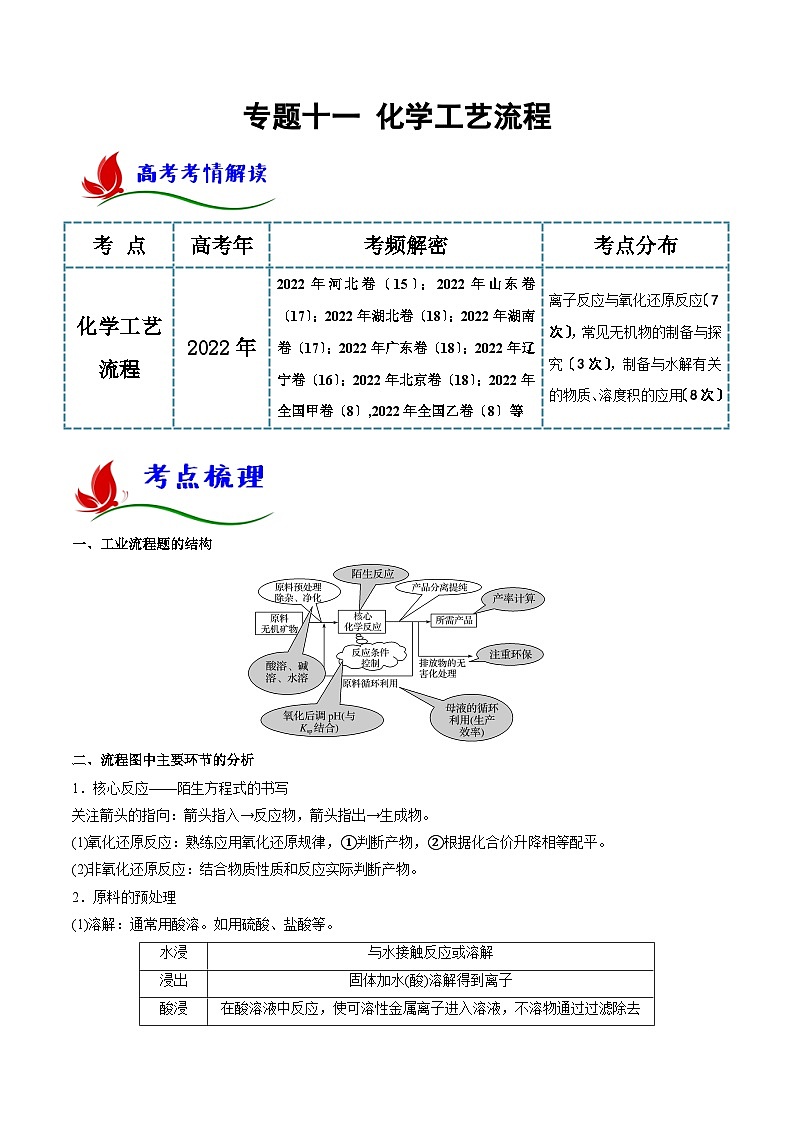
一、工业流程题的结构
二、流程图中主要环节的分析
1.核心反应——陌生方程式的书写
关注箭头的指向:箭头指入→反应物,箭头指出→生成物。
(1)氧化还原反应:熟练应用氧化还原规律,①判断产物,②根据化合价升降相等配平。
(2)非氧化还原反应:结合物质性质和反应实际判断产物。
2.原料的预处理
(1)溶解:通常用酸溶。如用硫酸、盐酸等。
(2)灼烧、焙烧、煅烧:改变结构,使一些物质能溶解,并使一些杂质在高温下氧化、分解。
(3)审题时要“瞻前顾后”,注意物质性质及反应原理的前后联系。
3.常用的控制反应条件的方法
(1)调节溶液的pH。常用于使某些金属离子形成氢氧化物沉淀。调节pH所需的物质一般应满足两点:
①能与H+反应,使溶液pH增大;
②不引入新杂质。
例如:若要除去Cu2+中混有的Fe3+,可加入CuO、CuCO3、Cu(OH)2、Cu2(OH)2CO3等物质来调节溶液的pH,不可加入NaOH溶液、氨水等。
(2)控制温度。根据需要升温或降温,改变反应速率或使平衡向需要的方向移动。
(3)趁热过滤。防止某物质降温时会析出。
(4)冰水洗涤。洗去晶体表面的杂质离子,并减少晶体在洗涤过程中的溶解损耗。
4.常用的提纯方法
(1)水溶法:除去可溶性杂质。
(2)酸溶法:除去碱性杂质。
(3)碱溶法:除去酸性杂质。
(4)氧化剂或还原剂法:除去还原性或氧化性杂质。
(5)加热灼烧法:除去受热易分解或易挥发的杂质。
(6)调节溶液的pH法:如除去酸性溶液中的Fe3+等。
5.常用的分离方法
(1)过滤:分离难溶物和易溶物,根据特殊需要采用趁热过滤或者抽滤等方法。
(2)萃取和分液:利用溶质在互不相溶的溶剂里的溶解度不同提取分离物质,如用CCl4或苯萃取溴水中的溴。
(3)蒸发结晶:提取溶解度随温度变化不大的溶质,如从溶液中提取NaCl。
(4)冷却结晶:提取溶解度随温度变化较大的溶质、易水解的溶质或结晶水合物,如KNO3、FeCl3、CuCl2、CuSO4·5H2O、FeSO4·7H2O等。
(5)蒸馏或分馏:分离沸点不同且互溶的液体混合物,如分离乙醇和甘油。
(6)冷却法:利用气体液化的特点分离气体,如合成氨工业采用冷却法分离平衡混合气体中的氨气。
三、化学工艺流程题的分析方法
主线分析“原料→中间转化物质→目标产物”
(1)反应与物质的转化:分析每一步操作的目的及所发生的化学反应,跟踪物质转化的形式。尤其要注意原料中的杂质在流程中是如何被除去的。滤渣、滤液成分的确定:反应过程中哪些物质(离子)发生了变化?产生了哪些新离子?这些离子间是否能发生化学反应?所加试剂是否过量?
(2)循环物质的确定
(3)副产品的判断
探究一 离子反应与氧化还原反应的综合应用
草酸钴可用于指示剂和催化剂。其中草酸钴的制备可用水钴矿(主要成分为,含少量等)制取工艺流程如图所示:
已知:①浸出液含有的阳离子主要有等;
②酸性条件下,不会氧化,转化为;
③部分阳离子的氢氧化物形式沉淀时溶液的见下表。
(1)回答下列问题:浸出过程中加入的主要目的_______,发生反应的离子方程式为_______。
(2)向浸出液中加入发生反应的离子方程式为_______。
(3)向滤液Ⅰ中加入溶液得到的沉淀的主要成分是_______(写化学式)。
(4)萃取剂对金属离子的萃取率与的关系如图1所示,萃取剂的作用是除锰离子,其使用的适宜范围是_______(填字母代号)。
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5
(5)①实验室里灼烧晶体,所需要的硅酸盐质仪器除了酒精灯和玻璃棒外,还有_______ (填仪器名称)
②热分解质量变化过程如图2所示。其中以前是隔绝空气加热,以后是在空气中加热。A、B、C均为纯净物,C点所示产物的化学式是_______。
【答案】(1) 将Fe3+和C3+还原
(2)
(3)CaF2、MgF2
(4)B
(5) (瓷)坩埚和泥三角 C2O3
【详解】(1)①具有还原性,能还原氧化性离子铁离子和钴离子,所以浸出过程中加入的主要目的是将Fe3+和C3+还原;
故答案为:将Fe3+和C3+还原;
②发生反应的离子方程式为;
故答案为: ;
(2)NaClO3加入浸出液中,是为了将Fe2+氧化为Fe3+,其反应离子方程式为;
故答案为:;
(3)向滤液Ⅰ中加入溶液是为了除镁钙,则得到的沉淀的主要成分是CaF2、MgF2;
故答案为:CaF2、MgF2;
(4)由图可知,调节pH在3.0~3.5之间,可使Mn2+萃取较完全,并尽可能减少C2+损失,故选B;
故答案为:B;
(5)①实验室里灼烧晶体,所需要的硅酸盐质仪器除了酒精灯和玻璃棒外,还有瓷坩埚和泥三角;
故答案为:瓷坩埚和泥三角;
②18.30g的物质的量为 ,以后是在空气中加热,则C点对应的产物为钴的氧化物,质量为8.30g,而0.1ml钴的质量为5.90g,则该氧化物中氧元素质量为8.30g-5.90g=2.40g,C原子与O原子的物质的量之比为 ,故C点所示产物的化学式是C2O3;
故答案为:C2O3。
【变式练习】
1.(2022·山东潍坊·高三期中)常温下是一种无色气体、溶于浓硫酸、易水解,常用作火箭高能燃料。工业用液氨法制取的流程如下:
已知:①硼酐是一种难溶物;
②石灰石中含有微量氧化铁、二氧化硅、硫单质等
回答下列问题:
(1)氨化釜中主要产物为,则滤渣Ⅰ的成分是_______,操作Ⅱ的名称_______。
(2)反应釜Ⅰ中产生两种气体,发生反应的离子方程式为_______。
(3)经过必要的处理可循环利用的物质是_______。
(4)反应釜Ⅱ中发生反应的化学方程式_______。
(5)利用离子色谱法可以检测三氟化硼中硫元素的含量,将样品通过检测液,进行色谱分析,得到如图所示结果。出现曲线1的原因可能是_______。
(6)利用电解氟硅酸钠的方法可以制取高纯度,装置如图所示。甲室中加入的电解质为_______,a膜选用_______(“阴离子”“阳离子”“质子”)交换膜。
【答案】(1) SiO2 蒸馏
(2)CaCO3+2+2F-=CaF2+CO2↑+2NH3↑+H2O
(3)氨气
(4)3CaF2+B2O3+3H2SO4(浓)=3CaSO4+2BF3+3H2O
(5)浓硫酸与S反应生成了SO2,SO2溶于水生成了亚硫酸根离子
(6) Na2SiF6溶液 阳离子
【详解】(1)根据分析可知,滤渣Ⅰ成分为SiO2,操作Ⅱ为蒸馏。
(2)反应釜I中NH4F和CaCO3反应生成氨气、二氧化碳和氟化钙,离子方程式为CaCO3+2+2F-=CaF2+CO2↑+2NH3↑+H2O。
(3)反应釜Ⅰ中生成了氨气,经必要处理后可生成液氨重复利用。
(4)根据分析可知,反应釜Ⅱ中反应的化学方程式为3CaF2+B2O3+3H2SO4(浓)=3CaSO4+2BF3+3H2O。
(5)浓硫酸与S反应生成了SO2,SO2溶于水生成了亚硫酸根离子。
(6)阳极上水失电子生成氧气和氢离子,氢离子与Na2SiF6反应生成H2SiF6,则甲室加入的电解质为Na2SiF6溶液,阴极上水得电子生成氢气和氢氧根离子,为防止丙室产生的氢氧根离子进入甲室与H2SiF6反应,同时为得到高纯度的H2SiF6,甲室的Na+需能通过a膜向丙室移动,则a膜选用阳离子交换膜。
2.(2022·辽宁沈阳·高三期中)碳酸锰在工业上常用作脱硫的催化剂、瓷釉、涂料和清漆的颜料。工业上利用软锰矿(主要成分是,还含有等杂质)制取碳酸锰的流程如图所示。
已知:还原焙烧的主反应为。可能用到的数据如表所示:
根据要求回答下列问题:
(1)在实验室进行步骤A操作时,需要用到的主要仪器的名称:_______。
(2)步骤B中为提高浸取的速率采取的方法有_______(写两种方法)。
(3)步骤D发生反应的离子方程式为_______。
(4)步骤E中调节的范围为_______。
(5)步骤G发生反应的化学方程式为_______。
(6)已知溶液能将氧化为。证明步骤G中已完全反应的方法为___。
【答案】(1)铁坩埚
(2)搅拌、适当升高反应混合物的温度(合理即可)
(3)
(4)
(5)
(6)取少量上层清液于试管中,向其中滴入溶液,溶液不变为紫红色,可证明已经沉淀完全
【详解】(1)焙烧时碳酸钙会和瓷坩埚中的二氧化硅反应,所以应选用铁坩埚。
(2)步骤B中为提高浸取的速率采取的方法可以是搅拌、适当升高反应混合物的温度等。
(3)步骤D中加入可以将氧化为,根据电子守恒、电荷守恒、原子守恒,结合物质的拆分原则,可得该反应的离子方程式为:。
(4)沉淀完全时的和开始沉淀时的,所以为完全除去,又不减小的含量的范围为。
(5)在步骤G中与反应生成沉淀、和,反应的化学方程式为:。
(6)若步骤G中已完全反应,则取少量上层清液于试管中,向其中滴入溶液,溶液不变为紫红色,可证明已经沉淀完全。
3.某工厂从废含镍有机催化剂中回收镍的工艺流程如图所示(已知废催化剂中含有及一定量的和有机物,镍及其化合物的化学性质与铁的类似,但的性质较稳定)。回答下列问题:
已知:部分阳离子以氢氧化物的形式完全沉淀时的如下表所示。
(1)为28号元素,写出原子基态电子排布式_______,用乙醇洗涤废催化剂的目的是_______,从废液中回收乙醇的方法是_______。
(2)为提高酸浸速率,可采取的措施有_______(答一条即可)
(3)硫酸酸浸后所得滤液A中含有的金属离子是_______,向其中加入反应的离子方程式为_______。
(4)滤液C进行如下所示处理可以制得。滤液溶液
①操作X是_______,过滤,洗涤,干燥。
②在强碱溶液中用氧化,可制得碱性镍镉电池电极材料,该反应的离子方程式是_______。
【答案】(1) 1s22s22p63s23p63d84s2 溶解、除去催化剂表面的有机物 蒸馏
(2)将废催化剂粉碎或适当地提高硫酸的浓度或升高浸泡时的温度;
(3) 、、
(4) 冷却结晶
【详解】(1)①为28号元素,基态电子排布式为:1s22s22p63s23p63d84s2
②用乙醇可以溶解废催化剂表面的有机物,达到除去目的,答案为:溶解、除去催化剂表面的有机物
③可以利用乙醇与废液中有机物的沸点不同采用蒸馏的方法,答案为:蒸馏
(2)将废催化剂粉碎,增大反应物的接触面积,或适当地提高硫酸的浓度,或升高浸泡时的温度等措施均可以提高酸浸速率,故答案为:将废催化剂粉碎或适当地提高硫酸的浓度或升高浸泡时的温度;
(3)①由分析可知,硫酸酸浸后所得滤液A中含有硫酸镍、硫酸铝、硫酸铁,则溶液中含有的金属阳离子为、、;
②向滤液A中加入过氧化氢溶液的目的是保温条件下将亚铁离子氧化为铁离子,便于调节溶液pH时,将铁离子转化为沉淀除去,反应的离子方程式为
(4)①①硫酸镍的溶解度随温度的升高变化较大,故酸化后的硫酸镍溶液经冷却结晶得到七水硫酸镍晶体,故答案为:冷却结晶;
②由题意可知,生成碱式氧化镍的反应为碱性条件下,硫酸镍溶液与次氯酸钠溶液发生氧化还原反应生成碱式氧化镍沉淀、硫酸钠、氯化钠和水,反应的离子方程式为,故答案为:。
探究二 常见无机物的制备、分离与提纯
用含钴废料(主要成分为,含有少量杂质)制备的流程如图所示。
已知:①有关金属离子形成氢氧化物沉淀的范围如下:
②在为4~6时,水解生成含胶粒的胶体。
请回答下列问题:
(1)“酸浸”步骤中可以有效提高废料利用率的方法有_______________(写出一种方法即可)。
(2)“酸浸”时与发生反应的离子方程式为______________________________。
(3)“除铁”中,溶液对除铁率和钴回收率影响如图所示。该步骤应控制范围是3.0~4.0图中钴回收率骤降的可能原因是______________________________。
(4)“除镍”步骤的实验操作名称是______________________________。
(5)“沉钴”时温度不能太低也不能太高,原因是______________________________。
(6)“沉钴”步骤的化学反应方程式是_____________________________________________。
【答案】(1)粉碎、搅拌等
(2)
(3)水解生成含胶粒的胶体;胶体吸附大量的导致回收率下降
(4)萃取分液
(5)碳酸氢铵不稳定,温度太高会分解,温度过低会导致反应速率很慢
(6)
【详解】(1)“酸浸”步骤中可以有效提高废料利用率的方法有粉碎、搅拌等;
(2)“酸浸”时与发生反应生成二价钴和氧气、水,离子方程式为;
(3)已知,在为4~6时,水解生成含胶粒的胶体;胶体吸附大量的导致回收率下降;
(4)“除镍”步骤中为分离水层和有机层的操作,实验操作名称是萃取分液;
(5)“沉钴”时温度不能太低也不能太高,原因是碳酸氢铵不稳定,温度太高会分解,温度过低会导致反应速率很慢,降低效率;
(6)“沉钴”步骤中碳酸氢铵和反应生成硫酸铵和二氧化碳、水、,化学反应方程式是。
【变式练习】
1.(2022·宁夏·平罗中学高三期中)金属钛是一种性能优越的结构材料和功能材料,被誉为“太空金属”。以云南富民钛铁精矿(主要成分为TiO2、FeO、Fe2O3,含SiO2、Al2O3等杂质)为原料,制备海绵状金属钛的流程设计如图:
已知:TiCl4及所含杂质氯化物的性质
回答下列问题:
(1)“氯化”过程需在沸腾炉中进行,且需维持在1050℃,若TiO2氯化时生成的CO与CO2的物质的量之比为1:1,则该反应的化学方程式为_______;氯化产物冷却至室温,经过滤得到粗TiCl4混合液,则滤渣中含有_______(填化学式)。
(2)“精制"过程中,粗TiC4经两步蒸馏得纯TiCl4。第一步蒸馏分离出的杂质是_______(填化学式);再将温度控制在一定的范围内蒸馏分离出纯TiCl4,所控制温度范围是_______。
(3)“氧化”过程的产物中可循环利用的是_______(填化学式)。
【答案】(1) FeCl3、AlCl3
(2) SiCl4 高于136℃而低于181℃
(3)Cl2
【详解】(1)维持在1050℃,若TiO2氯化时生成的CO与CO2的物质的量之比为1:1,反应同时生成四氯化碳,该反应的化学方程式为 ;根据图表中物质的沸点可知,氯化产物中氯化铁、氯化铝也会被气化导出,则冷却至室温,经过滤得到粗TiCl4混合液,则滤渣中含有FeCl3、AlCl3;
(2)根据图表中物质的沸点可知,“精制"过程中,粗TiC4经两步蒸馏得纯TiCl4,SiCl4沸点较低,故第一步蒸馏分离出的杂质是SiCl4;再将温度控制在一定的范围内蒸馏分离出纯TiCl4,所控制温度范围是高于136℃而低于181℃;
(3)“氧化”过程四氯化钛和氧气反应生成二氧化钛和氯气,氯气在氯化过程中可循环利用。
2.(2022·福建·泉州七中高三期中)某化工厂从含NiO的废料(杂质为Fe2O3、CaO、CuO中回收、制备具有良好的电化学活性和高堆积密度的羟基氧化镍(NiOOH)的工艺流程如下图:
(1)如图是酸浸时镍的浸出率与温度的关系,则酸浸时合适的浸出温度是_______℃,若酸浸时将温度控制在80℃左右,则料渣1中会含有一定量的,其可能的原因_______。
(2)合适温度下,料渣1的主要成分是_______。
(3)生成S的化学方程式为_______。
(4)试剂X是一种绿色氧化剂,其化学式为_______,X参与反应时氧化剂与还原剂物质的量之比为_______,试剂Y用于调节溶液的pH,则pH的调控范围是_______(与沉淀相关的数据如表所示)。
(5)写出氧化过程中反应的离子方程式:_______
(6)工业上也可用电解碱性悬浊液的方法制备NiOOH,加入一定量的KCl有助于提高生产效率,原因_______。
【答案】(1) 70℃ Ni2+能水解,生成Ni(OH)2,升温能促进水解
(2)硫酸钙(CaSO4)
(3)
(4) H2O2 1:2 3.2≤pH
相关试卷
这是一份新高考化学二轮复习讲与练专题一0五 有机化学基础(解析版),文件包含新高考化学二轮复习讲与练专题十五有机化学基础原卷版docx、新高考化学二轮复习讲与练专题十五有机化学基础解析版docx等2份试卷配套教学资源,其中试卷共119页, 欢迎下载使用。
这是一份新高考化学二轮复习讲与练专题一0二 化学反应原理综合(解析版),文件包含新高考化学二轮复习讲与练专题十二化学反应原理综合原卷版docx、新高考化学二轮复习讲与练专题十二化学反应原理综合解析版docx等2份试卷配套教学资源,其中试卷共117页, 欢迎下载使用。
这是一份新高考化学二轮复习讲与练专题一0三 化学实验综合探究(解析版),文件包含新高考化学二轮复习讲与练专题十三化学实验综合探究原卷版docx、新高考化学二轮复习讲与练专题十三化学实验综合探究解析版docx等2份试卷配套教学资源,其中试卷共114页, 欢迎下载使用。








