




所属成套资源:新高考化学二轮复习高频考点练习(2份,原卷版+解析版)
新高考化学二轮复习高频考点练习29 化学反应速率平衡图像(解析版)
展开
这是一份新高考化学二轮复习高频考点练习29 化学反应速率平衡图像(解析版),文件包含新高考化学二轮复习高频考点练习29化学反应速率平衡图像原卷版docx、新高考化学二轮复习高频考点练习29化学反应速率平衡图像解析版docx等2份试卷配套教学资源,其中试卷共18页, 欢迎下载使用。
A.B.气体的总物质的量:
C.a点平衡常数:D.反应速率:
2.(2021·广东卷)反应经历两步:①;②。反应体系中、、的浓度c随时间t的变化曲线如图所示。下列说法不正确的是( )
A.a为随t的变化曲线
B.时,
C.时,的消耗速率大于生成速率
D.后,
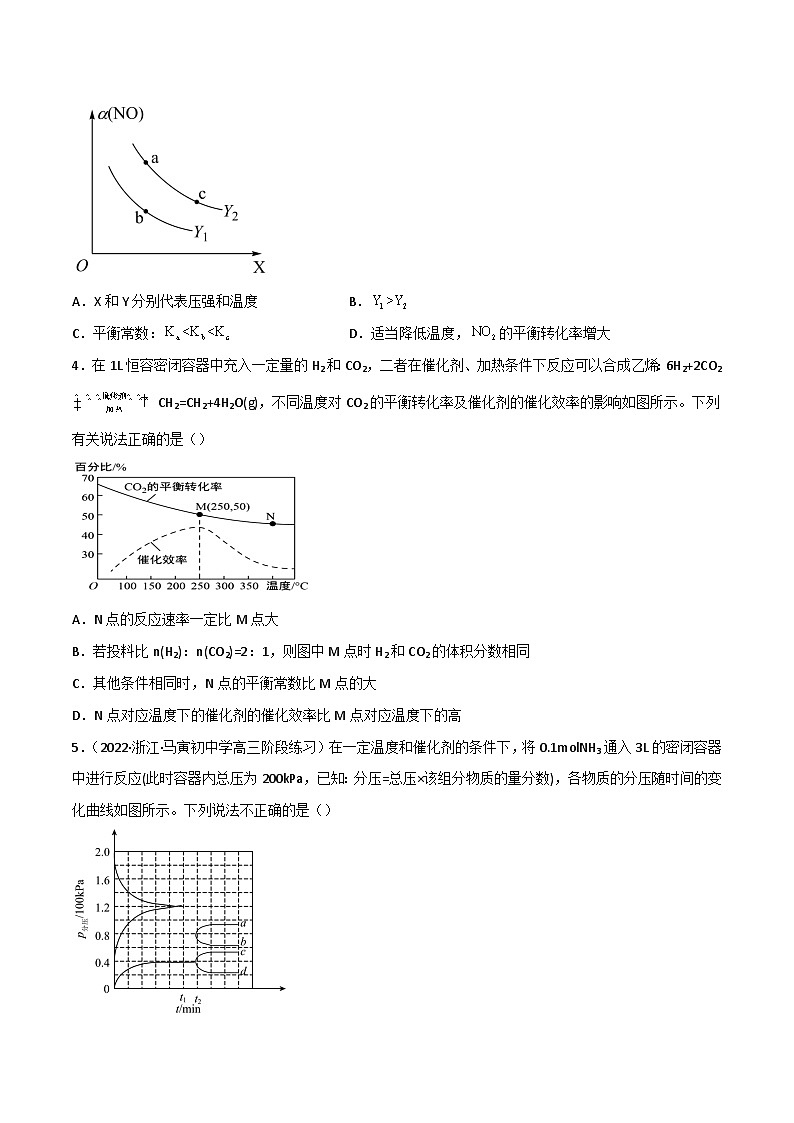
3.(2021·河北省保定市部分学校高三模拟)硝酸厂常用催化还原法处理尾气。在催化条件下可以将还原为,反应原理为 ,的平衡转化率随温度、压强的变化示意图如图所示,下列说法正确的是( )
A.X和Y分别代表压强和温度B.
C.平衡常数:D.适当降低温度,的平衡转化率增大
4.在1L恒容密闭容器中充入一定量的H2和CO2,二者在催化剂、加热条件下反应可以合成乙烯:6H2+2CO2CH2=CH2+4H2O(g),不同温度对CO2的平衡转化率及催化剂的催化效率的影响如图所示。下列有关说法正确的是()
A.N点的反应速率一定比M点大
B.若投料比n(H2):n(CO2)=2:1,则图中M点时H2和CO2的体积分数相同
C.其他条件相同时,N点的平衡常数比M点的大
D.N点对应温度下的催化剂的催化效率比M点对应温度下的高
5.(2022·浙江·马寅初中学高三阶段练习)在一定温度和催化剂的条件下,将0.1mlNH3通入3L的密闭容器中进行反应(此时容器内总压为200kPa,已知:分压=总压×该组分物质的量分数),各物质的分压随时间的变化曲线如图所示。下列说法不正确的是()
A.若保持容器体积不变,氨气分压不变可说明反应已达平衡状态
B.若保持容器体积不变,用H2浓度变化表示0~t1时间内的反应速率v(H2)= ml·L-1·min-1
C.t2时将容器体积迅速缩小至原来的一半并保持不变,图中能正确表示压缩后N2分压变化趋势的曲线是d
D.若保持容器体积不变,t2时充入He,反应仍处于平衡状态,氨气的分压保持不变
6.(双选)恒容密闭容器中充入3 ml CH4和6 ml H2S,发生反应:CH4(g)+2H2S(g)CS2(g)+4H2(g),温度变化对平衡时各组分的物质的量分数的影响如图所示。下列说法错误的是( )
A.当满足v逆(H2S)=2v正(H2)时,反应达到平衡状态
B.高温、低压条件有利于提高CH4的平衡转化率
C.M点时,保持温度不变,继续充入3 ml CH4和6 ml H2S,达到新平衡时,CH4的物质的量分数小于H2
D.图中N点对应温度下,以物质的量分数表示的化学平衡常数Kx=
7.(2022·江苏省如东高级中学高三开学考试)合成气是一种重要的化工原料气,主要组分为CO和H2。用甲烷、二氧化碳自热重整可制备合成气,反应原理如下:
反应I:CH4(g)+2O2(g)CO2(g)+2H2O(g) △H1=-820.6kJ·ml-1
反应II:CH4(g)+CO2(g)2CO(g)+2H2(g) △H2=+247.1kJ·ml-1
反应III:CH4(g)+H2O(g)CO(g)+3H2(g) △H3=+205.9kJ·ml-1
反应IV:CO2(g)+H2(g)CO(g)+H2O(g) △H4
不同温度下,向体积为VL的含少量O2的恒压容器按照n(CO2):n(CH4)=1投料,实验测得不同压强下平衡时随温度的变化关系如图所示。下列说法正确的是( )
A.△H4=-41.2kJ·ml-1
B.某温度下,反应II的平衡常数随压强增大而减小
C.由图可知,p1>p2>p3
D.压强为p2时,T>Tm后,升高温度对反应IV的促进作用更大
8.(2021·天津卷节选)CS2是一种重要的化工原料。工业上可以利用硫(S8)与CH4为原料制备CS2,S8受热分解成气态S2,发生反应,回答下列问题:
(1)某温度下,若S8完全分解成气态S2。在恒温密闭容器中,S2与CH4物质的量比为2∶1时开始反应。
①当CS2的体积分数为10%时,CH4的转化率为___________。
②当以下数值不变时,能说明该反应达到平衡的是___________(填序号)。
a.气体密度b.气体总压c.CH4与S2体积比d.CS2的体积分数
(2)一定条件下,CH4与S2反应中CH4的平衡转化率、S8分解产生S2的体积分数随温度的变化曲线如图所示。据图分析,生成CS2的反应为___________(填“放热”或“吸热”)反应。工业上通常采用在600~650℃的条件下进行此反应,不采用低于600℃的原因是___________。
9.CO2资源化利用对缓解碳减排压力具有重要意义。在二氧化碳催化加氢制甲烷的反应体系中,发生的主要反应的热化学方程式如下:
反应I:CO2(g)+4H2(g)CH4(g)+2H2O(g) △H1=-164.7kJ·ml-1
反应II:CO2(g)+H2(g)CO(g)+H2O(g) △H2=+41.2kJ·ml-1
反应III:2CO(g)+2H2(g)CO2(g)+CH4(g) △H3=-247.1kJ·ml-1
向恒压、密闭容器中通入1mlCO2和4mlH2,平衡时体系内CH4、CO、CO2的物质的量(n)与温度(T)的变化关系如图所示。
回答下列问题:
(1)反应I~III中,属于吸热反应的是反应____(填反应序号)。
(2)反应III的平衡常数表达式K=____。
(3)盖斯定律的重要价值是可以利用已知反应的反应热求得未知反应的反应热,利用上述反应计算CH4(g)+H2O(g)CO(g)+3H2(g)的△H=____。
(4)结合上述反应,图中CO的物质的量随温度的变化的原因是_____。
(5)在实际生产中为了提高甲烷的产量,选择的反应条件为较低温度和使用合适的催化剂。
①从反应原理角度说明选择较低温度的理由是____。
②从反应原理角度说明选择使用合适的催化剂的理由是____。
(6)CO2能与H2反应制得甲醇(CH3OH):CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H<0。一定条件下,将2mlCO2和4mlH2充入密闭容器中,发生反应制取甲醇,CO2的平衡转化率与温度、平衡总压强的关系如图所示。
①p1、p2、p3由大到小的顺序为_____。
②255℃时,该反应的压强平衡常数Kp=_____(MPa)-2(Kp为以分压表示的平衡常数,分压=总压×物质的量分数;计算结果保留1位小数)。
相关试卷
这是一份新高考化学二轮复习高频考点练习27 化学平衡移动原理(解析版),文件包含新高考化学二轮复习高频考点练习27化学平衡移动原理原卷版docx、新高考化学二轮复习高频考点练习27化学平衡移动原理解析版docx等2份试卷配套教学资源,其中试卷共18页, 欢迎下载使用。
这是一份新高考化学二轮复习高频考点追踪练习专题09 化学反应速率与化学平衡(讲义)(2份打包,原卷版+解析版),文件包含新高考化学二轮复习高频考点追踪练习专题09化学反应速率与化学平衡讲义原卷版docx、新高考化学二轮复习高频考点追踪练习专题09化学反应速率与化学平衡讲义解析版docx等2份试卷配套教学资源,其中试卷共120页, 欢迎下载使用。
这是一份高考化学二轮复习讲义+分层训练(新高考专用) 高考解密07 化学反应速率与化学平衡(讲义)-【高频考点解密】(原卷版+解析),共46页。试卷主要包含了考查化学平衡常数及有关计算,考查图像等内容,欢迎下载使用。








