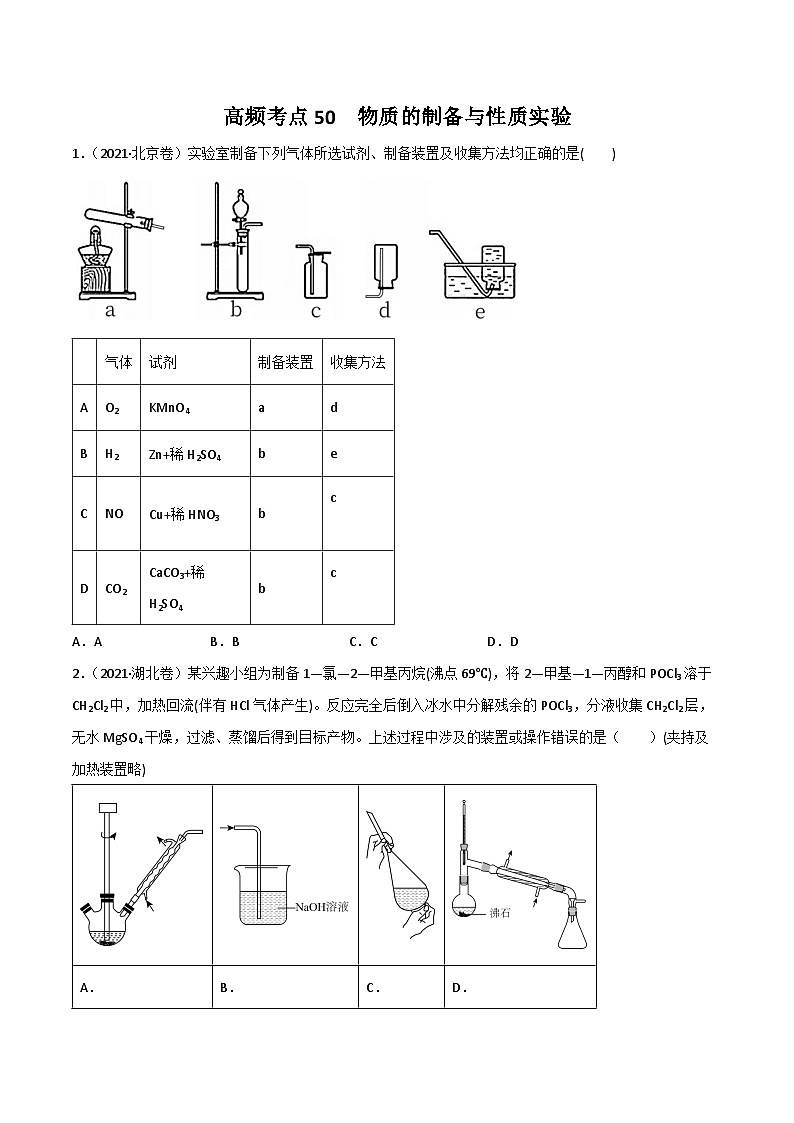


所属成套资源:新高考化学二轮复习高频考点练习(2份,原卷版+解析版)
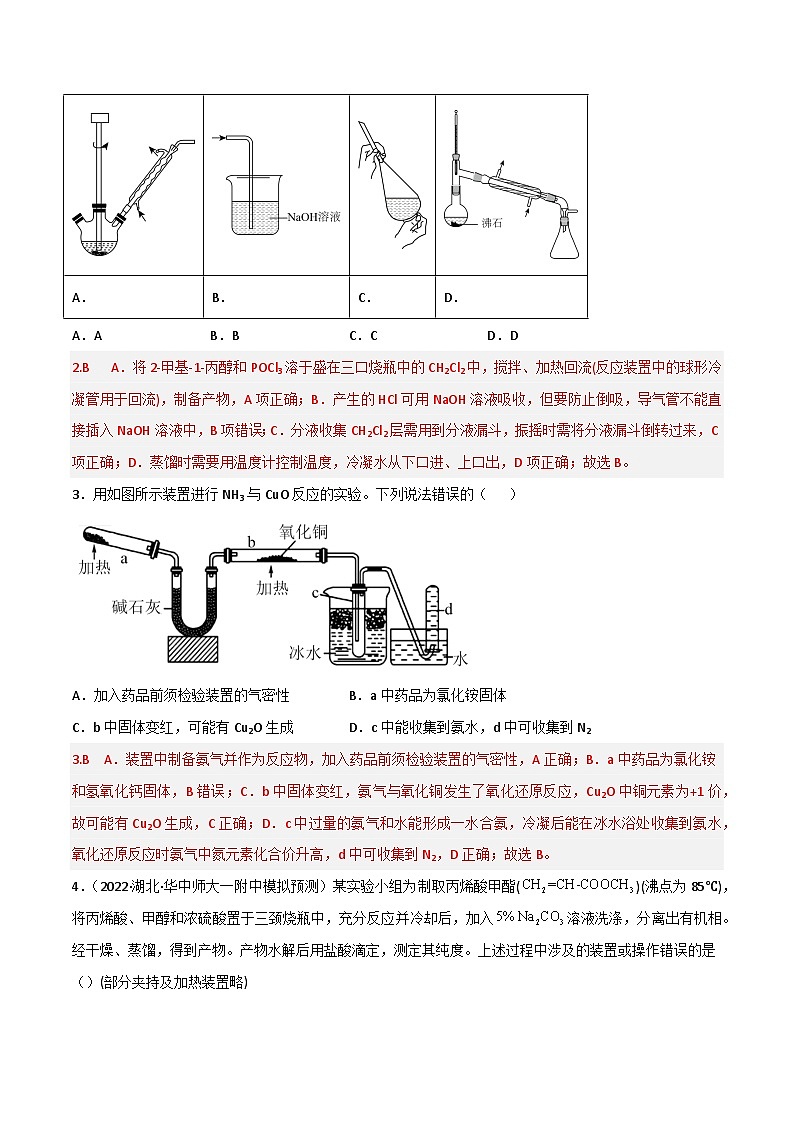
新高考化学二轮复习高频考点练习50 物质的制备与性质实验(解析版)
展开
这是一份新高考化学二轮复习高频考点练习50 物质的制备与性质实验(解析版),文件包含新高考化学二轮复习高频考点练习50物质的制备与性质实验原卷版docx、新高考化学二轮复习高频考点练习50物质的制备与性质实验解析版docx等2份试卷配套教学资源,其中试卷共23页, 欢迎下载使用。
A.AB.BC.CD.D
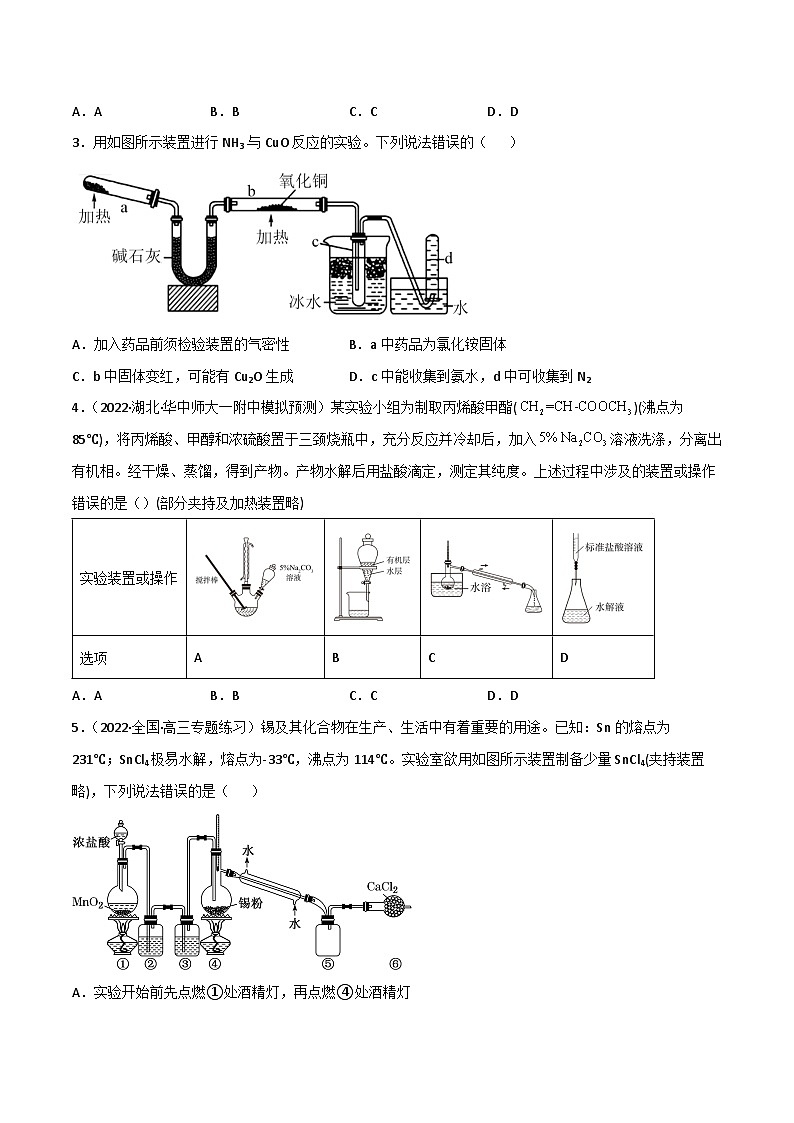
2.(2021·湖北卷)某兴趣小组为制备1—氯—2—甲基丙烷(沸点69℃),将2—甲基—1—丙醇和POCl3溶于CH2Cl2中,加热回流(伴有HCl气体产生)。反应完全后倒入冰水中分解残余的POCl3,分液收集CH2Cl2层,无水MgSO4干燥,过滤、蒸馏后得到目标产物。上述过程中涉及的装置或操作错误的是( )(夹持及加热装置略)
A.AB.BC.CD.D
3.用如图所示装置进行NH3与CuO反应的实验。下列说法错误的( )
A.加入药品前须检验装置的气密性B.a中药品为氯化铵固体
C.b中固体变红,可能有Cu2O生成D.c中能收集到氨水,d中可收集到N2
4.(2022·湖北·华中师大一附中模拟预测)某实验小组为制取丙烯酸甲酯()(沸点为85℃),将丙烯酸、甲醇和浓硫酸置于三颈烧瓶中,充分反应并冷却后,加入溶液洗涤,分离出有机相。经干燥、蒸馏,得到产物。产物水解后用盐酸滴定,测定其纯度。上述过程中涉及的装置或操作错误的是()(部分夹持及加热装置略)
A.AB.BC.CD.D
5.(2022·全国·高三专题练习)锡及其化合物在生产、生活中有着重要的用途。已知:Sn的熔点为231℃;SnCl4极易水解,熔点为-33℃,沸点为114℃。实验室欲用如图所示装置制备少量SnCl4(夹持装置略),下列说法错误的是( )
A.实验开始前先点燃①处酒精灯,再点燃④处酒精灯
B.装置③与装置⑥的作用不同
C.如果无装置③,装置④中除生成SnCl4外,还会生成SnO2
D.本实验会造成污染,应在装置⑥后添加氢氧化钠溶液装置
6.(2021·全国乙卷)氧化石墨烯具有稳定的网状结构,在能源、材料等领域有着重要的应用前景,通过氧化剥离石墨制备氧化石墨烯的一种方法如下(装置如图所示):
Ⅰ.将浓、、石墨粉末在c中混合,置于冰水浴中,剧烈搅拌下,分批缓慢加入粉末,塞好瓶口。
Ⅱ.转至油浴中,35℃搅拌1小时,缓慢滴加一定量的蒸馏水。升温至98℃并保持1小时。
Ⅲ.转移至大烧杯中,静置冷却至室温。加入大量蒸馏水,而后滴加至悬浊液由紫色变为土黄色。
Ⅳ.离心分离,稀盐酸洗涤沉淀。
Ⅴ.蒸馏水洗涤沉淀。
Ⅵ.冷冻干燥,得到土黄色的氧化石墨烯。
回答下列问题:
(1)装置图中,仪器a、c的名称分别是_______、_______,仪器b的进水口是_______(填字母)。
(2)步骤Ⅰ中,需分批缓慢加入粉末并使用冰水浴,原因是_______。
(3)步骤Ⅱ中的加热方式采用油浴,不使用热水浴,原因是_______。
(4)步骤Ⅲ中,的作用是_______(以离子方程式表示)。
(5)步骤Ⅳ中,洗涤是否完成,可通过检测洗出液中是否存在来判断。检测的方法是_______。
(6)步骤Ⅴ可用试纸检测来判断是否洗净,其理由是_______。
7.用铁屑为原料制备三草酸合铁(III)酸钾(K3[Fe(C2O4)3])的化学方程式依次如下:
①Fe(s)+H2SO4=FeSO4+H2↑
②FeSO4+H2C2O4+2H2O=FeC2O4·2H2O↓+H2SO4
③2FeC2O4·2H2O+H2O2+H2C2O4+3K2C2O4=2K3[Fe(C2O4)3]+6H2O
已知:K3[Fe(C2O4)3]·3H2O晶体的摩尔质量为491g·ml-1,易溶于水,难溶于乙醇;Fe(C2O4)33-Fe3++3。
回答下列问题:
(1)在反应①之前为了除去铁屑表面的油污,先用饱和Na2CO3溶液浸泡一段时间,通常采用_____分离获得铁屑。
(2)为从反应③后的溶液中得到K3[Fe(C2O4)3]·3H2O晶体,某同学设计的实验步骤为“加热蒸发→冷却结晶→抽滤→洗涤→干燥”,采用该方案会导致获得的产品纯度不高,其主要原因是_______。
(3)为获得较纯净的K3[Fe(C2O4)3]·3H2O晶体,适当调整该同学的设计,调整后的实验步骤是_______。
(4)抽滤获得K3[Fe(C2O4)3]·3H2O晶体通常采用如图装置,其仪器I的名称是_______。选出下列有关抽滤的正确操作并按序列出字母:组装装置→检查装置的气密性→________→停止抽滤,处理滤液和洗涤装置。
A.选择比仪器I内径略小又能将全部小孔盖住的滤纸
B.选择比仪器I内径稍大又能将全部小孔盖住的滤纸
C.放入滤纸后,用蒸馏水润湿滤纸,微开水龙头,通过抽气使滤纸紧贴漏斗瓷板上
D.放入滤纸后,直接转移溶液
E.将溶液转移至仪器I中,开大水龙头,待溶液快流尽时再转移晶体
F.洗涤晶体时,先关小水龙头,用蒸馏水缓慢淋洗
G.洗涤晶体时,先关小水龙头,用一定浓度的酒精水溶液缓慢淋洗
(5)称取5.00g制得的晶体加水溶解,配成250mL溶液,取25.00mL于锥形瓶中,用0.100ml·L-1酸性高锰酸钾标准溶液滴定,重复三次实验,平均消耗12.00mL酸性高锰酸钾标准溶液。计算所得的样品中K3[Fe(C2O4)3]·3H2O的纯度为_________。
8.二氯异氰尿酸钠为白色固体,难溶于冷水,是一种高效、安全的氧化性消毒剂。实验室用如图所示装置制备(夹持装置已略去)。回答下列问题:
已知:实验原理为
(1)仪器a中侧管的作用为___________,装置A中的药品可以选择___________。
A. B. C. D.
(2)装置B的作用是除去氯气中的HCl,用平衡原理解释30%硫酸的作用___________。
(3)当从装置C中观察到___________时,加入溶液。实验过程中C的温度必须保持在17~20℃,pH控制在6.5~8.5,则该实验的受热方式是___________,若温度过高,pH值过低,会生成写出生成的离子方程式:___________。
(4)二氯异氰尿酸钠缓慢水解可产生HClO消毒灭菌,通过下列实验检测二氯异氰尿酸钠样品的有效氯。准确称取mg样品,用容量瓶配成100mL溶液;取25.00mL上述溶液于碘量瓶中,加入适量稀硫酸和过量KI溶液,密封,在暗处静置5min;用标准溶液滴定至溶液呈微黄色,加入淀粉,继续滴定至终点,消耗溶液VmL。(、)已知:该样品的有效氯=。
①样品的有效氯测定值为___________%(用含m、V的代数式表示)。
②下列操作会导致样品的有效氯测定值偏高的是___________(填序号)。
A.盛装标准溶液的滴定管未润洗
B.滴定管在滴定前无气泡,滴定后有气泡
C.碘量瓶中加入的稀硫酸偏少
9.2019年12月中旬以来,新型冠状病毒肺炎(NCP)肆虐全球,酒精、84消毒液、双氧水、过氧乙酸等化学品是常用的消毒剂,能够杀死新型冠状病毒。
Ⅰ.如图是简易84消毒液发生器,写出该电解池中发生的总反应的化学方程式:________________。
Ⅱ.过氧化尿素是一种新型漂白剂、消毒剂,漂白、消毒的效果优于H2O2和过氧乙酸。
某工业用过氧化尿素的部分参数见下表:
合成过氧化尿素的流程及反应器的示意图如图:
回答下列问题:
(1)流程中操作①的名称为__,仪器X的名称是________________。
(2)流程中操作②的具体过程是________________。
A.盐析、过滤 B.减压蒸馏、结晶、过滤
C.分液、过滤 D.常压蒸馏、萃取
(3)搅拌器选用的材质是玻璃而不是铁质的原因是________________________________。
(4)为测定产品中活性氧的含量(含双氧水34%,则其中活性氧为16%),一般采用KMnO4标准溶液进行滴定,但由于KMnO4的强氧化性,其溶液很容易被空气或水中的少量还原性物质还原,生成难溶性物质MnO(OH)2,因此配制KMnO4标准溶液有如下步骤:
a.利用氧化还原滴定方法,在70~80℃条件下用基准试剂纯度高、相对分子质量较大、稳定性较好的物质)溶液标定其浓度。
b.过滤得到的KMnO4溶液贮存于棕色试剂瓶中并放在暗处。
c.称取稍多于所需量的KMnO4固体溶于水中,将溶液加热并保持微沸。
d.用微孔玻璃漏斗过滤除去难溶的MnO(OH)2。
①请按照正确的流程对上述步骤进行排序__(填字母)。
②在下列物质中,用于标定KMnO4溶液的基准试剂最好选用________。
A.H2C2O4·2H2O B.FeSO4 C.浓盐酸 D.Na2SO3
③若准确称取Wg你选的基准试剂溶于水配成500mL溶液,取25.00mL置于锥形瓶中,用KMnO4溶液滴定至终点,消耗KMnO4溶液VmL。称取干燥样品1.2g,溶解后置于锥形瓶中加入1mL6ml·L-1的硫酸,然后用上述KMnO4标准溶液滴定(KMnO4溶液与尿素不反应),平行实验三次,实验结果如下:
产品中活性氧的质量分数为_______________ (用含字母的最简等式表示)。
10.(2022·湖北·高三期中)乙酰苯胺( )具有退热镇痛作用,在OTC药物中占有重要地位。乙酰苯胺可通过苯胺( )和乙酸反应制得,该反应是放热的可逆反应,其制备流程如下:
已知:①苯胺在空气中易被氧化。
②可能用到的有关性质如下:
回答下列问题:
Ⅰ.乙酰苯胺的制备
(1)制备乙酰苯胺的化学方程式为_______。
(2)加入锌粉的原因是_______。
(3)“加热回流”的装置如图所示,a处使用的仪器为_______(填“A”“B”或“C”),该仪器的名称是_______。
(4)“加热回流”的反应温度应控制在_______(填标号)。
A.85-100℃ B.100-115℃ C.115-130℃
Ⅱ.乙酰苯胺的提纯
将上述制得的粗乙酰苯胺固体移入500mL烧杯中,加入100mL热水,加热至沸腾,待粗乙酰苯胺完全溶解后,再补加少量蒸馏水。稍冷后,加入少量活性炭吸附色素等杂质,在搅拌下微沸5min,趁热过滤。待滤液冷却至室温,有晶体析出,称量产品为10.0g。
(5)趁热过滤的目的是_______;这种提纯乙酰苯胺的方法叫_______。
(6)该实验中乙酰苯胺的产率是_______(保留三位有效数字)。
气体
试剂
制备装置
收集方法
A
O2
KMnO4
a
d
B
H2
Zn+稀H2SO4
b
e
C
NO
Cu+稀HNO3
b
c
D
CO2
CaCO3+稀H2SO4
b
c
A.
B.
C.
D.
实验装置或操作
选项
A
B
C
D
分子式
外观
热分解温度
熔点
水溶性(20℃)
CO(NH2)2·H2O2
白色晶体
45℃
75~85℃
500g·L-1
实验序号
1
2
3
KMnO4溶液体积(mL)
滴定前读数
0.00
0.00
1.00
滴定后读数
19.90
22.70
21.10
名称
相对分子质量
性状
密度
熔点/℃
沸点/℃
溶解度
g/100g水
g/100g乙醇
苯胺
93
棕黄色液体
1.02
-6.3
184
微溶
∞
冰醋酸
60
无色透明液体
1.05
16.6
117.9
∞
∞
乙酰苯胺
135
无色片状晶体
1.21
155~156
280~290
温度高,溶解度大
较水中大
相关试卷
这是一份新高考化学二轮复习高频考点50 物质的制备与性质实验(含解析),共14页。
这是一份新高考2024版高考化学一轮复习微专题小练习专练50物质的制备与性质实验,共6页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
这是一份统考版2024版高考化学一轮复习微专题小练习专练50物质的制备与性质实验,共5页。试卷主要包含了化学是以实验为基础的科学等内容,欢迎下载使用。








