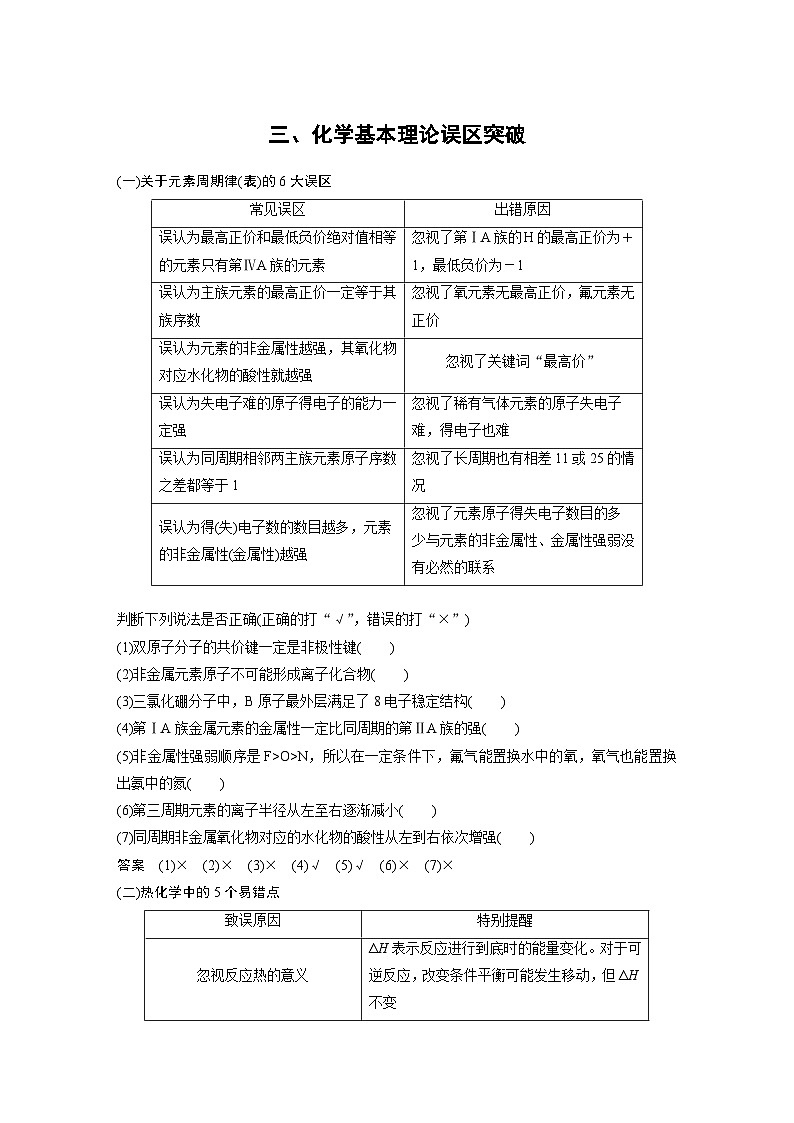

新高考化学二轮复习讲义 第2部分 回扣基础 规范答题 三、化学基本理论误区突破
展开判断下列说法是否正确(正确的打“√”,错误的打“×”)
(1)双原子分子的共价键一定是非极性键( )
(2)非金属元素原子不可能形成离子化合物( )
(3)三氯化硼分子中,B原子最外层满足了8电子稳定结构( )
(4)第ⅠA族金属元素的金属性一定比同周期的第ⅡA族的强( )
(5)非金属性强弱顺序是F>O>N,所以在一定条件下,氟气能置换水中的氧,氧气也能置换出氨中的氮( )
(6)第三周期元素的离子半径从左至右逐渐减小( )
(7)同周期非金属氧化物对应的水化物的酸性从左到右依次增强( )
答案 (1)× (2)× (3)× (4)√ (5)√ (6)× (7)×
(二)热化学中的5个易错点
判断下列说法是否正确(正确的打“√”,错误的打“×”)
(1)已知2C(s)+2O2(g)===2CO2(g) ΔH=a kJ·ml-1,2C(s)+O2(g)===2CO(g) ΔH=b kJ·ml-1,则a>b( )
(2)甲烷的标准燃烧热ΔH=-890 kJ·ml-1,则甲烷燃烧的热化学方程式为CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890 kJ·ml-1( )
(3)已知S(s)+O2(g)===SO2(g) ΔH1=-Q1 kJ·ml-1,S(g)+O2(g)===SO2(g) ΔH2=-Q2 kJ·ml-1,则Q1
(5)H2(g)+F2(g)===2HF(g) ΔH=-270 kJ·ml-1,则相同条件下,2 ml HF气体的总能量小于1 ml氢气和1 ml氟气的能量之和( )
(6)①2O2(g)+N2(g)===N2O4(l) ΔH1
②N2(g)+2H2(g)===N2H4(l) ΔH2
③O2(g)+2H2(g)===2H2O(g) ΔH3
④2N2H4(l)+N2O4(l)===3N2(g)+4H2O(g) ΔH4
ΔH4=2ΔH3-2ΔH2-ΔH1( )
(7)已知反应2HI(g)H2(g)+I2(g) ΔH=+11 kJ·ml-1,1 ml H2(g)、1 ml I2(g)分子中化学键断裂时分 别需要吸收436 kJ、151 kJ的能量,则1 ml HI(g)分子中化学键断裂时需吸收的能量为299 kJ( )
(8)已知NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=-57.3 kJ·ml-1,则含40.0 g NaOH的稀溶液与稀醋酸完全中和,放出的热量小于57.3 kJ( )
答案 (1)× (2)× (3)√ (4)× (5)√ (6)√ (7)√ (8)√
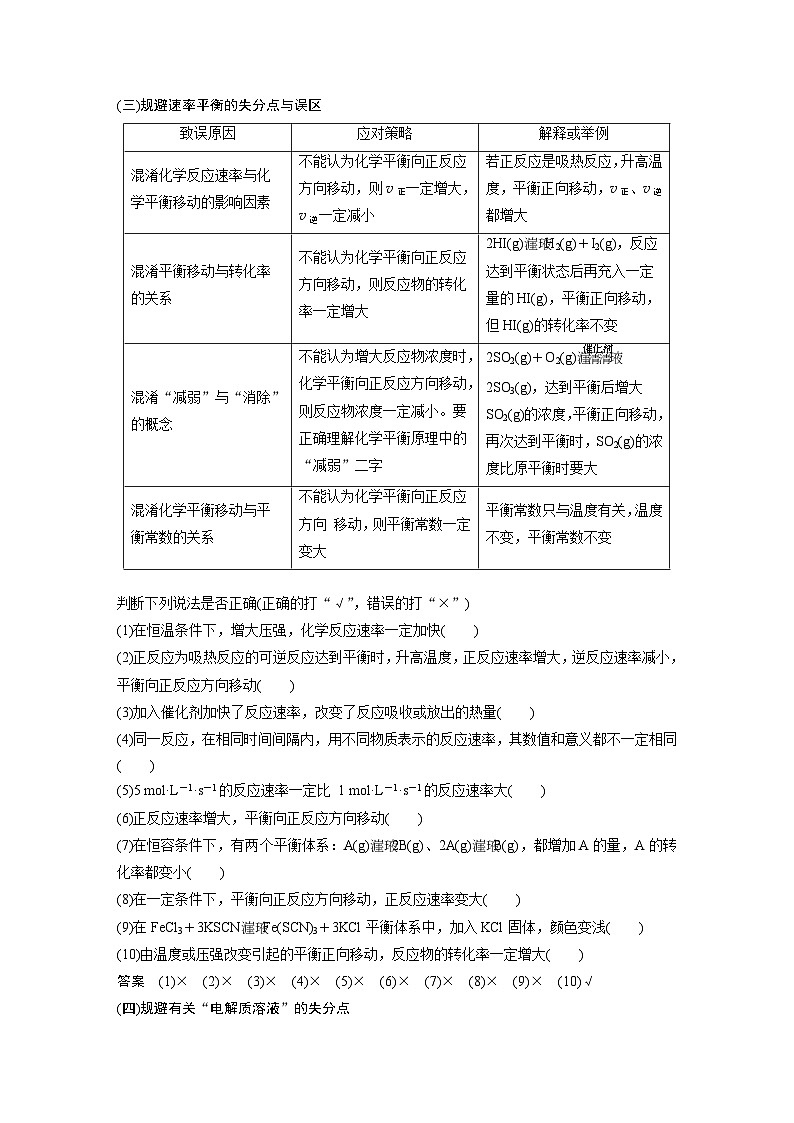
(三)规避速率平衡的失分点与误区
判断下列说法是否正确(正确的打“√”,错误的打“×”)
(1)在恒温条件下,增大压强,化学反应速率一定加快( )
(2)正反应为吸热反应的可逆反应达到平衡时,升高温度,正反应速率增大,逆反应速率减小,平衡向正反应方向移动( )
(3)加入催化剂加快了反应速率,改变了反应吸收或放出的热量( )
(4)同一反应,在相同时间间隔内,用不同物质表示的反应速率,其数值和意义都不一定相同( )
(5)5 ml·L-1·s-1的反应速率一定比 1 ml·L-1·s-1的反应速率大( )
(6)正反应速率增大,平衡向正反应方向移动( )
(7)在恒容条件下,有两个平衡体系:A(g)2B(g)、2A(g)B(g),都增加A的量,A的转化率都变小( )
(8)在一定条件下,平衡向正反应方向移动,正反应速率变大( )
(9)在FeCl3+3KSCNFe(SCN)3+3KCl平衡体系中,加入KCl固体,颜色变浅( )
(10)由温度或压强改变引起的平衡正向移动,反应物的转化率一定增大( )
答案 (1)× (2)× (3)× (4)× (5)× (6)× (7)× (8)× (9)× (10)√
(四)规避有关“电解质溶液”的失分点
1.弱电解质电离平衡移动的3个易失分点
(1)误认为电离平衡正向移动,弱电解质的电离程度一定增大。如向CH3COOH溶液中加入少量冰醋酸,平衡向电离方向移动,但CH3COOH的电离程度减小。
(2)误认为当对酸、碱溶液稀释时,溶液中所有离子的浓度都减小。如对于电离平衡CH3COOHCH3COO-+H+,当加水稀释时,由于Kw是定值,故c(H+)减小,c(OH-)增大;当对碱溶液稀释时,c(OH-)减小,c(H+)增大。
(3)误认为电离平衡右移,电离平衡常数一定增大。对于同一反应,电离平衡常数只与温度有关,只有因为温度升高而导致平衡右移时,电离平衡常数才会增大。
2.有关溶液酸碱性的4个易失分点
(1)误认为由水电离出的c(H+)=10-13 ml·L-1的溶液一定呈碱性。如25 ℃,0.1 ml·L-1的盐酸或氢氧化钠溶液中由水电离出的c(H+)都为10-13 ml·L-1。
(2)误认为溶液的酸碱性取决于pH。如pH=7的溶液在温度不同时,可能显酸性也可能显碱性,还可能显中性。
(3)误认为酸碱恰好中和时溶液一定显中性。如强酸和弱碱恰好中和时溶液显酸性,强碱和弱酸恰好中和时溶液显碱性,强酸和强碱恰好中和时溶液才显中性。
(4)不能正确理解酸、碱的无限稀释规律。常温下任何酸(碱)溶液无限稀释时,溶液的pH都不可能大于7(小于7),只能无限接近7。
3.盐类水解的5个易失分点
(1)误认为酸式盐一定呈酸性。如NaHSO4、NaHSO3、NaH2PO4溶液均呈酸性,但NaHCO3、NaHS溶液均呈碱性。
(2)误认为能够发生水解的盐溶液一定呈酸性或碱性,但其实是与弱离子的水解程度有关。如CH3COONH4为弱酸弱碱盐,发生水解,但溶液呈中性。
(3)误认为水解平衡正向移动,离子的水解程度一定增大。如向FeCl3溶液中加入少量FeCl3固体,平衡向水解方向移动,但Fe3+的水解程度减小。
(4)误认为弱酸强碱盐都因水解而显碱性。但NaHSO3因HSOeq \\al(-,3)的电离能力大于其水解能力,所以NaHSO3溶液显酸性。
(5)由于加热可促进盐类水解,错误地认为可水解的盐溶液在蒸干后都得不到原溶质。对于水解程度不是很大、水解产物不能脱离平衡体系的情况[如Al2(SO4)3、Na2CO3溶液]来说,溶液蒸干仍得原溶质。
4.沉淀溶解平衡的4个易失分点
(1)误认为沉淀溶解平衡右移,Ksp一定增大。Ksp与其他化学平衡常数一样,只与难溶电解质的性质和温度有关,而与沉淀的量和溶液中离子浓度的变化无关。
(2)误认为沉淀溶解平衡右移,溶解度一定变大。溶解度表示的是100 g溶剂中所能溶解溶质的质量,溶解度受温度和同离子效应的影响,若是加水使沉淀溶解平衡右移,溶解度不变。
(3)误认为只要Ksp越大,其溶解度就会越大。Ksp还与难溶电解质类型有关,只有同类型的难溶物的Ksp大小可用于比较其溶解度大小。
(4)误认为Ksp小的难溶电解质不能转化为Ksp大的难溶电解质,只能实现Ksp大的难溶电解质向Ksp小的难溶电解质转化。实际上当两种难溶电解质的Ksp相差不是很大时,通过调节某种离子的浓度,可实现由Ksp小的难溶电解质向Ksp大的难溶电解质转化。
5.判断下列说法是否正确(正确的打“√”,错误的打“×”)
(1)任何温度下,溶液中c(H+)和c(OH-)的相对大小都可判断溶液的酸、碱性( )
(2)某醋酸溶液的pH=a,将此溶液稀释到原体积的2倍后,溶液的pH=b,则a>b( )
(3)pH=4的醋酸加水稀释过程中,所有离子浓度都降低( )
(4)无论在酸溶液中还是在碱溶液中,由水电离出的c(H+)=c(OH-)( )
(5)某盐溶液呈酸性,一定是由水解引起的( )
(6)水解方程式都必须写“”( )
(7)沉淀转化只能是Ksp大的沉淀转化为Ksp小的沉淀( )
(8)中和等体积、等pH的盐酸和醋酸消耗的NaOH的物质的量相同( )
(9)用湿润的pH试纸测得某溶液的pH=3.4( )
(10)在NaHCO3溶液中加入NaOH,不会影响离子的种类( )
(11)在NaHSO4溶液中,c(H+)=c(OH-)+c(SOeq \\al(2-,4))( )
(12)0.1 ml·L-1氨水中加入CH3COONH4固体,eq \f(cOH-,cNH3·H2O)比值变大( )
(13)用标准NaOH溶液滴定未知浓度的CH3COOH到终点时,c(Na+)=c(CH3COO-)( )
(14)室温时,向等体积pH=a的盐酸和pH=b的CH3COOH中分别加入等量的氢氧化钠后,两溶液均呈中性,则a>b( )
(15)常温下,等体积的盐酸和CH3COOH的pH相同,由水电离出的c(H+)相同( )
(16)溶液均为0.1 ml·L-1的①CH3COOH、②NH4Cl、③H2SO4三种溶液中,由水电离出的c(H+):②>①>③( )
答案 (1)√ (2)× (3)× (4)√ (5)× (6)× (7)× (8)× (9)× (10)√ (11)√ (12)× (13)× (14)× (15)√ (16)√
(五)突破电化学中的易错点
判断下列说法是否正确(正确的打“√”,错误的打“×”)
(1)Cu+2H+===Cu2++H2↑既可在原电池中完成,也可在电解池中完成( )
(2)蓄电池充电时,标志着“-”的电极应与电源的负极相连( )
(3)电解质溶液导电时不可能发生化学反应( )
(4)在铜锌原电池(Zn|H2SO4|Cu)中,硫酸根离子向正极移动;在电解(惰性电极)硫酸溶液时,硫酸根离子向阳极移动( )
(5)用惰性电极电解MgCl2溶液时,阴极可能得到固体镁( )
(6)用惰性电极电解KOH溶液时,阴极的电极反应式:O2+2H2O+4e-===4OH-( )
(7)以Pt电极电解电解质溶液时,若两极只有H2和O2析出,则溶液的浓度一定改变( )
(8)粗铜(含碳)与稀硫酸接触发生电化学腐蚀时,正极的电极反应式:O2+4e-+4H+===2H2O( )
答案 (1)× (2)√ (3)× (4)× (5)× (6)× (7)× (8)√常见误区
出错原因
误认为最高正价和最低负价绝对值相等的元素只有第ⅣA族的元素
忽视了第ⅠA族的H的最高正价为+1,最低负价为-1
误认为主族元素的最高正价一定等于其族序数
忽视了氧元素无最高正价,氟元素无正价
误认为元素的非金属性越强,其氧化物对应水化物的酸性就越强
忽视了关键词“最高价”
误认为失电子难的原子得电子的能力一定强
忽视了稀有气体元素的原子失电子难,得电子也难
误认为同周期相邻两主族元素原子序数之差都等于1
忽视了长周期也有相差11或25的情况
误认为得(失)电子数的数目越多,元素的非金属性(金属性)越强
忽视了元素原子得失电子数目的多少与元素的非金属性、金属性强弱没有必然的联系
致误原因
特别提醒
忽视反应热的意义
ΔH表示反应进行到底时的能量变化。对于可逆反应,改变条件平衡可能发生移动,但ΔH不变
忽视反应热和平衡常数的计算的不同
A(g)+eq \f(1,2)B(g)C(g) ΔH1,平衡常数为K1;
C(g)+eq \f(1,2)B(g)D(g) ΔH2,平衡常数为K2。
则反应A(g)+B(g)D(g) ΔH=ΔH1+ΔH2,平衡常数K=K1·K2
忽视用键能或用能量计算反应热时公式的不同
ΔH=反应物总键能-生成物总键能
ΔH=生成物总能量-反应物总能量
忽视催化剂对活化能与反应热的影响不同
催化剂能改变正、逆反应的活化能,但不能改变反应的反应热
忽视反应热的符号
比较反应热的大小时,需带上正、负号进行比较
致误原因
应对策略
解释或举例
混淆化学反应速率与化学平衡移动的影响因素
不能认为化学平衡向正反应方向移动,则v正一定增大,v逆一定减小
若正反应是吸热反应,升高温度,平衡正向移动,v正、v逆都增大
混淆平衡移动与转化率的关系
不能认为化学平衡向正反应方向移动,则反应物的转化率一定增大
2HI(g)H2(g)+I2(g),反应达到平衡状态后再充入一定量的HI(g),平衡正向移动,但HI(g)的转化率不变
混淆“减弱”与“消除”的概念
不能认为增大反应物浓度时,化学平衡向正反应方向移动,则反应物浓度一定减小。要正确理解化学平衡原理中的“减弱”二字
2SO2(g)+O2(g)eq \(,\s\up7(催化剂))2SO3(g),达到平衡后增大SO2(g)的浓度,平衡正向移动,再次达到平衡时,SO2(g)的浓度比原平衡时要大
混淆化学平衡移动与平衡常数的关系
不能认为化学平衡向正反应方向 移动,则平衡常数一定变大
平衡常数只与温度有关,温度不变,平衡常数不变
致误原因
应对策略
解释或举例
混淆电解池和原电池原理
根据电化学反应原理,充电时为电解池,放电时为原电池;与电源连接的为电解池,提供电流的为原电池
电池的总反应为
Li1-xMnO2+LixC6eq \(,\s\up7(放电),\s\d5(充电))LiMnO2+C6,放电时负极反应式为LixC6-xe-===C6+xLi+,充电时阳极反应式为LiMnO2-xe-===Li1-xMnO2+xLi+
电解时忽视惰性电极和非惰性电极的区别
惰性电极为石墨、Pt、Au等,Cu、Fe等金属都是非惰性电极
惰性电极与电源正极相连接,电极不参与反应,非惰性电极与电源正极相连接,发生氧化反应
不清楚电池正、负极所带电荷情况,错误判断离子迁移方向
原电池中,负极附近溶液带正电,阴离子向负极迁移,正极附近溶液带负电,阳离子向正极迁移;电解池中阴离子向阳极移动,阳离子向阴极移动
在Cu、Zn、H2SO4形成的原电池中,SOeq \\al(2-,4)向Zn(负极)迁移,H+向Cu(正极)迁移;电解NaCl溶液时,Na+、H+向阴极移动,Cl-、OH-向阳极移动
不理解电解反应,错误判断加入复原物质
需根据电解反应方程式判断
电解CuSO4溶液,2CuSO4+2H2Oeq \(=====,\s\up7(电解))2Cu+2H2SO4+O2↑,对于此反应,每生成
1 ml O2,析出2 ml Cu,加入2 ml CuO或2 ml CuCO3,溶液可复原,加入
2 ml Cu(OH)2则多了2 ml H2O
新高考化学二轮复习讲义 第2部分 回扣基础 规范答题 七、教材实验装置再现: 这是一份新高考化学二轮复习讲义 第2部分 回扣基础 规范答题 七、教材实验装置再现,共5页。试卷主要包含了主要仪器,注意事项,误差分析依据,命题角度,操作步骤等内容,欢迎下载使用。
高考化学二轮复习(新高考版) 第2部分 回扣基础 规范答题 一、化学与社会、生活、环境(含解析): 这是一份高考化学二轮复习(新高考版) 第2部分 回扣基础 规范答题 一、化学与社会、生活、环境(含解析),共3页。试卷主要包含了化学与社会等内容,欢迎下载使用。
高考化学二轮复习(新高考版) 第2部分 回扣基础 规范答题 五、重要的化工生产(含解析): 这是一份高考化学二轮复习(新高考版) 第2部分 回扣基础 规范答题 五、重要的化工生产(含解析),共3页。试卷主要包含了海水晒盐及粗盐等离子)提纯,氯碱工业,侯氏制碱法,电解熔融的氯化钠制钠,提取溴,海水制镁等内容,欢迎下载使用。












