
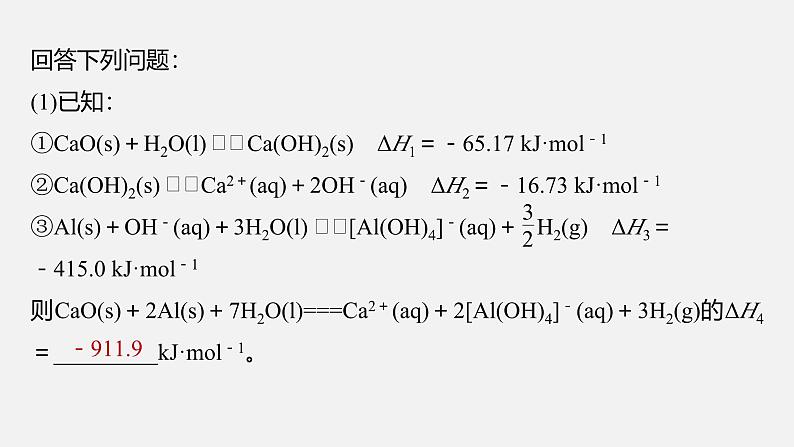





新高考化学二轮复习课件 第1部分 专题突破 大题突破1 化学反应原理综合题题型研究
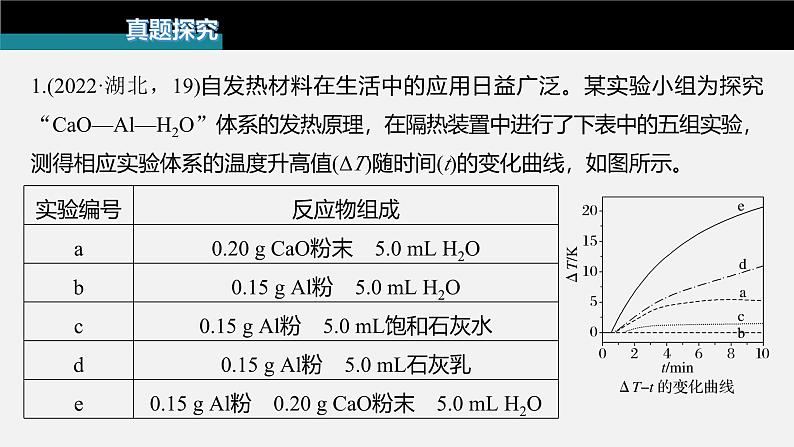
展开1.(2022·湖北,19)自发热材料在生活中的应用日益广泛。某实验小组为探究“CaO—Al—H2O”体系的发热原理,在隔热装置中进行了下表中的五组实验,测得相应实验体系的温度升高值(ΔT)随时间(t)的变化曲线,如图所示。
回答下列问题:(1)已知:①CaO(s)+H2O(l) Ca(OH)2(s) ΔH1=-65.17 kJ·ml-1②Ca(OH)2(s) Ca2+(aq)+2OH-(aq) ΔH2=-16.73 kJ·ml-1③Al(s)+OH-(aq)+3H2O(l) [Al(OH)4]-(aq)+ H2(g) ΔH3=-415.0 kJ·ml-1则CaO(s)+2Al(s)+7H2O(l)===Ca2+(aq)+2[Al(OH)4]-(aq)+3H2(g)的ΔH4=_________kJ·ml-1。
根据盖斯定律,①+②+2×③可得反应CaO(s)+2Al(s)+7H2O(l)===Ca2+(aq)+2[Al(OH)4]-(aq)+3H2(g),则ΔH4=ΔH1+ΔH2+2ΔH3=(-65.17 kJ·ml-1)+(-16.73 kJ·ml-1)+2×(-415.0 kJ·ml-1)=-911.9 kJ·ml-1。
(2)温度为T时,Ksp[Ca(OH)2]=x,则Ca(OH)2饱和溶液中c(OH-)=_____________(用含x的代数式表示)。
温度为T时,Ca(OH)2饱和溶液中,Ca(OH)2(s) Ca2+(aq)+2OH-(aq), c(OH-)=2c(Ca2+),Ksp[Ca(OH)2]=c(Ca2+)·c2(OH-)=x,则c(OH-)= 。
(3)实验a中,4 min后ΔT基本不变,原因是________________________________________________。(4)实验b中,ΔT的变化说明Al粉与H2O在该条件下_______(填“反应”或“不反应”)。实验c中,前3 min的ΔT有变化,其原因是_____________________________;3 min后ΔT基本不变,其原因是_____微粒的量有限。
Ca(OH)2在水中的溶解度小,
实验b中,ΔT几乎不变,说明Al粉与H2O在该条件下不反应;实验c中,前3 min的ΔT有变化,是因为Al和溶液中的OH-发生了反应,3 min后ΔT基本不变,是因为饱和石灰水中OH-的浓度较低,OH-的量有限。
(5)下列说法不能解释实验d在10 min内温度持续升高的是____(填标号)。A.反应②的发生促使反应①平衡右移B.反应③的发生促使反应②平衡右移C.气体的逸出促使反应③向右进行D.温度升高导致反应速率加快
实验d中,发生反应②和③,反应③中有气体生成,气体的逸出促使反应③向右进行,反应③的发生使得溶液中OH-的浓度减小,促使反应②平衡右移,这两步反应都是放热反应,温度升高导致反应速率加快;综上所述,实验d在10 min内温度持续升高与反应①无关,故选A。
(6)归纳以上实验结果,根据实验e的特征,用文字简述其发热原理_________________________________________________________________________________________________________________________________________________________________________________________________________________________________________。
中,发生反应①、②和③,反应③中有气体生成,气体的逸出促使反应③向右进行,反应③的发生使得溶液中OH-的浓度减小,促使反应②平衡右移,反应②的发生促使反应①平衡右移,这三步反应都是放热反应,温度升高导致反应速率加快,温度持续升高
2.(2022·海南,16)某空间站的生命保障系统功能之一是实现氧循环,其中涉及反应:CO2(g)+4H2(g) 2H2O(g)+CH4(g)回答问题:(1)已知:电解液态水制备1 ml O2(g),电解反应的ΔH=+572 kJ·ml-1。由此计算H2(g)的燃烧热(焓)ΔH=________ kJ·ml-1。
电解液态水制备1 ml O2(g),电解反应的ΔH=+572 kJ·ml-1,由此可以判断,2 ml H2(g)完全燃烧消耗1 ml O2(g),生成液态水的同时放出的热量为572 kJ,故1 ml H2(g)完全燃烧生成液态水放出的热量为286 kJ,因此,H2(g)的燃烧热(焓)ΔH=-286 kJ·ml-1。
(2)已知:CO2(g)+4H2(g) 2H2O(g)+CH4(g)的平衡常数(K)与反应温度(t)之间的关系如图1所示。①若反应为基元反应,且反应的ΔH与活化能(Ea)的关系为|ΔH|>Ea补充完成该反应过程的能量变化示意图(图2)。
由CO2(g)+4H2(g) 2H2O(g)+CH4(g)的平衡常数(K)与反应温度(t)之间的关系图可知,K随着温度升高而减小,故该反应为放热反应。若反应为基元反应,则反应为一步完成,由于反应的ΔH与活化能(Ea)的关系为|ΔH|>Ea,由图2信息可知Ea=a kJ·ml-1,则|ΔH|>a kJ·ml-1,该反应为放热反应,生成物的总能量小于反应物的,因此该反应过程的能量变化示意图为 。
②某研究小组模拟该反应,温度t下,向容积为10 L的抽空的密闭容器中通入0.1 ml CO2和0.4 ml H2,反应平衡后测得容器中n(CH4)=0.05 ml。则CO2的转化率为______,反应温度t约为_______________________________________ ℃。
660.2(或660.1或660.3,其他答
温度t下,向容积为10 L的抽空的密闭容器中通入0.1 ml CO2和0.4 ml H2,反应平衡后测得容器中n(CH4)=0.05 ml,则CO2的转化率为 ×100%=50%,根据C元素守恒可知,CO2的平衡量为0.05 ml,H2的平衡量为0.2 ml,H2O(g)的平衡量是CH4(g)的2倍,
则n(H2O)=0.1 ml,CO2(g)、H2(g)、H2O(g)、CH4(g)的平衡浓度分别为0.005 ml·L-1、0.02 ml·L-1、0.01 ml·L-1、0.005 ml·L-1,
则该反应的平衡常数K= =625,根据图1中的信息可知,反应温度t约为660.2 ℃。
(3)在相同条件下,CO2(g)与H2(g)还会发生不利于氧循环的副反应:CO2(g)+3H2(g) H2O(g)+CH3OH(g),在反应器中按n(CO2)∶n(H2)=1∶4通入反应物,在不同温度、不同催化剂条件下,反应进行到2 min时,测得反应器中CH3OH、CH4浓度(μml·L-1)如下表所示。
在选择使用催化剂Ⅰ和350 ℃条件下反应,0~2 min生成CH3OH的平均反应速率为______μml·L-1·min-1;若某空间站的生命保障系统实际选择使用催化剂Ⅱ和400 ℃的反应条件,原因是___________________________________________________________________。
应速率更快,相同温度,催化剂Ⅱ副产物浓度低
相同催化剂,400 ℃的反
在选择使用催化剂Ⅰ和350 ℃条件下反应,由表中信息可知,0~2 min CH3OH的浓度由0增加到10.8 μml·L-1,因此,0~2 min生成CH3OH的平均反应速率为 =5.4 μml·L-1·min-1;由表中信息可知,相同催化剂,400 ℃的反应速率更快,相同温度,催化剂Ⅱ副产物浓度低。
化学反应原理主要考查热化学、电化学、化学反应速率和化学平衡等主干理论知识,主要命题点有盖斯定律的应用、反应速率和化学平衡的分析、化学平衡常数的表达式书写与计算、反应条件的分析选择、生产生活中的实际应用等,试题常以填空、读图、作图、计算等形式呈现。试题一般以与生产、生活紧密联系的物质为背景材料命制组合题,各小题之间又有一定的独立性。主要考查学生的信息处理能力、学科内综合分析能力,应用反应原理解决生产实际中的具体问题,体现了“变化观念与平衡思想”的核心素养。在近几年的相关考题中,对单一因素影响的考查已经越来越少了,主要以“多因素影响”出现,考查考生的综合分析判断能力。以实际情景(场景)为背景,更能体现核心素养的要求。而在实际生产过程中,影响因素是多元化、多方位和多层次的。
(2022·安徽模拟)处理、回收利用CO是环境科学研究的热点课题。回答下列问题:(1)CO用于处理大气污染物N2O的反应为CO(g)+N2O(g) CO2(g)+N2(g)。在Zn+作用下该反应的具体过程如图1所示,反应过程中能量变化情况如图2所示。
总反应:CO(g)+N2O(g) CO2(g)+N2(g) ΔH=________ kJ·ml-1;该总反应的决速步是反应____(填“①”或“②”),该判断的理由是__________________________________________________________________________________。
反应①的活化能是149.6 kJ·ml-1,反应②的活化能是108.22 kJ·ml-1,反应②的活化能更小
由图2可知,总反应为CO(g)+N2O(g) CO2(g)+N2(g) ΔH=-361.22 kJ·ml-1;反应的决速步的活化能大,反应①的活化能是149.6 kJ·ml-1,反应②的活化能是108.22 kJ·ml-1,反应②的活化能小,故反应①是总反应的决速步。
(2)已知:CO(g)+N2O(g) CO2(g)+N2(g)的速率方程为v=k·c(N2O),k为速率常数,只与温度有关。为提高反应速率,可采取的措施是______(填字母)。A.升温B.恒容时,再充入COC.恒压时,再充入N2OD.恒压时,再充入N2
由速率方程可知,此反应的速率与温度和c(N2O)有关,升温,k增大,速率加快,A正确;恒容时,再充入CO,c(N2O)不变,速率不变,B错误;恒压时,再充入N2O,c(N2O)增大,速率增大,C正确;恒压时,再充入N2,c(N2O)减小,速率减慢,D错误。
(3)在总压为100 kPa的恒容密闭容器中,充入一定量的CO(g)和N2O(g)发生上述反应,在不同条件下达到平衡时,在T1 K时N2O的转化率与 、在 =1时N2O的转化率与 的变化曲线如图3所示:
①表示T1 K时N2O的转化率随 的变化曲线为________(填“Ⅰ”或“Ⅱ”)曲线。
②T1_____(填“>”或“<”)T2。
③已知:该反应的标准平衡常数Kθ= ,其中pθ为标准压强(100 kPa),p(CO2)、p(N2)、p(N2O)和p(CO)为各组分的平衡分压,则T4 K时,该反应的标准平衡常数Kθ=_____(结果保留两位有效数字,p分=p总×物质的量分数)。
(4)间接电解法除N2O。其工作原理如图4所示,已知:H2S2O4是一种弱酸。从A口中出来的气体是______(填化学式),电解池的阴极电极反应式为___________________________________,用化学方程式表示吸收池中除去N2O的原理:_________________________________。
2H2SO3+2e-+2H+===H2S2O4+2H2O
H2O+H2S2O4+N2O===N2+2H2SO3
由图可知,电解池的阳极电极反应式为2H2O-4e-===4H++O2↑,故从A口中出来的气体是O2,电解池的阴极电极反应式为2H2SO3+2e-+2H+===H2S2O4+2H2O;由装置图可知吸收池中除去N2O的原理是H2O+H2S2O4+N2O===N2+2H2SO3。
1.(2022·吉林延边一模)碳排放问题是第26届联合国气候变化大会讨论的焦点。我国向国际社会承诺2030年实现“碳达峰”,2060年实现“碳中和”。为了实现这个目标,加强了对CO2转化的研究。下面是CO2转化为高附加值化学品的反应。相关反应的热化学方程式如下:反应Ⅰ:CO2(g)+H2(g) H2O(g)+CO(g) ΔH1反应Ⅱ:CO(g)+2H2(g) CH3OH(g) ΔH2=-90.0 kJ·ml-1反应Ⅲ:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH3=-49.0 kJ·ml-1反应Ⅳ:CO2(g)+4H2(g) CH4(g)+2H2O(g) ΔH4=-165.0 kJ·ml-1反应Ⅴ:2CO2(g)+6H2(g) C2H4(g)+4H2O(g) ΔH5=-122.7 kJ·ml-1
回答下列问题:(1)反应Ⅲ一般认为通过反应Ⅰ、Ⅱ来实现,则反应Ⅰ的ΔH1=______ kJ·ml-1;已知:由实验测得反应Ⅰ的v正=k正·c(CO2)·c(H2),v逆=k逆·c(H2O)·c(CO)(k正、k逆为速率常数,与温度、催化剂有关)。若平衡后升高温度,则 ________(填“增大”“不变”或“减小”)。
(2)CO2在一定条件下催化加氢生成CH3OH,主要发生三个竞争反应(即反应Ⅲ、Ⅳ、Ⅴ),为分析催化剂对反应的选择性,在1 L恒容密闭容器中充入2.0 ml CO2和5.3 ml H2,测得反应进行相同时间后,有关物质的物质的量随温度变化如图所示:
①该催化剂在较低温度时主要选择反应_____(填“Ⅲ”“Ⅳ”或“Ⅴ”)。研究发现,若温度过高,三种含碳产物的物质的量会迅速降低,其主要原因可能是____________________________。
由图知,在较低温度时主要生成甲烷,该催化剂在较低温度时主要选择反应Ⅳ。研究发现,若温度过高,三种含碳产物的物质的量会迅速降低,其主要原因可能是温度升高,催化剂活性降低。
②在一定温度下达到平衡,此时测得容器中部分物质的含量为n(CH4)=0.1 ml,n(C2H4)=0.4 ml,n(CH3OH)=0.5 ml。则该温度下反应Ⅲ的平衡常数K(Ⅲ)=______(结果保留两位小数)。
CO2(g)+3H2(g) CH3OH(g)+H2O(g)转化/ml 0.5 1.5 0.5 0.5 CO2(g)+4H2(g) CH4(g)+2H2O(g)转化/ml 0.1 0.4 0.1 0.2 2CO2(g)+6H2(g) C2H4(g)+4H2O(g)转化/ml 0.8 2.4 0.4 1.6
(3)研究人员研究出一种方法,可实现水泥生产时CO2零排放,其基本原理如图所示。温度小于900 ℃时进行电解反应,碳酸钙先分解为CaO和CO2,电解质为熔融碳酸钠,阳极的电极反应式为 -4e-===2CO2↑+O2↑,则阴极的电极反应式为_______________________。
温度小于900 ℃时进行电解反应,碳酸钙先分解为CaO和CO2,电解质为熔融碳酸钠,熔融碳酸钠中的碳酸根离子移向阳极,阳极的电极反应式为 -4e-===2CO2↑+O2↑,阴极得电子发生还原反应生成碳,
则阴极的电极反应式为3CO2+4e-===C+ 。
2.(2022·重庆模拟)碳达峰是指我国承诺2030年前,二氧化碳的排放不再增长。因此,诸多科学家都在大力研究利用CO2和CO以减少碳的排放。(1)“神十三”中航天员们呼吸产生的CO2用一种循环方案处理,即CO2(g)+2H2(g) C(s)+2H2O(g) ΔH,然后电解水又得氢气和氧气。在温度为T时,向一恒容密闭容器中,按物质的量之比为2∶1通入H2和CO2,测得反应过程中压强(p)随时间(t)的变化如图中a所示。若其他条件不变,仅改变某一条件时,测得其压强(p)随时间(t)的变化如图中b所示。
①能说明容器中的反应已达到平衡状态的是______(填字母)。A.容器内气体的平均相对分子质量不变B.CO2和H2的转化率相等C.H2(g)与C(s)的物质的量之比保持不变D.v(H2)=v(H2O)
容器内气体的质量和物质的量均是变化的量,气体的平均相对分子质量不变,说明反应已达到平衡状态,A符合题意;CO2和H2的投料比等于化学计量数之比,故两
者的转化率相等,不能说明反应达到平衡状态,B不符合题意;H2(g)与C(s)的物质的量之比随着反应的进行不断变化,当该比例保持不变时,说明反应已达到平衡状态,C符合题意;v(H2)=v(H2O)时,由于未指明两个速率的反应方向,故不能说明反应达到平衡状态,D不符合题意。
②ΔH_____(填“>”“<”或“不确定”)0;理由是______________________________________________________________________________。
先变大后变小,说明反应为放热反应,使得开始的温度升高,压强增大
由图可知,随着反应进行,压强先变大后变小,5 min时达到平衡状态,说明反应为放热反应,使得开始的温度升高,压强变大,故ΔH<0。
③改变的条件是______________。
改变的条件使化学反应速率加快,而平衡没有移动,说明加入了催化剂。
(2)CO2经催化加氢可以生成低碳有机物,主要有以下反应:反应Ⅰ:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.6 kJ·ml-1反应Ⅱ:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g) ΔH=-122.6 kJ·ml-1①反应Ⅱ的活化能Ea(正)____(填“>”“<”或“=”)Ea(逆)。
反应Ⅱ为放热反应,生成物的能量低于反应物的能量,则反应Ⅱ的活化能Ea(正)<Ea(逆)。
②在T1温度下,将3 ml CO2和7 ml H2充入2 L的恒容密闭容器中发生反应Ⅰ和Ⅱ,达到平衡状态时CH3OH(g)和CH3OCH3(g)的物质的量分别为1 ml和0.5 ml。则T1温度时反应Ⅰ的平衡常数K=_____。
由题可得: CO2(g)+3H2(g) CH3OH(g)+H2O(g)转化/ml 1 3 1 1 2CO2(g)+6H2(g) CH3OH3(g)+3H2O(g)转化/ml 1 3 0.5 1.5
在T1温度下,2 L的恒容密闭容器中平衡时CO2、H2、CH3OH、H2O的物质的量分别为3 ml-1 ml-1 ml=1 ml、7 ml-3 ml-3 ml=1 ml、1 ml、1 ml+1.5 ml=2.5 ml;
(3)工业上利用废气中的CO2、CO联合制取烧碱、氯代烃和甲醇的流程如图。已知B中的装置使用了阳离子交换膜。
①B中发生的总反应的离子方程式为______________________________________。
由图可知,B中发生的总反应为电解氯化钠溶液的反应,离子方程式为2H2O+2Cl- H2↑+2OH-+Cl2↑。
②若某废气中含有的CO2和CO的体积比为1∶1,废气中CO2和CO的体积分数共为8.96%。假设A中处理了标准状况下10 m3的废气,其中CO2和CO全部转化成CH3OH,理论上可制得C2H4Cl2______ kg。
10 m3的废气中CO2和CO总体积为10×103 L×8.96%=896 L,CO2和CO的体积均为448 L,两者的物质的量均为20 ml,CO2和CO全部转化成CH3OH,CO2~6e-、CO~4e-,则转移电子的总物质的量为200 ml;C2H4生成C2H4Cl2,C2H4~2e-,则根据电子转移守恒可知,生成C2H4Cl2的物质的量为100 ml,质量为100 ml×99 g·ml-1=9 900 g=9.9 kg。
3.(2022·安徽马鞍山二中模拟)研究含氮元素物质的反应对生产、生活、科研等方面具有重要的意义。(1)发射“神舟十三”号的火箭推进剂为液态四氧化二氮和液态偏二甲肼(C2H8N2)。已知:①C2H8N2(l)+4O2(g)===2CO2(g)+N2(g)+4H2O(l) ΔH1=-2 765.0 kJ·ml-1②2O2(g)+N2(g)===N2O4(l) ΔH2=-19.5 kJ·ml-1③H2O(g)===H2O(l) ΔH3=-44.0 kJ·ml-1则C2H8N2(l)+2N2O4(l)===3N2(g)+2CO2(g)+4H2O(g)的ΔH为_______________。
-2 550.0 kJ·ml-1
由盖斯定律可知,①-2×②-4×③得反应:C2H8N2(l)+2N2O4(l)===3N2(g)+2CO2(g)+4H2O(g) ΔH=ΔH1-2ΔH2-4ΔH3=-2 550.0 kJ·ml-1。
(2)碘蒸气存在能大幅度提高N2O的分解速率,反应历程为第一步:I2(g)―→2I(g)(快反应)第二步:I(g)+N2O(g)―→N2(g)+IO(g)(慢反应)第三步:IO(g)+N2O(g)―→N2(g)+O2(g)+I(g)(快反应)实验表明,含碘时N2O分解速率方程v=k·c(N2O)·[c(I2)]0.5(k为速率常数)。下列表述正确的是_____(填字母)。A.N2O分解反应中,k值与碘蒸气浓度大小有关B.v(第二步的逆反应)<v(第三步反应)C.IO为反应的催化剂D.第二步活化能比第三步大
k为速率常数,受温度、催化剂、固体表面积性质等影响,不受浓度影响,A错误;平衡时v正=v逆,第二步反应为慢反应,反应速率较慢,则v(第二步的逆反应)也较慢,第三步反应为快反应,反应速率较快,故v(第二步的逆反应)<v(第三步反应),B正确;IO为中间过程产物,不是反应的催化剂,C错误;活化能越大反应越慢,第二步反应为慢反应,第三步反应为快反应,故第二步活化能比第三步大,D正确。
(3)为避免汽车尾气中的氮氧化合物对大气的污染,需给汽车安装尾气净化装置。在净化装置中CO和NO发生反应:2NO(g)+2CO(g)===N2(g)+2CO2(g) ΔH=-746.8 kJ·ml-1。实验测得:v正=k正·p2(NO)·p2(CO),v逆=k逆·p(N2)·p2(CO2)。其中k正、k逆分别为正、逆反应速率常数,只与温度有关;p为气体分压(分压=物质的量分数×总压)。①达到平衡后,仅升高温度,k正增大的倍数_______(填“大于”“小于”或“等于”)k逆增大的倍数。
②一定温度下在刚性密闭容器中充入CO、NO和N2的物质的量之比为2∶2∶1,压强为p0。达平衡时压强为0.9p0,则 =______。
一定温度下在刚性密闭容器中充入CO、NO和N2的物质的量之比为2∶2∶1,设初始CO、NO和N2的物质的量分别为2 ml、2 ml、1 ml,生成N2的物质的量为x ml, 2NO(g)+2CO(g) N2(g)+2CO2(g)起始/ml 2 2 1 0转化/ml 2x 2x x 2x平衡/ml 2-2x 2-2x 1+x 2x
则反应后总物质的量为(5-x) ml,初始压强为p0,达平衡时压强为0.9p0,
(4)我国科技人员计算了在一定温度范围内下列反应的平衡常数Kp:ⅰ.3N2H4(l)===4NH3(g)+N2(g) ΔH1 Kp1ⅱ.4NH3(g)===2N2(g)+6H2(g) ΔH2 Kp2绘制pKp1-T和pKp2-T的线性关系如图所示(已知:pKp=-lg Kp):①由图可知,ΔH1_____(填“>”或“<”)0。
由图可知,Kp1随着温度的升高而减小,则平衡逆向移动,正反应为放热反应,ΔH1<0。
②反应3N2H4(l)===3N2(g)+6H2(g)的K=________(用Kp1、Kp2表示);该反应的ΔH______(填“>”或“<”)0,写出推理过程:_____________________________________________________________________________________________________________________________________________________________________________________________________________________。
设T2>T1,由图可知:
pKp1(T2)-pKp1(T1)>∣pKp2(T2)-pKp2(T1)∣,则pKp1(T2)-pKp1(T1)>pKp2(T1)-pKp2(T2),pKp1(T2)+pKp2(T2)>pKp1(T1)+pKp2(T1),lg[Kp1(T1)·Kp2(T1)]>lg[Kp1(T2)·Kp2(T2)],即K(T1)>K(T2),因此该反应正反应为放热反应
由盖斯定律可知,ⅰ+ⅱ得反应3N2H4(l)===3N2(g)+6H2(g),则该反应的K=Kp1·Kp2。
4.(2022·青岛一模)丁二烯是生产合成橡胶的主要原料。一定条件下,2,3-二甲基-1,3-丁二烯( )与溴单质发生液相加成反应(1,2-加成和1,4-加成),已知溶剂极性越大越容易发生1,4-加成。现体系中同时存在如下反应:①②③
(1)由反应历程及能量变化图示判断,m_____(填“>”“=”或“<”)n,ΔH3=_____________________(用含不同活化能Ea的式子表示)。
-(Ea4+Ea2-Ea1-Ea3)
由反应历程及能量变化图示可知,反应物总能量高于生成物总能量,则 转化为 是放热反应,反应②-①得到 ,根据盖斯定律,ΔH3=(n-m) kJ·ml-1<0,则m>n; 转化为的ΔHⅰ=Ea1-Ea2, 转化为 的ΔHⅱ=Ea3-Ea4,ΔH3=ΔHⅱ+ΔHⅰ=Ea3-Ea4+(Ea1-Ea2)=-(Ea4+Ea2-Ea1-Ea3)。
(2)其他条件不变的情况下,升高反应温度,对反应____(填“①”或“②”)的速率提高更有利,分析原因:_____________________________________________________________________________________________________________________________________。
升高相同的温度,活化能越大,速率常数k增大的越多,Ea2<Ea3,故升高温度,对1,4-加成产物的生成速率提高更有利
由题中阿伦尼乌斯公式可知,
由题中阿伦尼乌斯公式可知,升高相同的温度,活化能越大,速率常数k增大的越多,Ea2<Ea3,故其他条件不变的情况下,升高反应温度,对反应②的速率提高更有利。
(3)由反应历程及能量变化图示判断,产物中________________________(用系统命名法命名)含量更大,若要提高该产物在平衡体系中的物质的量分数,还可采取的措施是__________________________。
2,3-二甲基-1,4-二溴-2-丁烯
在极性大的溶剂中进行反应
由图可知, 的能量低于 , 较稳定,反应生成的 容易转化为 ,则反应达平衡后,产物中 含量更大,主链含有4个C原子,1、4号C原子上含有Br原子,2、3号C原子上含有甲基,2号C原子含有碳碳双键,则该物质的名称为2,3-二甲基-1,4-二溴-2-丁烯;
由题目中信息可知,溶剂极性越大越容易发生1,4-加成,故若要提高该产物在平衡体系中的物质的量分数,还可采取的措施是在极性大的溶剂中进行反应。
(4)在一定温度下,向某反应容器中加入1.0 ml 和一定量的Br2发生上述反应。测得 的平衡转化率为α,平衡时Br2为b ml,若以物质的量分数表示的平衡常数Kx,反应③的平衡常数Kx3=4,则产物 的选择性百分比为______,开始加入的Br2为______ ml,反应①的平衡常数Kx1=__________。
设反应生成x ml ,反应③的平衡常数Kx3=4,则生成 的物质的量为4x ml,则产物 的选择性百分比为 ×100%=80%;反应开始时,加入1.0 ml ,的平衡转化率为α,则消耗 的物质的量为α ml,则消耗Br2的物质的量为α ml,平衡时Br2为b ml,故开始加入的Br2为(b+α) ml;
消耗 的物质的量为α ml,生成 和 的总物质的量为α ml,产物 的选择性百分比为80%,则生成 的物质的量为(1-80%)×α ml=0.2α ml,平衡时, 的物质的量为(1-α) ml,Br2为b ml,各物质总物质的量为(1+b) ml,
5.(2022·辽宁丹东一模)合成氨反应N2(g)+3H2(g) 2NH3(g)是目前最有效的工业固氮方法,解决了数亿人口生存问题。(1)反应历程中各步势能变化如图所示,其中吸附在催化剂表面的物种用“ad”表示。
该历程中反应速率最慢步骤的化学方程式为________________________。
Nad+3Had===NHad+2Had
从图中可以看出,活化能最大的一步反应是Nad+3Had===NHad+2Had。
(2)在T ℃、压强为0.9 MPa条件下,向一恒压密闭容器中通入氢氮比为3的混合气体,体系中气体的含量与时间变化关系如图所示:
①反应20 min达到平衡,试求0~20 min内氨气的平均反应速率v(NH3)=______ MPa·min-1,该反应的Kp=______ MPa-2(结果保留小数点后两位,Kp为以分压表示的平衡常数)。
②下列叙述能说明该条件下反应达到平衡状态的是______(填字母)。a.氨气的体积分数保持不变b.容器中氢氮比保持不变c.气体平均相对分子质量保持不变d.气体密度保持不变
氨气的体积分数保持不变,则各物质的浓度保持不变,反应达平衡状态,a正确;容器中氢氮比始终不变,则容器中氢氮比保持不变不能说明反应达平衡状态,b错误;气体总质量不变,气体总物质的量为变量,
若气体平均相对分子质量保持不变,说明反应达平衡状态,c正确;反应在恒压容器中进行,气体总质量不变,但体积可变,当体积不变时说明反应达平衡状态,d正确。
③若起始条件相同,在恒容容器中发生反应,则达到平衡时H2的含量符合图中_____(填“d”“e”“f”或“g”)点。
起始条件一样,在恒容容器中发生反应,相对于恒压状态,物质浓度减小,反应速率减慢,且恒容相当于减小压强,平衡逆向移动,H2的百分含量增大,所以g点符合要求。
(3)利用催化剂通过电化学反应在室温下合成氨的原理如图所示,该装置中阴极的电极反应式为_______________________。
N2+6e-+6H+===2NH3
根据图中信息可知,阴极上氮气得电子生成氨气,电极反应式为N2+6e-+6H+===2NH3。
新教材适用2024版高考化学二轮总复习第2部分新高考五大题型突破题型突破1化学反应原理综合题突破点3化学平衡图像课件: 这是一份新教材适用2024版高考化学二轮总复习第2部分新高考五大题型突破题型突破1化学反应原理综合题突破点3化学平衡图像课件,共30页。PPT课件主要包含了真题分点·研析,知能分点·突破,能力分点·提升,催化剂,能力越强,氢气浓度增加生成的等内容,欢迎下载使用。
新教材适用2024版高考化学二轮总复习第2部分新高考五大题型突破题型突破1化学反应原理综合题突破点2化学反应速率转化率与平衡常数计算课件: 这是一份新教材适用2024版高考化学二轮总复习第2部分新高考五大题型突破题型突破1化学反应原理综合题突破点2化学反应速率转化率与平衡常数计算课件,共30页。PPT课件主要包含了真题分点·研析,知能分点·突破,能力分点·提升等内容,欢迎下载使用。
新教材适用2024版高考化学二轮总复习第2部分新高考五大题型突破题型突破1化学反应原理综合题突破点1化学能与热能电能的相互转化课件: 这是一份新教材适用2024版高考化学二轮总复习第2部分新高考五大题型突破题型突破1化学反应原理综合题突破点1化学能与热能电能的相互转化课件,共58页。PPT课件主要包含了真题分点·研析,知能分点·突破,能力分点·提升,高考真题整体赏析,+128,02MPa,+H2O,ΔH2-ΔH1,H2g+,-200x+y等内容,欢迎下载使用。












