




新高考化学二轮复习核心考点逐项突破专题七 化学反应与能量(专练)(解析版)
展开
这是一份新高考化学二轮复习核心考点逐项突破专题七 化学反应与能量(专练)(解析版),文件包含新高考化学二轮复习核心考点逐项突破专题七化学反应与能量专练原卷版docx、新高考化学二轮复习核心考点逐项突破专题七化学反应与能量专练解析版docx等2份试卷配套教学资源,其中试卷共42页, 欢迎下载使用。
学校:___________姓名:___________班级:___________考号:___________
注意事项:
1.答题前,务必将自己的姓名、考号填写在答题卡规定的位置上。
2.答选择题时,必须使用2B铅笔将答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦擦干净后,再选涂其它答案标号。
3.答非选择题时,必须将答案书写在专设答题页规定的位置上。
4.所有题目必须在答题卡上作答。在试题卷上答题无效。
5.考试结束后,只交试卷答题页。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Mg-24 S-32 Cl-35.5
一、选择题(本题含16小题,每题3分,共48分。每题只有一个选项符合题意)
1.(2023·广东·深圳市光明区高级中学校联考模拟预测)分析下表中的3个热化学方程式,下列说法正确的是。
A.丙烷的燃烧热为
B.等质量的氢气与丙烷相比较,充分燃烧时,丙烷放热更多
C.
D.
【答案】C
【详解】A.燃烧热是在101 kPa时,1 ml物质完全燃烧生成稳定的氧化物时所放出的热量;由反应②可知,1ml丙烷燃烧生成液体水时,放出热量大于,A错误;
B.等质量的氢气与丙烷相比较,假设质量均为44g,则两者的物质的量分别为22ml、1ml,则由反应①②比较可知,充分燃烧时,氢气放热更多,B错误;
C.由盖斯定律可知,反应①×5-②得:,C正确;
D.由盖斯定律可知,反应①×-③得:,D错误;
故选C。
2.(2022·浙江·模拟预测)利用和制备的过程中,各物质的能量关系如图所示(表示活化能),下列说法正确的是
A.反应1的正反应活化能大于逆反应的活化能
B.反应2的反应速率决定了整个转化过程的反应速率
C.若该过程中使用合适的催化剂,则图中的高度将减小
D.在转化过程中,只存在C-H键的断裂和C-Cl键的形成
【答案】A
【详解】A.本题考查化学反应与能量变化,涉及活化能、催化剂与焓变的关系、化学键变化等。由图可知反应1为吸热反应,故正反应活化能大于逆反应活化能,A正确;
B.整个转化过程的速率由慢反应的速率决定,由于反应1的正反应活化能明显大于反应2,则可知反应1为慢反应,B错误;
C.催化剂只能改变反应活化能,无法改变,C错误;
D.转化过程中还存在键的断裂和键的形成,D错误;
故答案为:A。
3.(2023秋·天津河北·高三天津外国语大学附属外国语学校校考期末)碘在不同状态下(固态或气态)与氢气反应的热化学方程式如下所示。
① H2(g) + I2(?)2HI(g) ΔH = −9.48 kJ/ml
② H2(g) + I2(?)2HI(g) ΔH = +26.48 kJ/ml
下列判断正确的是
A.HI(g)比 HI(s)热稳定性更好
B.1ml 固态碘升华时将吸热 17 kJ
C.①中的 I2为固态,②中的 I2为气态
D.①的反应物总能量比②的反应物总能量高
【答案】D
【分析】气态碘的能量比固态碘的能量高,所以气态碘和氢气反应生成气态HI放出热量,而固态碘和氢气反应生成气态HI会吸收热量,所以反应①中的碘为气体,反应②中的碘为固体。
【详解】A.一般地,能量越低越稳定,同一物质,固态能量低于液态能量,液态能量低于气态能量,所以HI(s)比 HI(g)热稳定性更好,故A错误;
B.由以上分析可知,反应①中的碘为气体,反应②中的碘为固体,将反应②减去反应①,即可得到I2(s)= I2(g)的ΔH=+35.96kJ/ml,即1ml 固态碘升华时将吸热 35.96 kJ,故B错误;
C.由以上分析可知,反应①中的碘为气态,反应②中的碘为固态,故C错误;
D.一般地,同一物质,气态能量高于固态能量,所以①的反应物总能量比②的反应物总能量高,故D正确;
故选D。
4.(2023秋·天津南开·高三崇化中学校考期末)以下反应均可制取O2。下列有关说法正确的是
反应①:2H2O(l)=2H2(g)+O2(g) △H1=+571.6 kJ·ml-1
反应②:2H2O2(l)=2H2O(1)+O2(g) △H2=-196.4 kJ·ml-1
A.制取O2的反应一定是吸热反应
B.H2的燃烧热为-571.6 kJ·ml-1
C.若使用催化剂,反应②的△H将减小
D.反应2H2O2(l)=2H2O(g)+O2(g)的△H>-196.4 kJ·ml-1
【答案】D
【详解】A.制取O2的反应可能是放热反应,如过氧化氢在催化剂作用下的分解反应的△H<0,为放热反应,故A错误;
B.燃烧热是完全燃烧1ml物质得到最稳定的化合物所放出的热量,根据2H2O(l)=2H2(g)+O2(g)△H1=+571.6 kJ·ml-1可知,H2的燃烧热为0.5×571.6kJ•ml-1=285.8kJ•ml-1,故B错误;
C.使用催化剂,只能改变反应速率,不影响反应的△H,故C错误;
D.液态水变成气态水需要吸热,双氧水分解生成气态水放出的热量更小,△H更大,因此2H2O2(l)═2H2O(g)+O2(g)的△H>-196.4kJ•ml-1,故D正确;
故选D。
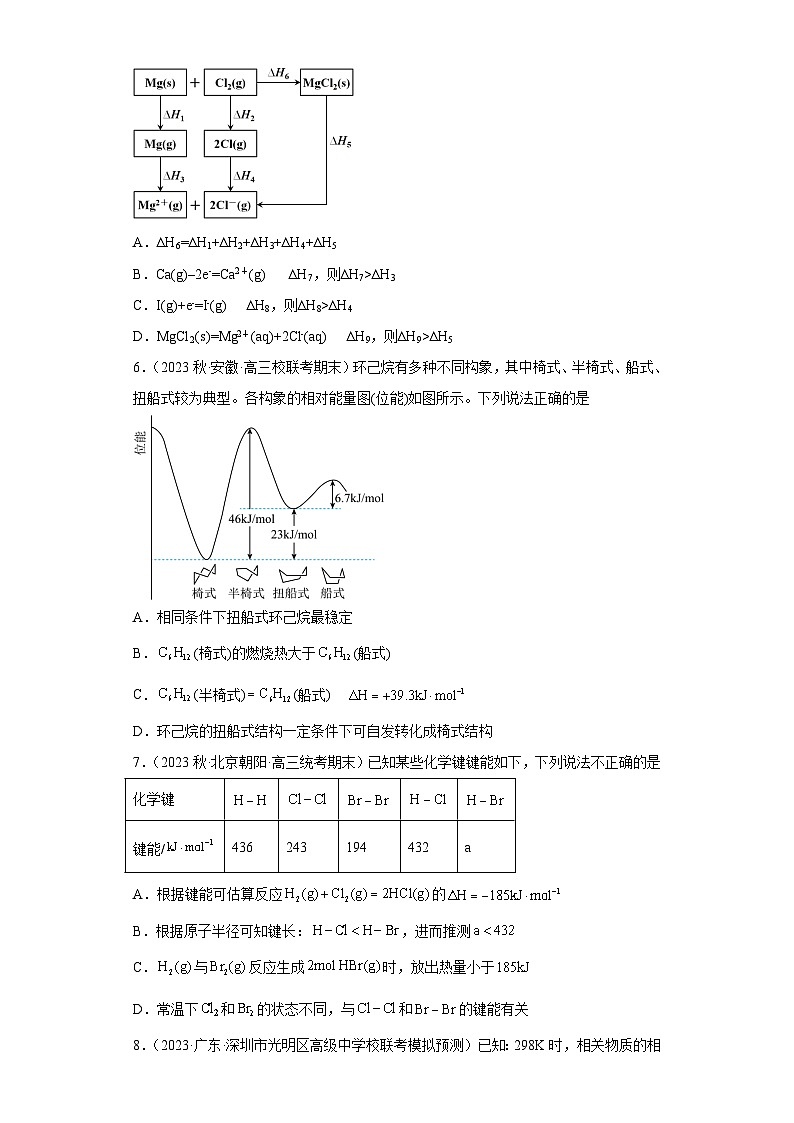
5.(2021·浙江绍兴·校考模拟预测)镁和氯气反应生成氯化镁的能量关系图如图所示。已知,气态的卤素原子得电子生成气态的卤离素子是放热过程。下列说法正确的是
A.∆H6=∆H1+∆H2+∆H3+∆H4+∆H5
B.Ca(g)–2e-=Ca2+(g) ∆H7,则∆H7>∆H3
C.I(g)+e-=I-(g) ∆H8,则∆H8>∆H4
D.MgCl2(s)=Mg2+(aq)+2Cl-(aq) ∆H9,则∆H9>∆H5
【答案】C
【详解】A.根据盖斯定律可知,∆H6=∆H1+∆H2+∆H3+∆H4-∆H5,故A错误;
B.原子失去电子变为离子属于吸热过程,Ca和Mg属于同主族,Ca的金属性强于Mg,Ca→Ca2+吸收热量小于Mg→Mg2+吸收热量,即∆H7<∆H3,故B错误;
C.原子得电子变为离子属于放热过程,Cl非金属性强于I,即Cl→Cl-放出热量比I→I-放出热量多,即∆H8>∆H4,故C正确;
D.MgCl2(s)=Mg2+(g)+2Cl-(g)属于吸热反应,即∆H5>0,Mg2+(g)、2Cl-(g)转化成Mg2+(aq)、2Cl-(aq)要放出热量,发生MgCl2(s)=Mg2+(aq)+2Cl-(aq)吸收热量比MgCl2(s)=Mg2+(g)+2Cl-(g)少,即∆H9<∆H5,故D错误;
答案为C。
6.(2023秋·安徽·高三校联考期末)环己烷有多种不同构象,其中椅式、半椅式、船式、扭船式较为典型。各构象的相对能量图(位能)如图所示。下列说法正确的是
A.相同条件下扭船式环己烷最稳定
B.(椅式)的燃烧热大于(船式)
C.(半椅式)(船式)
D.环己烷的扭船式结构一定条件下可自发转化成椅式结构
【答案】D
【详解】A.能量越低越稳定,由图图像可知椅式最稳定,A错误;
B.四种结构中,椅式能量最低最稳定,故椅式环己烷充分燃烧释放的热量最少,B错误;
C.(半椅式)(船式) ,反应放热,C错误;
D.扭船式结构转化成椅式结构释放能量,焓变小于0,根据△H-T△S,反应生成HBr比生成HCl更难,放出的热量更低,故生成时,放出热量小于,选项C正确;
D.Cl-Cl键能大于Br-Br键能,说明Cl2分子比Br2分子稳定,破坏的是共价键,而状态由分子间作用力决定,选项D不正确;
答案选D。
8.(2023·广东·深圳市光明区高级中学校联考模拟预测)已知:298K时,相关物质的相对能量如图所示。下列说法错误的是。
A.CO燃烧的热化学方程式为2CO(g)+O2(g)2CO2(g) ∆H=-566kJ∙ml-1
B.H2的燃烧热为∆H=-242kJ∙ml-1
C.C2H6比C2H4稳定
D.CO(g)+H2O(g)CO2(g)+H2(g)是放热反应
【答案】B
【详解】A.CO燃烧的热化学方程式为2CO(g)+O2(g)2CO2(g) ∆H=[(-393×2)-(-110×2+0)] kJ∙ml-1=-566kJ∙ml-1,A正确;
B.H2的燃烧热为∆H=[(-286)-(0+×0)] kJ∙ml-1=-286kJ∙ml-1,B错误;
C.C2H6的能量为-84kJ∙ml-1,C2H4的能量为52kJ∙ml-1,物质具有的能量越低,稳定性越强,则C2H6比C2H4稳定,C正确;
D.CO(g)+H2O(g)CO2(g)+H2(g) ∆H=[(-393+0)-(-110-242)] kJ∙ml-1=-41kJ∙ml-1,是放热反应,D正确;
故选B。
9.(2023秋·天津河西·高二天津实验中学校考期末)已知可分别通过如下两个反应制取氢气:
a.
b.
则下列说法正确的是
A.乙醇的燃烧热
B.升高反应a的反应温度,乙醇的平衡转化率减小
C.
D.制取等量的氢气,反应b吸收的能量更少
【答案】D
【详解】A.燃烧热指生成稳定的氧化物,应生成水、二氧化碳,根据题中信息,无法得到乙醇的燃烧热,A错误;
B.反应a为吸热反应,升高温度,平衡正向移动,乙醇的平衡转化率增大,B错误;
C.根据盖斯定律,由反应b-反应a2得 ,C错误;
D.由热化学方程式可知,生成1ml氢气,反应a吸收热量kJ,反应b吸收热量kJ,所以制取等量的氢气,反应b吸收的能量低于反应a,D正确;
答案选D。
10.(2022·浙江·模拟预测)由金属单质和氯气反应得到和的能量关系如图所示(M=Ca、Ba)。下列说法不正确的是
A.
B.
C.
D.
【答案】A
【详解】A.和分别代表M元素的第一电离能和第二电离能,均大于0,所以,A错误;
B.断键形成两个气态氯原子,该过程吸热,所以,气态氯原子得到一个电子可以形成稳定的8电子结构,该过程放热,所以,因此,B正确;
C.同主族元素从上到下第一电离能逐渐减小,所以第一电离能:,即,C正确;
D.由盖斯定律可知:,D正确。
故选A。
11.(2023·浙江金华·浙江省东阳中学校考模拟预测)乙烯是重要的工业原材料,中科院设计并完成了催化氧化制取的新路径,
其主要反应为:反应Ⅰ:
反应Ⅱ:
一定条件下,向容积为的容器中通入和,若仅考虑上述反应,平衡转化率和平衡时的选择性随温度、压强的关系如图所示,代表不同压强下乙烷的平衡转化率。
已知:
下列说法正确的是
A.压强
B.压强为、温度为T时,反应达平衡时,混合气体中
C.一定温度下,增大可提高的平衡转化率
D.反应
【答案】B
【分析】根据图像可知,L1和L2是乙烷转化率随温度变化的等压线,结合两个方程式的气体分子数变化可推断L1和L2的压强大小;根据图像中温度为T时,L1等压线乙烷转化率为50%,其中乙烯的选择性为80%,列出两个选择性反应的三段式可进行相关计算。
【详解】A.Ⅰ和Ⅱ反应前后气体分子数都增大,相同温度下,压强越大都有利于Ⅰ和Ⅱ反应的平衡逆移,乙烷的转化率减小,由图像可知,L2压强大乙烷转化率低,A错误;
B.根据题意和分析,Ⅰ和Ⅱ反应的三段式为:,,平衡时混合气体中,B正确;
C.一定温度下,增大 ,C2H6的平衡转化率下降,C错误;
D.反应 ΔH=2ΔH1-ΔH2,D错误;
答案选B。
【点睛】选择性的两个反应的平衡三段式要注意:相同物质的平衡量唯一且相同,按选择性比例列出相应反应的转变量,相同反应物的平衡量是起始量减去两次的消耗量,相同生成物的平衡量是起始量加上两次的生成量。
12.(2022·浙江·模拟预测)已知:在标准压强(101 kPa)、298 K下,由最稳定的单质合成1 ml物质B的反应焓变叫做物质B的标准摩尔生成焓,用表示。有关物质的如图所示。下列有关判断正确的是
A.2 ml NO(g)的键能大于1 ml 与1 ml 的键能之和-
B.的
C.标准燃烧热为
D.比稳定
【答案】D
【详解】A.根据题图,NO(g)的标准摩尔生成焓为,的反应物键能之和-生成物键能之和,即2ml NO(g)的键能小于1ml 与1 ml 的键能之和,A错误;
B.同种物质气态时的能量高于液态时的能量,的,B错误;
C.由题图数据可计算出①,②,②-①可得,的标准燃烧热是指生成液态水时放出的热量,应大于,C错误;
D.的标准摩尔生成焓为,的标准摩尔生成焓为,和反应生成放热,而生成吸热,则的能量比低,较稳定,D正确;
故选D。
13.(2022·浙江·模拟预测)在下催化和反应时的反应机理如下。
反应①:
反应②:
下列说法正确的是
A.反应①的
B.在高温条件下能自发进行、低温条件下不能自发进行
C.
D.使用可以降低反应的焓变
【答案】C
【详解】A.,反应①为吸热反应,该反应能自发进行,说明,即,A错误;
B.为放热反应,即,反应过程中,气体分子数减小,则,根据时反应能自发进行,可知该反应低温下能自发进行、高温下不能自发进行,B错误;
C.的催化氧化反应为放热反应,反应①+反应②得反应,结合盖斯定律,则,已知、,则,C正确;
D.为催化剂,催化剂可降低反应的活化能,但不能改变焓变,D错误。
故选C。
14.(2023秋·北京·高三统考期末)环已烯是有机合成的重要中间体,可由环已烷氧化脱氢制备。已知几种物质的燃烧热(25℃,):
下列说法正确的是A.氢气燃烧的热化学方程式为
B.由燃烧热可知,环已烯的能量小于环已烷的能量
C. (l)= (l)+H2(g)
D.环已烷氧化脱氢制备环已烯时,氧气和高锰酸钾均可作氧化剂
【答案】C
【详解】A.燃烧热是在101 kPa时,1 ml物质完全燃烧生成稳定的氧化物时所放出的热量;氢气燃烧的热化学方程式为 ,A错误;
B.等量的环已烯、环已烷燃烧耗氧量、生成水的量不同,由燃烧热不能判断环已烯的能量小于环已烷的能量,B错误;
C.由燃烧热可知,①
②
③
由盖斯定律可知,③-①-②得:(l)= (l)+H2(g) ,C正确;
D.环已烯中含有碳碳双键,会被高锰酸钾氧化,D错误;
故选C。
15.(2023秋·北京西城·高三统考期末)转化可减少排放并实现资源利用。催化氧化乙烷制乙烯的主要反应有:
①:
②:
反应的能量变化如图1所示。体系中还存在其他副反应。相同时间内,乙烷的转化率、乙烯的选择性与温度的关系如图2所示。
已知:乙烯的选择性为转化的乙烷中生成乙烯的百分比,下列说法不正确的是
A.
B.反应②比反应①的速率小,是总反应的决速步
C.在图2所画曲线的温度范围内,温度越高,乙烯的产率越低
D.其他条件不变,适当增大投料比,能提高的转化率
【答案】C
【详解】A.由图可知,=生成物的能量减去反应物的能量=-300kJ/ml-(-477 kJ/ml)=+177kJ/ml,故A正确;
B.由图可知,反应①的活化能大于反应②的活化能,则反应②比反应①的速率小,速率小的是总反应的决速步,故B正确;
C.由图可知,在图2所画曲线的温度范围内,温度越高,乙烯的选择性越低,但是乙烷的转化率越高,无法确定乙烯的产率的变化,故C错误;
D.其他条件不变,适当增大投料比,反应①正向移动,能提高的转化率,故D正确;
故选C。
16.(2023秋·北京东城·高二汇文中学校考期末)联合和制取时,发生的主要反应如下:
①
②
将、和按一定比例通入填充有催化剂的恒容反应器,在不同温度下,反应相同时间内(反应均未达到化学平衡状态)测得的值如下图所示。
下列说法不正确的是
A.若反应足够长时间,①与②同时达到化学平衡状态
B.由①②可知,
C.其他条件不变时升高温度,反应①的正反应速率增大、逆反应速率减小
D.其他条件不变时,增大原料中的浓度可以提高产物中的值
【答案】C
【分析】由已知可知,反应①和②均为吸热反应,升高温度,正逆反应速率增大,平衡正向移动;
【详解】A.反应①与②均为吸热反应,若反应足够长时间,可同时达到化学平衡状态,故A正确;
B.根据盖斯定律,反应①—反应②可得,,故B正确;
C.其他条件不变时升高温度,反应①的正反应和逆反应速率均增大,故C错误;
D.其他条件不变时,增大原料中的浓度,转化率增大,根据反应①,生成的氢气量增多,可以提高产物中的值,故D正确;
故选C。
二、非选择题 (本题共5小题,1-3题每题10分,4-5题每题11分,共52分)
17.(2023秋·上海闵行·高二上海市七宝中学校考期末)环戊二烯()重要的有机合成中间体。一定条件下,存在以下转化:
反应①:
反应②:
反应③:
(1)反应①的_______。
(2)反应③的化学平衡常数表达式_______。
(3)在恒温恒容的容器中,当反应②达到化学平衡时,则下列一定正确的是_______。
a.气体分子数不变 b.
c. d.断裂键的同时断裂键
(4)恒温恒容时,和(g)发生反应③,测得平衡时容器内压强变为起始的1.2倍,则环戊烯的转化率为_______。
(5)欲提高反应③的正反应速率,且K值不变,可采取的措施有_______(选填编号)。
a.通入 b.升高温度
c.提高环戊烯浓度 d.分离出
(6)已知两分子环戊二烯易发生加成反应形成二聚体。不同温度下在容器中环戊二烯物质的量与反应时间的关系如图所示。推测_______(选填=、<或>);时,用二聚体表示的平均反应速率_______。
【答案】(1)100.3
(2)
(3)ad
(4)40%
(5)c
(6) <
【详解】(1)根据盖斯定律可知,①=③-②,则;
(2)反应③的化学平衡常数表达式;
(3)a.该反应属于反应前后气体分子数不变的反应,则达到化学平衡时气体分子数不变,a正确;
b.时,反应达到化学平衡状态,b错误;
c.由于起始投料量未知,则时,反应不一定达到平衡状态,c错误;
d.断裂键代表正反应速率,断裂键代表逆反应速率,则当断裂键的同时断裂键,反应达到平衡状态,d正确;
故选ad。
(4)设变化xml,根据题意列三段式有
恒温恒容下,压强之比等于物质的量之比,则,解得x=0.2,环戊烯的转化率为;
(5)a.若是在恒温恒容条件下,通入惰性气体,各组分浓度不变,正逆反应速率不变,若是在恒温恒压条件下,通入惰性气体,相当于增大容器体积,各组分浓度均减小,正逆反应速率均减小,a不符合题意;
b.升高温度,平衡正向移动,K值增大,b不符合题意;
c.提高环戊烯浓度,即增大反应物浓度,加入反应物这一瞬间,正反应速率突然增大,后逐渐减小,总的结果正反应速率增大,温度不变,K值不变,c符合题意;
d.分离出,即减小生成物的浓度,平衡正向移动,正反应速率减小,d不符合题意;
故选c。
(6)环戊二烯容易发生聚合生成二聚体,该反应为可逆反应。不同温度下2L溶液中环戊二烯物质的量与反应时间的关系如图所示。b点时,0-1小时内环戊二烯的浓度变化为:,环戊二烯的二聚体的浓度为环戊二烯浓度变化的,则b点时二聚体的浓度为,二聚体的生成速率v=;温度越高反应速率越快,根据图示可知,在温度T2(虚线)的反应速率较大,则T1<T2。
18.(2023秋·甘肃武威·高二天祝藏族自治县第一中学校考期末)试回答下列问题:
i.
(1)实验测得,5 g甲醇()液体在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5 kJ的热量,则表示甲醇燃烧热的热化学方程式为__________________________________________.
(2)已知:
则______。
ii.二甲醚(DME)被誉为“21世纪的清洁燃料”,由合成气制备二甲醚的主要原理如下:
①
②
③
回答下列问题:
(3)反应的______;
(4)下列措施中,能提高(1)中产率的有______(填字母)。
A.使用过量的CO B.升高温度 C.增大压强
(5)已知某些化学键的键能数据如下表:
则反应的焓变______。
【答案】(1)
(2)>
(3)
(4)AC
(5)
【详解】(1)1 ml 完全燃烧放出的热量为kJ,反应的热化学方程式为;
(2)甲醇的燃烧是放热反应,而对于放热反应,生成物及其聚集状态相同时,反应物的能量越高,反应放出的热量越多.等物质的量的的能量低于,故2 ml 燃烧时放出的热量少于2 ml 燃烧放出的热量,而放热反应的,故;
(3)根据盖斯定律可知,①×2+②+③得到;
(4)为提高的产率,应使平衡正向移动;A.使用过量的CO,平衡正向移动,产率增大,选项A符合;
B.升高温度,平衡向吸热反应的逆反应方向移动,产率减小,选项B不符合;
C.增大压强,平衡向气体体积缩小的正反应方向移动,产率增大,选项C符合;
答案选AC;
(5)反应物总键能-生成物总键能,则该反应的。
19.(2023秋·山东泰安·高二校考期末)氮氧化物的排放是造成大气污染的原因之一,消除氮氧化物的污染对生态文明建设具有重要意义,回答下列问题:
(1)①
②
则相同条件下_______。
(2)一定温度下,将、充入恒压密闭容器中发生反应。已知起始压强为10MPa,10min时反应达到平衡状态,测得的物质的量为0.5ml,则:
①0~10min内,平均反应速率_______(保留2位小数)
②此反应的平衡常数_______(是以物质的量分数表示的平衡常数)。
③该条件下,可判断此反应达到平衡状态的标志是_______。
A.单位时间内,断裂同时形成
B.混合气体的平均相对分子质量不再改变
C.混合气体的密度不再改变
D.CO与NO的转化率比值不再改变
④若此时再向容器中充入和,达到新平衡时NO的转化率将_______(填“增大”“减小”或“不变”)。
【答案】(1)
(2) 0.09 0.31 BC 不变
【详解】(1)由反应①
②,
根据盖斯定律②-①可得,,故-566kJ/ml-180kJ/ml=kJ/ml;
(2)①根据已知可知
的压强的变化为×10MPa≈0.9MPa,故0~10min内,平均反应速率0.09;
②此反应的平衡常数≈0.31;
③A.单位时间内,断裂2mlC=O同时形成,正反应速率和逆反应速率不相等,不能说明达到平衡,选项A错误;
B.该反应是气体分子数不相等的反应,混合气体的平均相对分子质量不再改变,可以说明达到平衡,选项B正确;
C.容器是恒压容器,反应是气体分子数不相等的反应,混合气体的密度不再改变可以说明达到平衡,选项C正确;
D.CO与NO的转化量相等,设任一时刻转化量为aml,则CO与NO的转化率比值为=2,始终为定值,则CO与NO的转化率比值不再改变,不能说明反应达到平衡,选项D错误;
故答案为:BC;
④恒温恒压条件下,向容器中充入和,与原平衡通入的反应物的比值相同,属于等比等效平衡,故转化率不变。
20.(2023秋·新疆乌鲁木齐·高二乌市八中校考期末)I.以H2合成尿素CO(NH2)2的有关热化学方程式有:
①N2(g)+3H2(g)=2NH3(g) ΔH1=-92.4 kJ·ml-1
②NH3(g)+CO2(g)=NH2CO2NH4(s) ΔH2=-79.7 kJ·ml-1
③NH2CO2NH4(s)=CO(NH2)2(s)+H2O(l) ΔH3=+72.5 kJ·ml-1
(1)则N2(g)、H2(g)与CO2(g)反应生成CO(NH2)2(s)和H2O(l)的热化学方程式为_______。
II.一定条件下,在容积为5L的密闭容器中,发生反应A(g)+2B(g)2C(g),已知达平衡后,降低温度,A的体积分数减小。
(2)该反应的反应速率v随时间t的关系如图乙所示。
①根据图乙判断,在t3时刻改变的外界条件是_______。
②a、b、c对应的平衡状态中,C的体积分数最大的是状态_______。
③各阶段的平衡常数如表所示:
K1、K2、K3之间的大小关系为_______(用“>”“<”或“=”连接)。
III.在密闭容器中充入一定量的H2S,发生反应:2H2S(g)2H2(g)+S2(g) ΔH,如图丙所示为H2S气体分解生成H2(g)和S2(g)的平衡转化率与温度、压强的关系。
(3)ΔH_______(填“>”“<”“=”)0。
(4)图丙中压强(p1、p2、p3)的大小顺序为_______。
(5)图丙中M点对应的平衡常数Kp=_______MPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(6)如果想进一步提高H2S的转化率,除改变温度、压强外,还可以采取的措施有_______。
【答案】(1)N2(g)+3H2(g)+CO2(g)=CO(NH2)2(s)+H2O(l) ΔH=-179.3 kJ·ml-1
(2) 升高温度 a K1>K2=K3
(3)>
(4)p3>p2>p1
(5)1
(6)及时分离出产物
【详解】(1)已知反应①N2(g)+3H2(g)=2NH3(g) ΔH1=-92.4 kJ·ml-1;反应②NH3(g)+CO2(g)=NH2CO2NH4(s) ΔH2=-79.7 kJ·ml-1;反应③NH2CO2NH4(s)=CO(NH2)2(s)+H2O(l) ΔH3=+72.5 kJ·ml-1;N2(g)、H2(g)与CO2(g)反应生成CO(NH2)2(s)和H2O(l)的化学方程式为N2(g)+3H2(g)+CO2(g)=CO(NH2)2(s)+H2O(l),根据盖斯定律可知,由①+2×②+③可得目标方程式,则ΔH=-92.4 kJ·ml-1+2×(-79.7 kJ·ml-1) +72.5 kJ·ml-1-179.3 kJ·ml-1,故热化学方程式为N2(g)+3H2(g)+CO2(g)=CO(NH2)2(s)+H2O(l) ΔH= -179.3 kJ·ml-1。
(2)①降低温度,A的体积分数减小,即降温平衡正向移动,则正反应为放热反应,在t3时刻,正逆反应速率瞬间均增大,则可能为升温或加压,逆反应速率大于正反应速率,平衡逆向移动,而加压平衡正向移动,升温平衡逆向移动,故改变的外界条件是升高温度。
②在t3时刻改变条件,平衡逆向移动,C的体积分数减小,t5时刻改变条件,正逆反应速率相等,平衡不移动,则 a、b、c对应的平衡状态中,C的体积分数最大的是状态a。
③平衡常数只与温度有关,t3时刻升温,升温平衡逆向移动,平衡常数减小,则K1>K2,t5时刻,平衡不移动,应该是加入的催化剂,平衡常数不变,则K2=K3,故K1、K2、K3之间的大小关系为K1>K2=K3。
(3)随温度升高,H2S的平衡转化率增大,即升温平衡正向移动,则正反应为吸热反应,ΔH>0。
(4)该反应的正反应为气体物质的量增大的反应,减压平衡正向移动,H2S的平衡转化率增大,则图丙中压强(p1、p2、p3)的大小顺序为p3>p2>p1。
(5)M点H2S的平衡转化率为50%,设起始时H2S的物质的量为1ml,则转化量为0.5ml,平衡时剩余0.5ml,生成0.5mlH2,0.25ml S2,各气体的分压为:、、,则图丙中M点对应的平衡常数。
(6)如果想进一步提高H2S的转化率,除改变温度、压强外,还可以采取的措施有及时分离出产物,减小生成物浓度,平衡正向移动。
21.(2023秋·湖南长沙·高三统考期末)2021年中国政府工作报告中提出碳中和目标:在2030年前达到最高值,2060年前达到碳中和。因此对二氧化碳的综合利用显得尤为重要。
(1)通过电解的方式可实现对二氧化碳的综合利用。2022年7月香港中文大学王莹教授研发新型电解槽实现二氧化碳回收转化效率达到60%以上。
双金属催化剂在某介质中催化转化为转化示意图如图所示,请写出其电极反应方程式:_______。
(2)在席夫碱(含“”有机物)修饰的纳米金催化剂上,直接催化加氢成甲酸。其反应历程如下图所示,其中吸附在催化剂表面上的物质用*标注。
该历程中起决速步骤的化学方程式是_______;
(3)通过使用不同新型催化剂,实现二氧化碳加氢合成转化为二甲醚 (CH3OCH3)也有广泛的应用。
反应Ⅰ:
反应Ⅱ:
反应Ⅲ:
① _______
②起始压强为4.0MPa、恒压条件下,通入氢气和二氧化碳的的情况下,不同温度下的平衡转化率和产物的选择性(选择性是指生成某物质消耗的占消耗总量的百分比)如下图所示:
当温度超过290℃,的平衡转化率随温度升高而增大的原因是_______。在上图中,在200℃时,若经过0.2s该平衡体系即达到平衡。计算分压的平均变化速率为_______;此时对于反应Ⅰ的_______(保留三位有效数字)
【答案】(1)
(2)
(3) 反应Ⅲ为吸热反应,当温度超过290℃,反应Ⅲ占主导因素,的选择性增大得更快,更有利于反应Ⅲ正向移动,故的转化率随温度升高而增大 1.5
【详解】(1)根据图示可知,在碱性条件下得电子被还原转化为,其电极反应式为:;
(2)起决速步骤为正反应活化能最高的步骤,根据图示可知,该步骤为TS-2,即反应为:;
(3)①根据盖斯定律可知,反应Ⅰ×2+II可得到,所以对应的反应焓变=;
②反应Ⅲ为吸热反应,当温度超过290℃,反应Ⅲ占主导因素,的选择性增大得更快,更有利于反应Ⅲ正向移动,故的转化率随温度升高而增大;
设起始为,的起始分压,的平衡转化率50%,则转化的为,二甲醚的选择性为80%,则说明有的转化为二甲醚。的起始分压为,达平衡时分压为,则
,分压的平均变化速率:;
,则反应达到平衡后各物质的物质的量分别为n(CO2)=(1-0.5)ml=0.5ml,n(H2)=(4-3×0.5)ml=2.5ml,n(CH3OH)=(0.5-0.5×80%)ml=0.1ml,n(CH3OCH3)=( )ml=0.2ml,n(H2O)= (0.5+)ml=0.7ml,总气体的物质的量,所以反应I的Kp==MPa。
2022年北京冬奥会“飞扬”火炬使用的燃料
氢气
①
2008年北京奥运会“祥云”火炬使用的燃料
丙烷
②
③
化学键
键能/
436
243
194
432
a
名称
氢气
环已烯
环已烷
化学式(状态)
共价键
H—H
Cl—Cl
H—Cl
键能/()
436
247
434
t2~t3
t4~t5
t5~t6
K1
K2
K3
相关试卷
这是一份高考化学二轮复习核心考点逐项突破专题一0实验基础(专练)(原卷版+解析),共37页。试卷主要包含了所有题目必须在答题卡上作答,考试结束后,只交试卷答题页等内容,欢迎下载使用。
这是一份高考化学二轮复习核心考点逐项突破专题九电解池(专练)(原卷版+解析),共33页。试卷主要包含了所有题目必须在答题卡上作答,考试结束后,只交试卷答题页,8L气体,05ml CO2时,有0,1kJ/ml-1等内容,欢迎下载使用。
这是一份高考化学二轮复习核心考点逐项突破专题八原电池(专练)(原卷版+解析),共33页。试卷主要包含了所有题目必须在答题卡上作答,考试结束后,只交试卷答题页,2ml Zn,转移电子0等内容,欢迎下载使用。








