




新高考化学二轮复习讲练测专题13 工艺流程综合题(测)(解析版)
展开可能用到的相对原子质量:H 1 Li 7 B 11 C 12 N 14 O 16 Na 23 Mg 24 Al 27 S 32 Cl 35.5
一、非选择题:本题共10个小题,共100分。
1.北京冬奥会奖牌中铜牌的主要成分为铜和锌。已知一种从硫中毒而失活的废甲醇催化剂(主要成分为等)中回收铜和锌的工艺流程如图甲所示。
已知:①“滤液"中含锌氨络合离子;②,。
回答下列问题:
(1)“焙烧1”时产生气体的主要成分为_______。
(2)“浸取”时溶解的离子方程式为_______。
(3)“调”的目的是生成沉淀,完全沉淀时溶液的最小为_______[已知c(Zn2+)≤1×10-5ml/L时视为完全沉淀]。
(4)“抽滤”是减压过滤,与普通过滤相比,“抽滤”的优点是_______。
(5)现取样品,逐渐升温加热分解,分解过程的热重曲线(样品质量随温度变化的曲线)如图乙所示。
焙烧生成的温度范围为_______,时发生反应的化学方程式为_______。
(6)已知该废甲醇催化剂中的质量分数为(其他成分中不含),该废甲醇催化剂经上述转化最终得到,则铜的提取率为_______%(用含m的代数式表示,)。
【答案】(1) (2) (3)8.24
(4)过滤速度快,且所得固体较干燥 (5) (6)
【解析】根据废催化剂含有成分,焙烧1,硫燃烧转化成SO2,甲醇转化成CO2、H2O,“浸取”步骤中ZnO溶于氯化铵生成锌氨络合离子[Zn(NH3)4]2+,滤渣为CuO,加入稀硫酸溶解,CuO转化成CuSO4,然后经过一系列操作得到蓝矾,锌氨络合离子[Zn(NH3)4]2+,调节pH,得到氢氧化锌沉淀,焙烧3,得到氧化锌。(1)根据上述分析,焙烧1中产生气体主要成分为CO2、SO2;(2)“浸取”时得到锌氨络合离子[Zn(NH3)4]2+,其离子方程式为ZnO+4NH=[Zn(NH3)4]2++H2O+2H+;(3)“调pH”时,当溶液中c(Zn2+)≤1×10-5ml/L时视为完全沉淀,可认为Zn2+沉淀完全,根据Ksp[Zn(OH)2]=3×10-17,可得到此时c(OH-)=ml/L=×10-6ml/L,pOH≈6-0.24=5.76,即pH=14-5.76=8.24;(4)“抽滤”为减压过滤,与普通过滤相比,“抽滤”的优点时过滤速度快,且所得固体较干燥;(5)n(CuSO4·5H2O)==0.01ml,根据铜原子守恒,当固体为CuO时,n(CuO)=0.01ml,其质量为0.01ml×80g/ml=0.80g,根据图像可知,焙烧生成CuO的温度范围是680~1000℃;1000℃时得到产物中m(Cu)=0.64g,m(O)=(0.72-0.64)g=0.08g,n(O)=0.005ml,则所得物质的化学式为Cu2O,反应方程式为4CuOeq \(=====,\s\up7(1000 ℃))2Cu2O+O2↑;(6)根据题意可知,废甲醇催化剂中Cu的质量为()g,所得产品CuO中含Cu的质量为()g,故Cu的提取率为。
2.软锰矿的主要成分为,还含有、MgO、、CaO、等杂质,工业上用软锰矿制取的流程如下:
已知:①部分金属阳离子完全沉淀时的pH如下表。
②温度高于27℃时,的溶解度随温度的升高而逐渐降低.
(1)“浸出”过程中通入的作用是__________________。
(2)第1步除杂中加入的目的是__________________(用离子方程式表示)。.
(3)第1步除杂中需要调整溶液pH的范围是______到______,调pH时可选择的试剂为______(填字母)。
a.氨水 b. c.CaO d.MgO
(4)第2步除杂,主要是将、转化为相应氟化物沉淀除去,写出除去的离子方程式:________________________,该反应的平衡常数为__________________。
(已知:的;的;的)
(5)“系列操作”中的具体操作有__________________,经干燥得到。
【答案】(1)将MnO2还原为Mn2+ (2) (3) 5.2 7.9 cd
(4) MnF2 + Ca2+Mn2+ + CaF2 (5)蒸发浓缩、趁热过滤
【解析】由流程可知,软锰矿的主要成分为MnO2,还含有Fe2O3、MgO、Al2O3、CaO、等杂质,加入硫酸并通入SO2浸出,其中MnO2和SO2发生反应SO2+MnO2=MnSO4,Fe2O3、MgO、Al2O3、CaO和H2SO4反应生成相应金属阳离子,和H2SO4不反应;过滤后所得浸出渣为,在所得浸出液中,先加H2O2将亚铁离子氧化为铁离子,再调节pH,由氢氧化物的沉淀pH可知,铁离子、铝离子转化为沉淀,则滤渣I为Fe(OH)3、Al(OH)3;在第2步除杂中,将、转化为相应氟化物沉淀除去;最后经一系列操作得到MnSO4•H2O,以此来解答。(1)“浸出”过程中,MnO2和SO2发生反应SO2+MnO2=MnSO4,则通入的作用是将MnO2还原为Mn2+;(2)第1步除杂中加入H2O2的目的是将溶液中的Fe2+氧化为Fe3+,以便于形成Fe(OH)3沉淀,过滤将沉淀除去,反应的离子方程式为;(3)第1步除杂中,需要将、完全转化为沉淀除去,则pH大于5.2,并且需要不沉淀,根据表格数据,当完全沉淀时,,设起始物质的量浓度为1ml/L,则开始沉淀时,,故需要调整溶液pH的范围是5.2到7.9;在调pH至5.27.9时,为了不引入新的杂质离子,所加的试剂应该可以与酸发生反应,可选择CaO、MgO,生成的Ca2+、Mg2+可在第2步除杂除去,故可选择的试剂为cd;(4)第2步除杂,主要是将Ca2+、Mg2+转化为相应氟化物沉淀除去, MnF2除去Ca2+的离子反应方程式是MnF2 + Ca2+Mn2+ + CaF2;该反应的平衡常数数值为K=;(5)MnSO4·H2O在水中的溶解度随温度的升高而减小,采用“趁热过滤”操作可以减少MnSO4·H2O在水中的溶解,得到更多所得产品,故具体操作有:蒸发浓缩、趁热过滤。
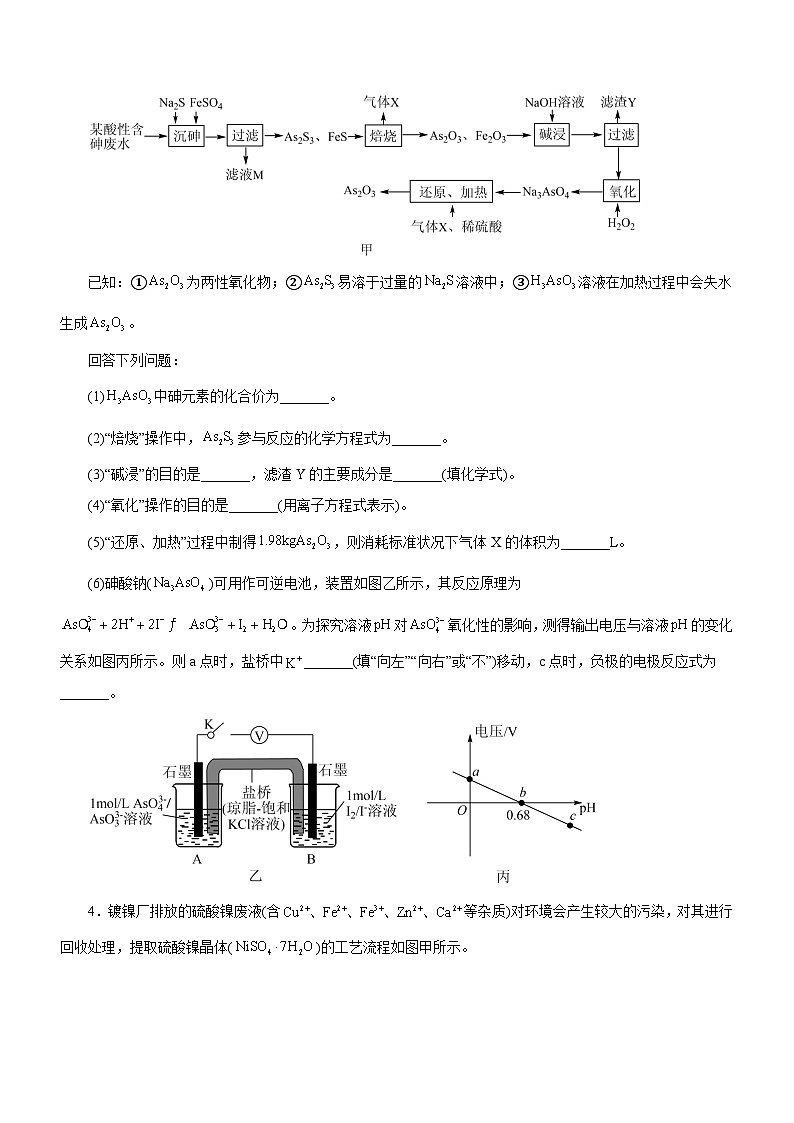
3.三氧化二砷(As2O3)可用于治疗急性早幼粒细胞白血病。利用某酸性含砷废水(含H3AsO3、H2SO4)可提取As2O3,其工艺流程如图甲所示。
已知:①为两性氧化物;②易溶于过量的溶液中;③溶液在加热过程中会失水生成。
回答下列问题:
(1)中砷元素的化合价为_______。
(2)“焙烧”操作中,参与反应的化学方程式为_______。
(3)“碱浸”的目的是_______,滤渣Y的主要成分是_______(填化学式)。
(4)“氧化”操作的目的是_______(用离子方程式表示)。
(5)“还原、加热”过程中制得,则消耗标准状况下气体X的体积为_______L。
(6)砷酸钠()可用作可逆电池,装置如图乙所示,其反应原理为。为探究溶液对氧化性的影响,测得输出电压与溶液的变化关系如图丙所示。则a点时,盐桥中_______(填“向左”“向右”或“不”)移动,c点时,负极的电极反应式为_______。
【答案】(1) (2)(3) 将转化为,与分离
(4) (5)448 (6) 向左
【解析】酸性含砷废水(含H3AsO3、H2SO4)加入Na2S和FeSO4得到As2S3和FeS沉淀,过滤将沉淀和滤液分离;As2S3和FeS在空气中焙烧得到As2O3、Fe2O3以及SO2,加入NaOH溶液溶解焙烧产物,As2O3反应生成Na3AsO3形成溶液,过滤得到的滤渣Y为Fe2O3,加入双氧水将Na3AsO3氧化得到Na3AsO4,通入二氧化硫和稀硫酸将Na3AsO4还原得到As2O3。(1)由化合价代数和为0可知,亚砷酸中砷元素为+3价;(2)由分析可知,硫化砷在空气中煅烧生成三氧化二砷和二氧化硫,反应的化学方程式为2As2S3+9O2eq \(=====,\s\up8(煅烧))2As2O3+6SO2;(3)由分析可知,碱浸的目的是将As2O3转化为Na3AsO3,与Fe2O3分离,滤渣Y为氧化铁;(4)加入过氧化氢溶液氧化操作的目的是亚砷酸钠与过氧化氢溶液反应生成砷酸钠和水,反应的离子方程式为+H2O2=+H2O;(5)由分析可知,向砷酸钠溶液中加入稀硫酸酸化得到砷酸,通入二氧化硫气体将砷酸还原为亚砷酸,亚砷酸受热分解生成三氧化二砷,由得失电子数目守恒可知,二者关系为AsO43-~SO2,生成1.98kg三氧化二砷时,根据砷元素守恒,反应消耗标准状况下二氧化硫的体积为×2×22.4L/ml=448L;(6)由图可知,a点时,溶液pH为0,平衡向正反应方向移动,甲池中石墨电极为原电池的正极,乙池中石墨电极为负极,则盐桥中钾离子向左侧甲池移动;c点时,溶液pH减小,平衡向逆反应方向移动,乙池中石墨电极为正极,甲池中石墨电极为负极,在水分子作用下,亚砷酸根在负极失去电子发生氧化反应生成砷酸根离子,电极反应式为+H2O-2e-=+2H+。
4.镀镍厂排放的硫酸镍废液(含等杂质)对环境会产生较大的污染,对其进行回收处理,提取硫酸镍晶体()的工艺流程如图甲所示。
已知:时,有关金属离子开始沉淀与沉淀完全的范围(a)、硫化物的酸溶性(b)如表所示。
回答下列问题:
(1)滤渣Ⅲ的主要成分是_______(用化学式表示)。
(2)“硫化”过程中发生反应的离子方程式为_______。
(3)“调”时,应调节溶液的范围为_______;实验室“萃取分液”时用到的玻璃仪器有_______。
(4)“萃取分液”选用有机萃取剂HDEHP萃取金属离子(用表示,为)的原理为。室温下,几种金属离子的萃取率[萃取率]随溶液的变化关系如图乙所示。
①“萃取分液”时进入有机相被除去,则应调节溶液的最佳范围是_______。
②若每次萃取,的萃取率均为75%,则经5次萃取后,水相中残余的物质的量浓度为(忽略水相体积变化),达到除杂要求。则“沉钙后,溶液中的物质的量浓度为_______(列出计算式即可)。
【答案】(1) (2)、
(3) 分液漏斗、烧杯 (4)
【解析】‘硫化’是S2-和Cu2+结合成沉淀,同时S2-具有强还原性,能与Fe3+发生氧化还原反应生成Fe2+和S单质,滤渣I为S和CuS,滤液中含Fe2+、Zn2+、Ca2+,‘氧化’中H2O2氧化Fe2+为Fe3+,用Ni(OH)2消耗H+调节pH使Fe3+沉淀,‘沉钙’中发生沉淀转化,得到滤液中含Zn2+、Ni2+,利用萃取剂将Zn2+保留在有机相,水相含NiSO4。(1)根据分析可知,滤渣Ⅲ的主要成分是。(2)“硫化”是S2-和Cu2+结合成沉淀,同时S2-具有强还原性,能与Fe3+发生氧化还原反应生成Fe2+和S单质,过程中发生反应的离子方程式为、。(3)“氧化”时将氧化为,“调”的目的是除去,使溶液中沉淀完全而不沉淀(产生沉淀是允许的,因为萃取分液除去),故调节溶液范围为。实验室“萃取分液”时需要使用的玻璃仪器有分液漏斗、烧杯。(4)①“萃取分液”时进入有机相被除去,为了尽可能多地除去的同时减少的损耗,根据题图乙可知,应调节溶液的最佳范围是3~4。②根据萃取率,可推出,故=ml/L。
5.钌粉主要用于生产钌靶材,而钌靶材是生产计算机硬盘不可替代的材料。以钌废料(废料中钌主要以单质的形式存在,还含有Al、Cr、Cr、CO、Ti、Fe等杂质)制备高纯钌粉的流程如下:
已知:i.钌在碱性条件下被氯气氧化为,是有毒的挥发性物质,用盐酸吸收得到红色溶液,其中还含有少量;
ii.易溶于水,微溶于酒精。
回答下列问题:
(1)钌废料在碱性条件下被氯气氧化的离子方程式为_______;钌废料氧化时,随着温度的升高,钌的回收率变化如图所示。综合考虑,确定氧化时的温度以_______℃为宜。
(2)用盐酸吸收蒸馏产物时发生主要反应的化学方程式是_______。
(3)沉淀用乙醇洗涤而不用水洗涤的优点是_______。
(4)加入的主要作用是_______,同时又调节了溶液的,有利于沉淀反应的发生。流程中可以循环利用的物质_______。
(5)煅烧的过程分为两步:第1步是氯钌酸铵分解生成钌单质和一种无毒的气体单质,同时有两种化合物生成;第2步是钌单质与氧气反应生成钌的氧化物()。第1步的化学方程式是_______。
【答案】(1) 80 (2)
(3)减少沉淀溶解损失 (4) 使溶液中低价的氧化为高价的 盐酸、氯气
(5)
【解析】钌废料被氯气氧化成,杂质被氧化成为氯化物,蒸馏出,与盐酸反应生成,溶液浓缩后,加双氧水和氯化铵反应得到沉淀,煅烧得到,经氢气高温还原得到高纯度钌粉,据此分析解答。(1)钌废料在碱性条件下被氯气氧化为,根据得失电子守恒及元素守恒得反应方程式:,钌废料氧化时,随着温度的升高,钌的回收率逐渐升高,在80℃左右回收率已经很高,再升高温度回收率增幅不明显,且会增加能量消耗,因此温度80℃为宜;(2)盐酸吸收蒸馏产物时转化为,Ru化合价降低,发生氧化还原反应,则HCl中氯元素被氧化为氯气,根据得失电子守恒可得反应方程式:;(3)易溶于水,微溶于酒精,用酒精洗涤可减少的溶解损失;(4)溶液,含有少量,中Ru化合价为+3价,加双氧水后产物中Ru化合价为+4价,可知双氧水将+3价Ru氧化成高价态,加盐酸过程中生成的氯气以及煅烧过程中生成的HCl气体可以循环利用;(5)氯钌酸铵分解生成钌单质和一种无毒的气体单质该气体为氮气,同时有两种化合物生成结合元素守恒及铵盐性质可知为HCl和NH3;结合电子得失守恒及元素守恒得分解方程式为:。
6.锰及其化合物用途广泛,以菱锰矿(主要成分为,还含有铁、镍、钴的碳酸盐以及杂质)为原料生产金属锰和高品位的工艺流程如图1所示。
已知时,部分物质的溶度积常数如表所示:
(1)“溶浸”时,锰的浸出率与浸出时间的关系如图2所示。由图可知,所采用的最佳实验条件(温度、时间)为_______。
(2)主要用于氧化_______。滤渣1中残余的可加入葡萄糖-硫酸溶液处理,回收,氧化产物为,写出反应的离子方程式:_______。
(3)滤渣3的主要成分为_______(填化学式,其中、均为价)。
(4)“沉锰”时除了作沉淀剂外,还有_______作用;“沉锰”的关键操作有两点:①将溶液加入溶液中;②反应终点溶液。如果①中颠倒试剂滴加顺序(反应大于7),可能造成的后果是_______;若反应终点溶液小于7,可能的后果是_______。
(5)以作电极,溶液为电解液,经过一系列步骤制得隐形战机涂料,则电解时阳极生成的电极总反应式为_______。
【答案】(1)、 (2) (葡萄糖)
(3) (4) 结合电离出的,促进沉淀(或调) 可能产生沉淀等,导致纯度降低 可能溶解,导致产率降低
(5)
【解析】菱锰矿(主要成分为,还含有铁、镍、钴的碳酸盐以及杂质)中加入硫酸进行溶浸,可以发生反应生成硫酸盐,向其中加入具有氧化性的MnO2,可以将Fe2+氧化为Fe3+,滤渣1为SiO2和过量的MnO2;向滤液中加入氨水调节pH=5将Fe3+以Fe(OH)3沉淀下来,滤渣2为Fe(OH)3;向滤液中加入MnS,可以将Ni2+、C2+形成CS和NiS沉淀下来,滤渣3为过量的MnS、CS和NiS;向MnSO4溶液中加入NH4HCO3溶液,调整溶液pH=7,使Mn2+形成MnCO3沉淀,最后对得到的含有Mn2+的盐电解,可以得到金属锰,据此解答。(1)物质的浸出率越高,反应消耗的时间越短,反应要求的温度越低,反应条件越佳。根据图2可知,所采用的最佳实验条件是温度,浸出时间;(2)由分析可知主要用于氧化Fe2+;滤渣1中残余的MnO2可加入葡萄糖一硫酸溶液处理,MnO2被还原为Mn2+,葡萄糖氧化产物为CO2。根据电子守恒、电荷守恒、原子守恒,可得对应的离子方程式为:C6H12O6(葡萄糖)+12MnO2+24H+=12Mn2++6CO2↑+18H2O;(3)根据上述分析可知:在滤渣3中含有;(4)“沉锰”时NH4HCO3除了作沉淀剂外,还有就是结合电离出的H+,促进MnCO3沉淀(或调pH);“沉锰”的关键操作有两点:①将NH4HCO3溶液加入MnSO4溶液中;②反应终点pH在7附近。如果①中颠倒试剂滴加顺序(反应pH大于7),可能造成的后果是可能产生Mn(OH)2沉淀等,造成MnCO3纯度降低;若反应终点pH低于7,MnCO3可能溶解,可能造成的后果是产品的产率降低;(5)以作电极,溶液为电解质溶液,电解时阳极失去电子,与溶液中的结合生成,同时产生,故阳极的电极总反应式为。
7.硫酸锰是一种重要的化工中间体。一种以高硫锰矿(主要成分为含锰化合物及)与氧化锰矿(主要成分为等锰的氧化物)为原料制备硫酸锰的工艺流程如下:
已知:①“混合焙烧”后烧渣含及少量。
②金属离子在水溶液中沉淀的范围如下表所示():
③离子浓度时,离子沉淀完全。
(1)“混合焙烧”的主要目的是_______。
(2)若试剂a为,则氧化步骤发生反应的离子方程式为_______,若省略“氧化”步骤,造成的影响是_______。
(3)“中和除杂”时,应控制溶液的范围是_______。
(4)“氟化除杂”后,溶液中浓度为。则溶液中_______[已知:;]。
(5)“碳化结晶”时发生反应的离子方程式为_______。
【答案】(1)价的将价的还原为,便于“浸出”
(2) 完全沉淀时已经完全沉淀,造成损失(或影响产品纯度) (3) (4) (5)
【解析】(1)混合焙烧的主要目的是:价的将价的还原为,便于“浸出”;(2)若试剂a为,将氧化为,反应的离子方程式为:;若不氧化,完全沉淀时已经完全沉淀,造成损失(或影响产品纯度);(3)调节是将和完全沉淀,不沉淀,所以调节范围是:;(4)氧化除杂后,溶液中。则溶液中;(5)碳化结晶是用将沉淀,发生反应的离子方程式为。
8.氧化钪(Sc2O3)是一种稀土氧化物,广泛应用于航天、激光、导弹等尖端科学领域。以钪锰矿石(主要含MnO2、SiO2及少量Sc2O3、Al2O3、CaO、FeO)为原料制备Sc2O3和三氯化钪(ScCl3)的工艺流程如图,其中TBP和P507均为有机萃取剂。
回答下列问题:
(1)“溶解”时铁屑被氧化为,该反应的离子方程式是_______。
(2)“滤渣”的主要成分是_______。
(3)有机萃取剂P507萃取的反应原理为阳离子交换:(HR代表)。在“富钪有机相”中反应生成的化学方程式是_______。
(4)“萃余液2”中的金属阳离子除、外,还有_______。
(5)沉钪后获得的操作Ⅰ为_______。
(6)取粗产品(含难溶杂质)溶于水,配成溶液,采用为指示剂,用标准溶液滴定,当溶液中出现_______现象时,说明已达到滴定终点。当溶液中恰好沉淀完全(浓度等于)时,此时溶液中_______。[已知:为砖红色固体;,]
【答案】(1)3MnO2+2Fe+12H+=3Mn2++2Fe3++6H2O (2)CaSO4和SiO2 (3)ScR3+3NaOH=3NaR+Sc(OH)3↓
(4)Mn2+ (5)灼烧 (6) 产生砖红色沉淀且30s内沉淀不消失 0.005
【解析】钪锰矿石(主要含MnO2、SiO2及少量Sc2O3、Al2O3、CaO、FeO)加入稀硫酸后,溶液中含有A13+、Fe2+、Ca2+、Sc3+再加入Fe,可以将二氧化锰还原为Mn2+,铁被氧化成Fe3+,滤渣中含有SiO2,TBP和HCl加入可以除去Fe3+,得到有机相和萃余液1,萃余液1加入有机萃取剂P507萃取Sc3+,萃余液2中剩余Al3+、Ca2+、Mn2+ ,富钪有机相加入氢氧化钠后得到反萃固体Sc (OH)3,加入HCl得到ScCl3,加入H2C2O4后得到Sc2 (C2O4)3,在空气中灼烧后Sc2O3。据此作答。(1)“溶解”时铁屑被MnO2氧化为Fe3+,MnO2还原Mn2+,溶液为酸性,有氢离子参与反应,根据元素守恒补齐生成物水,反应的离子方程式:3MnO2+2Fe+12H+=3Mn2++2Fe3++6H2O;(2)钪锰矿石中不与硫酸和废铁屑反应的物质为二氧化硅,以及钙离子与硫酸根离子作用产生微溶的CaSO4,“ 滤渣”的主要成分是CaSO4和SiO2;(3)在“富钪有机相”中反应生成Sc(OH)3,ScR3与氢氧化钠反应生成Sc(OH)3,化学方程式是ScR3+3NaOH=3NaR+Sc(OH)3↓;(4)根据分析可知,萃余液2中剩余Al3+、Ca2+、Mn2+ ;(5)加入HCl得到ScCl3,加入H2C2O4后得到Sc2 (C2O4)3,在空气中灼烧后Sc2O3,故操作Ⅰ为灼烧;(6)用AgNO3标准溶液滴定,当溶液中出现产生砖红色沉淀且30s内沉淀不消失现象时,说明已达到滴定终点;液中Cl-恰好沉淀完全(浓度等于1.0×10-5ml·L-1)时,K(AgCl)= c(Ag+)c(Cl-)= c(Ag+)1.0×10-5ml·L-1=2.0×10-10,c(Ag+)=2.0×10-5ml·L-1,K(Ag2CrO4)= c2(Ag+)c()=(2.0×10-5ml·L-1)2c()=2.0×10-12;此时溶液中c()=0.005ml·L-1。
9.铟是一种稀有贵金属,广泛应用于航空航天、太阳能电池等高科技领域。从铜烟灰酸浸渣(主要含PbO、FeAsO4·2H2O、In2O3)中提取铟和铅的工艺流程如下:
已知:①焙烧后金属元素均以硫酸盐的形式存在;
②In(OH)3性质与Al(OH)3类似。
回答下列问题:
(1)FeAsO4·2H2O中铁元素化合价为_______。
(2)生成PbO粗品的化学反应方程式为_______。
(3)PbO在NaOH溶液中溶解度曲线如图所示,PbO粗品中的杂质难溶于NaOH溶液。结合溶解度曲线,简述提纯PbO粗品的操作_______。
(4)“还原铁”反应的离子方程式为________
(5)“萃取除铁”中,发现当溶液pH>1.5后,钢萃取率随pH的升高而下降,原因是_______
(6)为测定PbO产品的纯度,探究小组同学准确称取PbO1.161g,加入稀硝酸使其完全溶解,再加入蒸馏水配制成50.00mL溶液:冷却至25℃,用0.100ml·L-1H2SO4滴定该溶液,滴定曲线如图所示。
已知:;a点的坐标为(50,3.8)
①25℃,PbSO4的Ksp=_______。
②PbO产品的纯度为_______。
【答案】(1)+3 (2) (3)将粗PbO溶解在35%NaOH溶液中,配成高温下的饱和溶液,趁热过滤,降温结晶、过滤,洗涤干燥 (4) (5)铟离子发生水解,导致铟萃取率下降 (6) 10-7.6 96%
【解析】从铜烟灰酸浸渣(主要含PbO、FeAsO4·2H2O、In2O3)中提取铟和铅,铜烟灰酸浸渣加入硫酸溶液硫酸化、焙烧后得到的焙砂,再加水水浸,浸渣加入10%氢氧化钠溶液加热处理后冷却、过滤,得到滤液和PbO粗品,经处理得到PbO;水浸液加硫代硫酸钠还原铁,再加入萃取剂萃取出含有亚铁离子和的水溶液,除铁后的有机相中加硫酸溶液反应萃取去掉萃余液,一系列处理得到粗铟。(1)FeAsO4·2H2O中O元素的化合价为-2价,As元素的化合价为+5价,根据化合物的化合价代数和为0,则 铁元素化合价为+3价;(2)水浸后的硫酸铅与氢氧化钠反应生成PbO粗品和硫酸钠,反应的化学反应方程式为;(3)根据PbO在NaOH溶液中溶解度曲线,PbO粗品中的杂质难溶于NaOH溶液,结合溶解度曲线,可知,氢氧化钠浓度较大时PbO溶液度较大,提纯PbO粗品的操作为将粗PbO溶解在35%NaOH溶液中,配成高温下的饱和溶液,趁热过滤,降温结晶、过滤,洗涤干燥;(4)“还原铁”是利用硫代硫酸钠将铁离子氧化为亚铁离子,反应的离子方程式为;(5)“萃取除铁”中,发现当溶液pH>1.5后,钢萃取率随pH的升高而下降,原因是铟离子发生水解,导致铟萃取率下降;(6)根据图像,加入50mLH2SO4时,沉淀完全,-lgc(Pb2+)=3.8,则c(Pb2+)=10-3.8ml/L,根据反应,则c(Pb2+)=c(),25℃,PbSO4的Ksp(PbSO4)= c(Pb2+)·c()=10-3.8ml/L10-3.8ml/L=10-7.6ml2/L2;②加入50.00mL 0.100ml/LH2SO4与Pb2+恰好完全反应,,n(Pb2+)=n()=0.100ml/L0.05L=0.005ml,根据原子守恒n(PbO)=n(Pb2+)=0.005ml,PbO的质量m=nM=0.005ml223g/ml=1.115g,PbO产品的纯度为。
10.碳酸锶()难溶于水,主要用于电磁材料和金属冶炼。一种由工业碳酸锶(含少量等)制备高纯碳酸锶的工艺流程如图所示。
已知:I.为两性氢氧化物;
II.常温下,各物质的溶度积常数如表所示。
回答下列问题:
(1)气体A的电子式为_______。
(2)“沉钡、铅”时,溶液过低会导致的利用率降低,原因是_______(结合化学用语解释);“还原”时发生反应的离子方程式为_______。
(3)滤渣1的主要成分为_______(填化学式)。
(4)用氨水和分步调节溶液,而不是直接调节溶液的的原因为_______。
(5)“调”后需对溶液进行煮沸并趁热过滤出滤渣2,煮沸并趁热过滤的原因为_______。
(6)已知:碳酸的电离常数、,则“碳化”时,反应的平衡常数____(结果保留3位有效数字)。
(7)“系列操作”中,将结晶过滤后,不经洗涤,直接以热风烘干,便可得到高纯,故“系列操作”烘干过程中除蒸发水外,还能够除去中的微量可溶性杂质,微量杂质除外还可能为_______(填化学式)。
【答案】(1)(2) 溶液中存在,溶液过低,浓度过大,平衡正向移动,更多的转化为,导致的利用率降低 (3) (4)溶液过大会使溶解,导致铬的去除率降低 (5)的溶解度随着温度的升高而降低,煮沸并趁热过滤有利于除尽溶液中的
(6) (7)
【解析】工业碳酸锶(含少量Ba2+、Ca2+、Mg2+、Pb2+等)加硝酸进行“酸溶”,碳酸锶和硝酸反应生成硝酸锶、水和二氧化碳,气体A为CO2,得到含Sr2+、Ba2+、Ca2+、Mg2+、Pb2+的溶液,向溶液中加入过量的(NH4)2CrO4进行“沉钡、铅”,过滤得到含Sr2+、Ca2+、Mg2+、、的溶液,对溶液进行酸化、加草酸进行还原,被还原为Cr3+,得到含Sr2+、Ca2+、Mg2+、、Cr3+的溶液,向溶液中加氨水调pH到7~8,将Cr3+转化为沉淀除去,滤渣1为Cr(OH)3,再加NaOH调pH≈13使Ca2+、Mg2+沉淀,过滤后碳化,Sr2+转化为SrCO3,再经过“系列操作”得到高纯SrCO3。(1)气体A为CO2,其电子式为;(2)溶液中存在,溶液过低,浓度过大,平衡正向移动,更多的转化为,导致的利用率降低;结合流程和分析来看“还原”时草酸和铬酸根离子发生氧化还原反应,发生反应的离子方程式为8H++Cr2O+3H2C2O4= 2Cr3++6CO2↑+7H2O;(3)由分析可知“滤渣1”的主要成分为Cr(OH)3;(4)Cr(OH)3是两性氢氧化物,pH过大Cr(OH)3会溶解,故用氨水和NaOH分步调节pH,而不是直接调节溶液的pH≈13的原因为溶液过大会使溶解,导致铬的去除率降低;(5)“调pH ≈13”主要是使镁离子、钙离子沉淀,“调pH ≈13”后需对溶液进行煮沸并趁热过滤的原因为Ca(OH)2的溶解度随着温度的升高而降低,煮沸并趁热过滤有利于除尽溶液中的Ca2+;(6)的平衡常数;(7)由于“酸化”阶段加入的硝酸根离子在流程中没有被除去,加之“系列操作”前加入了铵根离子,故“系列操作”烘干过程中除蒸发水外,还能够除去中的微量可溶性杂质,该杂质除外还可能为。金属阳离子
完全沉淀时的pH
3.2
5.2
10.4
12.4
金属离子
a
b
不溶于硫酸等
溶于酸
—
溶于酸
溶于酸
物质
物质
开始沉淀的
1.9
7.6
7.3
3.0
完全沉淀的
3.2
9.6
9.3
5.2
化合物
近似值
高考化学二轮复习讲练测(新高考专用)专题13工艺流程综合题(讲)(原卷版+解析): 这是一份高考化学二轮复习讲练测(新高考专用)专题13工艺流程综合题(讲)(原卷版+解析),共45页。试卷主要包含了原料的预处理,转化过程中反应条件的控制方法,工艺流程中的分离与提纯,工艺流程中Ksp的相关计算等内容,欢迎下载使用。
高考化学二轮复习讲练测(新高考专用)专题13工艺流程综合题(练)(原卷版+解析): 这是一份高考化学二轮复习讲练测(新高考专用)专题13工艺流程综合题(练)(原卷版+解析),共63页。试卷主要包含了工业废渣中的综合利用等内容,欢迎下载使用。
高考化学二轮复习讲练测(新高考专用)专题13工艺流程综合题(测)(原卷版+解析): 这是一份高考化学二轮复习讲练测(新高考专用)专题13工艺流程综合题(测)(原卷版+解析),共28页。试卷主要包含了8),24等内容,欢迎下载使用。












