

新高考化学二轮复习讲练测专题17 有机推断与合成路线(讲)(解析版)
展开1.有机化合物的组成与结构:(1)能根据有机化合物的元素含量、相对分子质量确定有机化合物的分子式;(2)了解常见有机化合物的结构;了解有机化合物分子中的官能团,能正确地表示它们的结构;(3)了解确定有机化合物结构的化学方法和物理方法(如质谱、红外光谱、核磁共振氢谱等);(4)能正确书写有机化合物的同分异构体(不包括手性异构体);(5)能够正确命名简单的有机化合物;(6)了解有机分子中官能团之间的相互影响。
2.烃及其衍生物的性质与应用:(1)掌握烷、烯、炔和芳香烃的结构与性质;(2)掌握卤代烃、醇、酚、醛、羧酸、酯的结构与性质,以及它们之间的相互转化;(3)了解烃类及衍生物的重要应用以及烃的衍生物的合成方法;(4)根据信息能设计有机化合物的合成路线。
3.糖类、氨基酸和蛋白质:(1)了解糖类、氨基酸和蛋白质的组成、结构特点、主要化学性质及应用;(2)了解糖类、氨基酸和蛋白质在生命过程中的作用。4.合成高分子:(1)了解合成高分子的组成与结构特点;能依据简单合成高分子的结构分析其链节和单体;(2)了解加聚反应和缩聚反应的含义;(3)了解合成高分子在高新技术领域的应用以及在发展经济、提高生活质量方面中的贡献。
高频考点一 常见有机物及官能团的主要性质
高频考点二 合成路线的分析与设计
1.有机合成中官能团的转变
(1)官能团的引入(或转化)
(2)官能团的消除
①消除双键:加成反应。
②消除羟基:消去、氧化、酯化反应。
③消除醛基:还原和氧化反应。
(3)官能团的保护
2.增长碳链或缩短碳链的方法
3.常见有机物转化应用举例
(1)
(2)
(3)
(4)CH3CHOeq \(―――――→,\s\up7(NaOH稀溶液))eq \(――→,\s\up11(浓硫酸),\s\d4(△))
4.有机合成路线设计的几种常见类型
根据目标分子与原料分子在碳骨架和官能团两方面变化的特点,我们将合成路线的设计分为
(1)以熟悉官能团的转化为主型
如:以CH2===CHCH3为主要原料(无机试剂任用)设计CH3CH(OH)COOH的合成路线流程图(须注明反应条件)。
CH2===CHCH3eq \(――→,\s\up7(Cl2))eq \(―――→,\s\up11(NaOH/H2O),\s\d4(△))eq \(――→,\s\up11(O2/Cu),\s\d4(△))eq \(――→,\s\up11(O2),\s\d4(催化剂))eq \(――→,\s\up11(H2/Ni),\s\d4(△))
(2)以分子骨架变化为主型
如:请以苯甲醛和乙醇为原料设计苯乙酸乙酯()的合成路线流程图(注明反应条件)。
提示:R—Br+NaCN―→R—CN+NaBr
eq \(――――→,\s\up11(H2),\s\d4(催化剂,△))eq \(――→,\s\up7(HBr))eq \(――→,\s\up7(NaCN))eq \(――→,\s\up7(H3O+))
eq \(―――――→,\s\up11(CH3CH2OH),\s\d4(浓硫酸,△))
(3)陌生官能团兼有骨架显著变化型(常为考查的重点)
要注意模仿题干中的变化,找到相似点,完成陌生官能团及骨架的变化。如:模仿
eq \(――→,\s\up7(CH3NO2))eq \(――→,\s\up11(浓硫酸),\s\d4(△))eq \(――→,\s\up7(H2))eq \(――→,\s\up11(Zn—Hg),\s\d4(HCl))
香兰素 A B C
eq \(――→,\s\up7(一定条件))
D 多巴胺
设计以苯甲醇、硝基甲烷为主要原料制备苯乙胺()的合成路线流程图。
关键是找到原流程中与新合成路线中的相似点。(碳架的变化、官能团的变化;硝基引入及转化为氨基的过程)
eq \(――→,\s\up11(O2/Cu),\s\d4(△))eq \(――→,\s\up7(CH3NO2))eq \(――→,\s\up11(浓硫酸),\s\d4(△))eq \(――→,\s\up7(H2))
eq \(――→,\s\up11(Zn—Hg),\s\d4(HCl))
高频考点二 有机合成与推断
1.根据反应条件推断反应物或生成物
(1)“光照”为烷烃的卤代反应。
(2)“NaOH水溶液、加热”为R—X的水解反应,或酯()的水解反应。
(3)“NaOH醇溶液、加热”为R—X的消去反应。
(4)“HNO3(浓H2SO4)”为苯环上的硝化反应。
(5)“浓H2SO4、加热”为R—OH的消去或酯化反应。
(6)“浓H2SO4、170 ℃”是乙醇消去反应的条件。
2.根据有机反应的特殊现象推断有机物的官能团
(1)使溴水褪色,则表示该物质中可能含有碳碳双键、碳碳三键或醛基。
(2)使酸性KMnO4溶液褪色,则该物质中可能含有碳碳双键、碳碳三键、醛基或苯的同系物(侧链烃基中与苯环直接相连的碳原子上必须含有氢原子)。
(3)遇FeCl3溶液显紫色或加入浓溴水出现白色沉淀,表示该物质分子中含有酚羟基。
(4)加入新制Cu(OH)2悬浊液并加热,有砖红色沉淀生成(或加入银氨溶液并水浴加热有银镜出现),表示该物质中含有—CHO。
(5)加入金属钠,有H2产生,表示该物质分子中可能有—OH 或—COOH。
(6)加入NaHCO3溶液有气体放出,表示该物质分子中含有—COOH。
3.以特征产物为突破口来推断碳架结构和官能团的位置
(1)醇的氧化产物与结构的关系
(2)由消去反应的产物可确定“—OH”或“—X”的位置。
(3)由取代产物的种类或氢原子环境可确定碳架结构。有机物取代产物越少或相同环境的氢原子数越多,说明该有机物结构的对称性越高,因此可由取代产物的种类或氢原子环境联想到该有机物碳架结构的对称性而快速进行解题。
(4)由加氢后的碳架结构可确定碳碳双键或碳碳三键的位置。
(5)由有机物发生酯化反应能生成环酯或高聚酯,可确定该有机物是含羟基的羧酸;根据酯的结构,可确定 —OH与—COOH的相对位置。
4.根据关键数据推断官能团的数目
(1)—CHO eq \b\lc\{\rc\ (\a\vs4\al\c1(\(――――→,\s\up7(2[AgNH32]+))2Ag,\(――――→,\s\up7(2CuOH2))Cu2O));
(2)2—OH(醇、酚、羧酸)eq \(――→,\s\up7(2Na))H2;
(3)2—COOHeq \(――→,\s\up7(Na2CO3))CO2,—COOHeq \(――→,\s\up7(NaHCO3))CO2;
(4)eq \(――→,\s\up7(Br2)) eq \(――→,\s\up7(消去)) —C≡C— eq \(――→,\s\up7(2Br2));
(5)RCH2OHeq \(――――→,\s\up11(CH3COOH),\s\d4(酯化))CH3COOCH2R。
(Mr) (Mr+42)
5.根据新信息类推
高考常见的新信息反应总结如下
(1)丙烯αH被取代的反应:CH3—CH===CH2+Cl2eq \(――→,\s\up7(△))Cl—CH2—CH===CH2+HCl。
(2)共轭二烯烃的1,4加成反应:
①CH2===CH—CH===CH2+Br2―→;
②。
(3)烯烃被O3氧化:R—CH===CH2eq \(――→,\s\up11(①O3),\s\d4(②Zn))R—CHO+HCHO。
(4)苯环侧链的烃基(与苯环相连的碳原子上含有氢原子)被酸性KMnO4溶液氧化:
eq \(――→,\s\up11(KMnO4),\s\d4(H+))。
(5)苯环上的硝基被还原:eq \(――→,\s\up7(Fe,HCl))。
(6)醛、酮的加成反应(加长碳链,—CN水解得—COOH):
①CH3CHO+HCN―→;
②+HCNeq \(――→,\s\up7(催化剂));
③CH3CHO+NH3eq \(――→,\s\up7(催化剂))
(作用:制备胺);
④CH3CHO+CH3OHeq \(――→,\s\up7(催化剂))
(作用:制半缩醛)。
(7)羟醛缩合:+eq \(――→,\s\up7(催化剂))。
(8)醛或酮与格氏试剂(R′MgX)发生加成反应,所得产物经水解可得醇:
+R′MgX―→eq \(――→,\s\up7(水解))。
(9)羧酸分子中的αH被取代的反应:
RCH2COOH+Cl2eq \(――→,\s\up7(催化剂))+HCl。
(10)羧酸用LiAlH4还原时,可生成相应的醇:
RCOOHeq \(――→,\s\up7(LiAlH4))RCH2OH。
(11)酯交换反应(酯的醇解):
R1COOR2+R3OH―→R1COOR3+R2OH。
题型一 有机推断综合
例1. (2022·北京卷)碘番酸可用于X射线的口服造影液,其合成路线如图所示。
已知:R-COOH+R’-COOH+H2O
(1)A可发生银镜反应,其官能团为___________。
(2)B无支链,B的名称为___________;B的一种同分异构体中只有一种环境氢,其结构简式为___________。
(3)E是芳香族化合物,的方程式为___________。
(4)G中有乙基,则G的结构简式为___________。
(5)碘番酸中的碘在苯环不相邻的碳原了上,碘番酸的相对分了质量为571,J的相对分了质量为193。则碘番酸的结构简式为___________。
(6)通过滴定法来确定口服造影液中碘番酸的质量分数。
第一步 取样品,加入过量粉,溶液后加热,将I元素全部转为,冷却,洗涤。
第二步 调节溶液,用溶液滴定至终点,用去。已知口服造影液中无其他含碘物质,则碘番酸质量分数为___________。
【变式探究】(2022·山东卷)支气管扩张药物特布他林(H)的一种合成路线如下:
已知:
Ⅰ.
Ⅱ.、
Ⅲ.
回答下列问题:
(1)A→B反应条件为_______;B中含氧官能团有_______种。
(2)B→C反应类型为_______,该反应的目的是_______。
(3)D结构简式为_______;E→F的化学方程式为_______。
(4)H的同分异构体中,仅含有、和苯环结构的有_______种。
(5)根据上述信息,写出以羟基邻苯二甲酸二乙酯为主要原料制备合成的路线_______。
题型二 有机合成综合
例2. (2022·湖北卷)化合物F是制备某种改善睡眠药物的中间体,其合成路线如下:
回答下列问题:
(1)的反应类型是___________。
(2)化合物B核磁共振氢谱的吸收峰有___________组。
(3)化合物C的结构简式为___________。
(4)的过程中,被还原的官能团是___________,被氧化的官能团是___________。
(5)若只考虑氟的位置异构,则化合物F的同分异构体有___________种。
(6)已知、和的产率分别为70%、82%和80%,则的总产率为___________。
(7)配合物可催化转化中键断裂,也能催化反应①:
反应①:
为探究有机小分子催化反应①的可能性,甲、乙两个研究小组分别合成了有机小分子(结构如下图所示)。在合成的过程中,甲组使用了催化剂,并在纯化过程中用沉淀剂除;乙组未使用金属催化剂。研究结果显示,只有甲组得到的产品能催化反应①。
根据上述信息,甲、乙两组合成的产品催化性能出现差异的原因是___________。
【变式探究】6.(2022·辽宁卷)某药物成分H具有抗炎、抗病毒、抗氧化等生物活性,其合成路线如下:
已知:
回答下列问题:
(1)A的分子式为___________。
(2)在溶液中,苯酚与反应的化学方程式为___________。
(3)中对应碳原子杂化方式由___________变为___________,的作用为___________。
(4)中步骤ⅱ实现了由___________到___________的转化(填官能团名称)。
(5)I的结构简式为___________。
(6)化合物I的同分异构体满足以下条件的有___________种(不考虑立体异构);
i.含苯环且苯环上只有一个取代基
ii.红外光谱无醚键吸收峰
其中,苯环侧链上有3种不同化学环境的氢原子,且个数比为6∶2∶1的结构简式为___________(任写一种)。
题型三 考查有机合成路线
例3. (2022·广东卷)基于生物质资源开发常见的化工原料,是绿色化学的重要研究方向。以化合物I为原料,可合成丙烯酸V、丙醇VII等化工产品,进而可制备聚丙烯酸丙酯类高分子材料。
(1)化合物I的分子式为_______,其环上的取代基是_______(写名称)。
(2)已知化合物II也能以II′的形式存在。根据II′的结构特征,分析预测其可能的化学性质,参考①的示例,完成下表。
(3)化合物IV能溶于水,其原因是_______。
(4)化合物IV到化合物V的反应是原子利用率的反应,且与化合物a反应得到,则化合物a为_______。
(5)化合物VI有多种同分异构体,其中含结构的有_______种,核磁共振氢谱图上只有一组峰的结构简式为_______。
(6)选用含二个羧基的化合物作为唯一的含氧有机原料,参考上述信息,制备高分子化合物VIII的单体。
写出VIII的单体的合成路线_______(不用注明反应条件)。
【变式探究】(2022·海南卷)黄酮哌酯是一种解痉药,可通过如下路线合成:
回答问题:
(1)A→B的反应类型为_______。
(2)已知B为一元强酸,室温下B与NaOH溶液反应的化学方程式为_______。
(3)C的化学名称为_______,D的结构简式为_______。
(4)E和F可用_______(写出试剂)鉴别。
(5)X是F的分异构体,符合下列条件。X可能的结构简式为_______(任马一种)。
①含有酯基 ②含有苯环 ③核磁共振氢谱有两组峰
(6)已知酸酐能与羟基化合物反应生成酯。写出下列F→G反应方程式中M和N的结构简式_______、_______。
(7)设计以为原料合成路线_______(其他试剂任选)。已知:+CO2
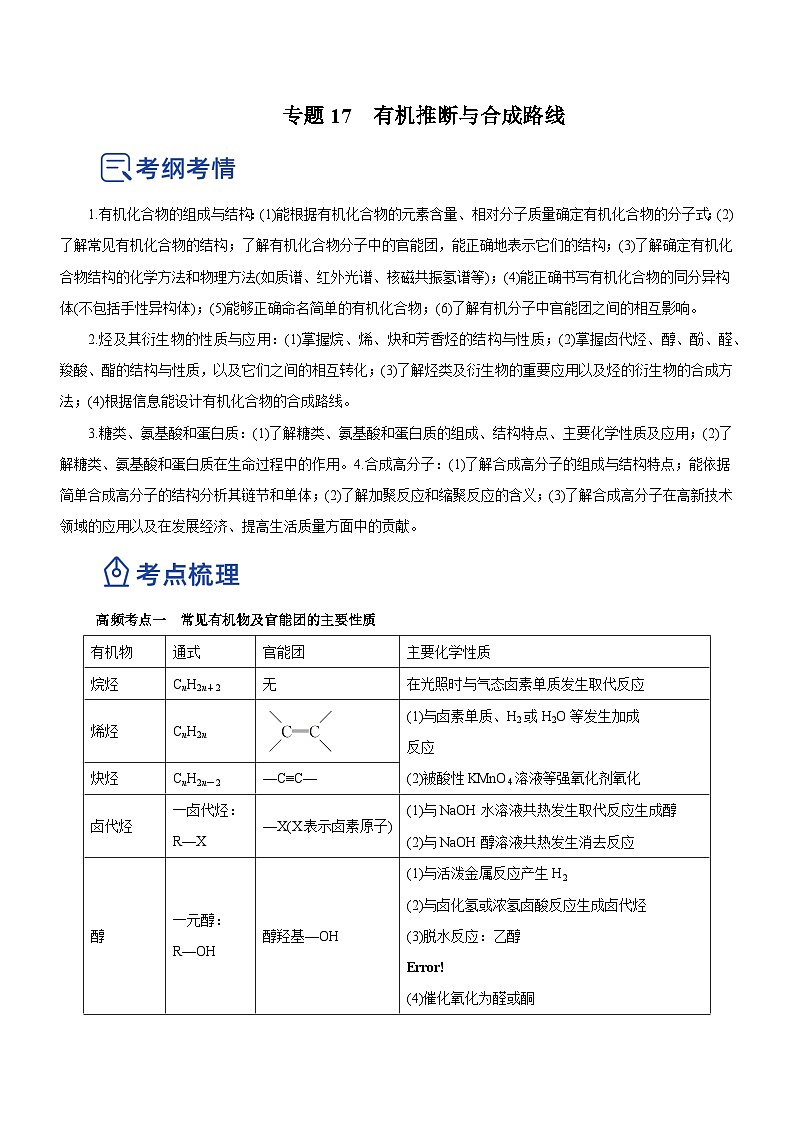
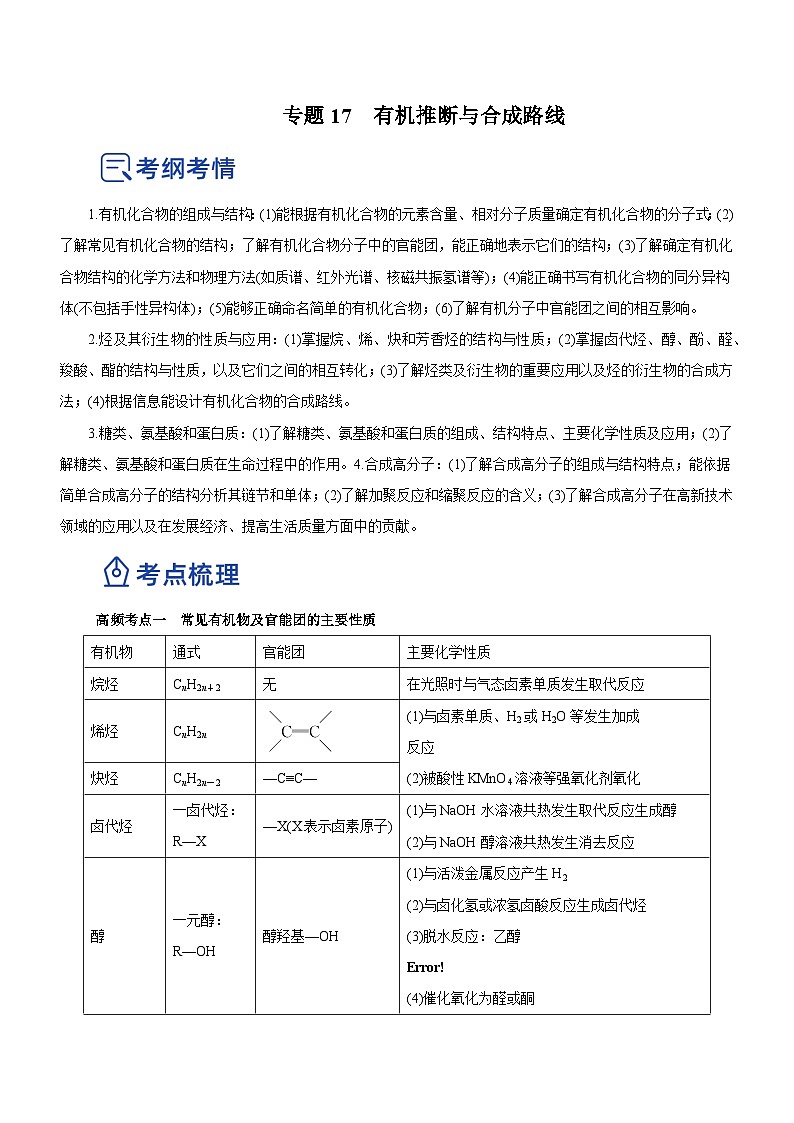
有机物
通式
官能团
主要化学性质
烷烃
CnH2n+2
无
在光照时与气态卤素单质发生取代反应
烯烃
CnH2n
(1)与卤素单质、H2或H2O等发生加成
反应
(2)被酸性KMnO4溶液等强氧化剂氧化
炔烃
CnH2n-2
—C≡C—
卤代烃
一卤代烃:R—X
—X(X表示卤素原子)
(1)与NaOH水溶液共热发生取代反应生成醇
(2)与NaOH醇溶液共热发生消去反应
醇
一元醇:R—OH
醇羟基—OH
(1)与活泼金属反应产生H2
(2)与卤化氢或浓氢卤酸反应生成卤代烃
(3)脱水反应:乙醇
eq \b\lc\{\rc\ (\a\vs4\al\c1(140 ℃分子间脱水生成醚,170 ℃分子内脱水生成烯))
(4)催化氧化为醛或酮
(5)与羧酸或无机含氧酸反应生成酯
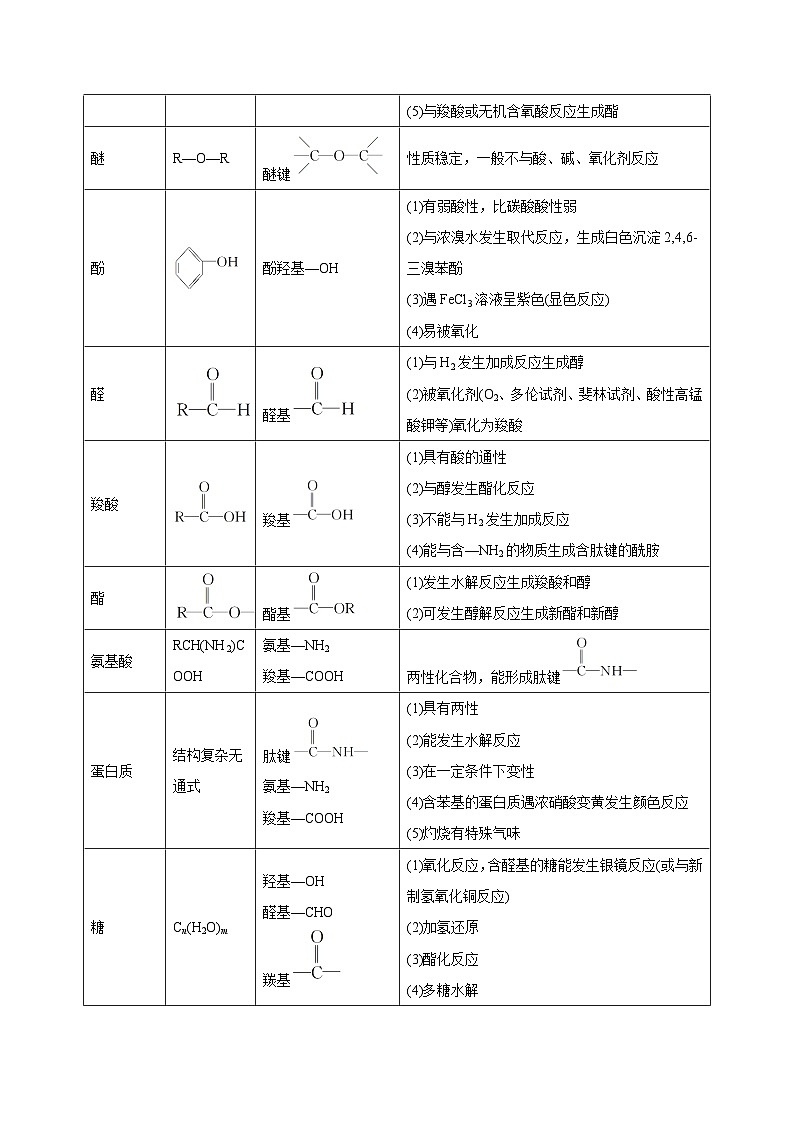
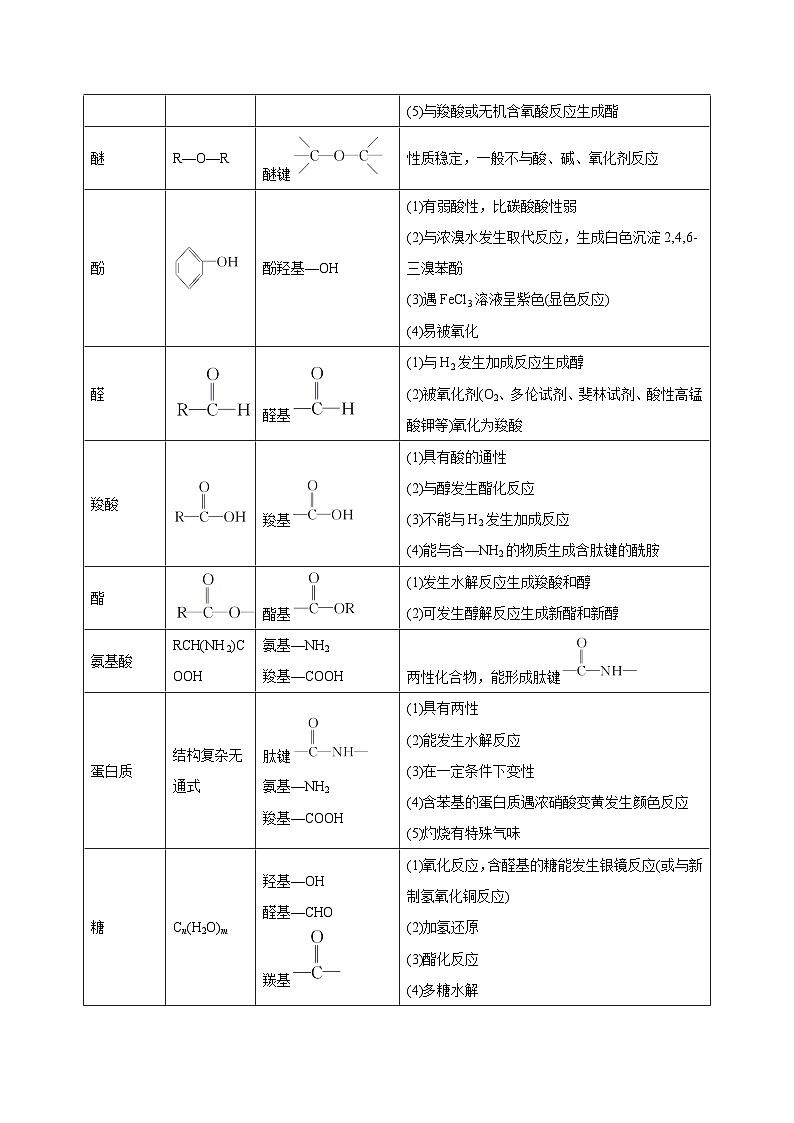
醚
R—O—R
醚键
性质稳定,一般不与酸、碱、氧化剂反应
酚
酚羟基—OH
(1)有弱酸性,比碳酸酸性弱
(2)与浓溴水发生取代反应,生成白色沉淀2,4,6三溴苯酚
(3)遇FeCl3溶液呈紫色(显色反应)
(4)易被氧化
醛
醛基
(1)与H2发生加成反应生成醇
(2)被氧化剂(O2、多伦试剂、斐林试剂、酸性高锰酸钾等)氧化为羧酸
羧酸
羧基
(1)具有酸的通性
(2)与醇发生酯化反应
(3)不能与H2发生加成反应
(4)能与含—NH2的物质生成含肽键的酰胺
酯
酯基
(1)发生水解反应生成羧酸和醇
(2)可发生醇解反应生成新酯和新醇
氨基酸
RCH(NH2)COOH
氨基—NH2
羧基—COOH
两性化合物,能形成肽键
蛋白质
结构复杂无通式
肽键
氨基—NH2
羧基—COOH
(1)具有两性
(2)能发生水解反应
(3)在一定条件下变性
(4)含苯基的蛋白质遇浓硝酸变黄发生颜色反应
(5)灼烧有特殊气味
糖
Cn(H2O)m
羟基—OH
醛基—CHO
羰基
(1)氧化反应,含醛基的糖能发生银镜反应(或与新制氢氧化铜反应)
(2)加氢还原
(3)酯化反应
(4)多糖水解
(5)葡萄糖发酵分解生成乙醇
油脂
酯基
(1)水解反应(在碱性溶液中的水解称为皂化反应)
(2)硬化反应
官能团
的引入
—OH
+H2O;R—X+H2O;R—CHO+H2;RCOR′+H2;R—COOR′+H2O;多糖水解
—X
烷烃+X2;烯(炔)烃+X2或HX;R—OH+HX
R—OH和R—X的消去;炔烃不完全加成
—CHO
某些醇氧化;烯烃氧化;炔烃水化;糖类水解
—COOH
R—CHO+O2;苯的同系物被强氧化剂氧化;羧酸盐酸化;R—COOR′+H2O
—COO—
酯化反应
被保护的
官能团
被保护的官能团性质
保护方法
酚羟基
易被氧气、臭氧、双氧水、酸性高锰酸钾溶液氧化
①用NaOH溶液先转化为酚钠,后酸化重新转化为酚:eq \(,\s\up11(NaOH溶液),\s\d4(H+))
②用碘甲烷先转化为苯甲醚,后用氢碘酸酸化重新转化为酚:eq \(,\s\up11(CH3I),\s\d4(HI))
氨基
易被氧气、臭氧、双氧水、酸性高锰酸钾溶液氧化
先用盐酸转化为盐,后用NaOH溶液重新转化为氨基
碳碳双键
易与卤素单质加成,易被氧气、臭氧、双氧水、酸性高锰酸钾溶液氧化
用氯化氢先通过加成转化为氯代物,后用NaOH醇溶液通过消去反应重新转化为碳碳双键
醛基
易被氧化
乙醇(或乙二醇)加成保护:eq \(――――→,\s\up7(CH3CH2OH))eq \(―――→,\s\up7(H+/H2O))
举例
增长碳链
2CH≡CH―→CH2===CH—C≡CH
2R—Cleq \(――→,\s\up7(Na))R—R+2NaCl
CH3CHOeq \(―――――→,\s\up11(CH3CH2MgBr),\s\d4(H+/H2O))
R—Cleq \(――→,\s\up7(HCN))R—CNeq \(――→,\s\up11(H+),\s\d4(H2O))R—COOH
CH3CHOeq \(――→,\s\up7(HCN))eq \(――→,\s\up11(H+),\s\d4(H2O))
nCH2===CH2eq \(――→,\s\up7(催化剂))CH2—CH2
nCH2===CH—CH===CH2eq \(――→,\s\up7(催化剂))
CH2—CH===CH—CH2
2CH3CHOeq \(――――→,\s\up7(NaOH稀溶液))
+R—Cleq \(――→,\s\up7(AlCl3))+HCl
+eq \(――→,\s\up7(AlCl3))+HCl
+eq \(――→,\s\up7(HCl))+(n-1)H2O
缩短碳链
+NaOHeq \(――→,\s\up11(CaO),\s\d4(△))RH+Na2CO3
R1—CH===CH—R2eq \(――→,\s\up11(O3),\s\d4(Zn/H2O))R1CHO+R2CHO
序号
结构特征
可反应的试剂
反应形成的新结构
反应类型
①
加成反应
②
_______
_______
_______
氧化反应
③
_______
_______
_______
_______
新高考化学二轮复习讲练测专题17 有机推断与合成路线(练)(解析版): 这是一份新高考化学二轮复习讲练测专题17 有机推断与合成路线(练)(解析版),文件包含新高考化学二轮复习讲练测专题17有机推断与合成路线练原卷版docx、新高考化学二轮复习讲练测专题17有机推断与合成路线练解析版docx等2份试卷配套教学资源,其中试卷共71页, 欢迎下载使用。
高考化学二轮复习讲练测(新高考专用)专题17有机推断与合成路线(讲)(原卷版+解析): 这是一份高考化学二轮复习讲练测(新高考专用)专题17有机推断与合成路线(讲)(原卷版+解析),共40页。试卷主要包含了有机化合物的组成与结构,烃及其衍生物的性质与应用,糖类、氨基酸和蛋白质,92%等内容,欢迎下载使用。
高考化学二轮复习讲练测(新高考专用)专题17有机推断与合成路线(练)(原卷版+解析): 这是一份高考化学二轮复习讲练测(新高考专用)专题17有机推断与合成路线(练)(原卷版+解析),共71页。












