






所属成套资源:新高考化学一轮复习讲义课件 (含解析)
新高考化学一轮复习讲义课件 第3章 第18讲 常见金属及其化合物的综合应用
展开
这是一份新高考化学一轮复习讲义课件 第3章 第18讲 常见金属及其化合物的综合应用,共60页。PPT课件主要包含了复习目标,课时精练巩固提高,内容索引,一元弱,第二周期ⅢA族,在HCl氛围中加热,阴离子,KSCN溶液,Mg2++,高温焙烧等内容,欢迎下载使用。
1.掌握常见金属元素知识网络构建及重要方程式的书写。2.了解硼及其化合物的性质。
二、知识拓展专题 硼及其化合物的性质
一、知识网络构建及方程式再书写
专项提能特训3 热点金属及其化合物的制备大题
微专题7 热重分析判断物质成分
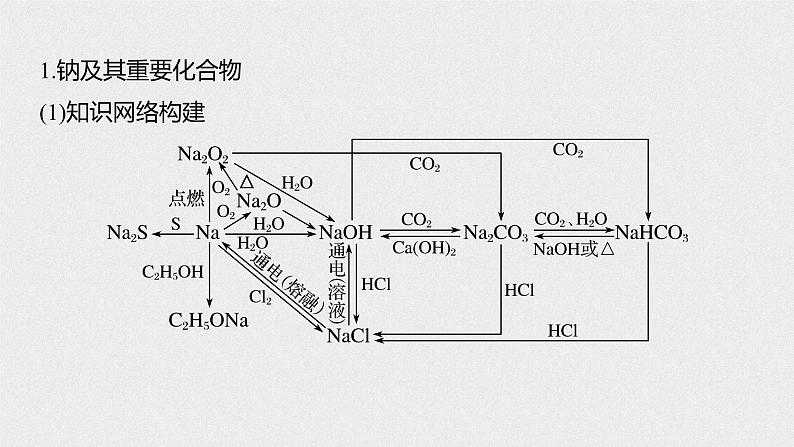
1.钠及其重要化合物(1)知识网络构建
(2)重要反应必练写出下列反应的化学方程式,是离子反应的写出离子方程式。①Na和H2O的反应_______________________________;②Na在空气中燃烧___________________;③Na2O2和H2O的反应__________________________________;
2Na+2H2O===2Na++2OH-+H2↑
2Na2O2+2H2O===4Na++4OH-+O2↑
④Na2O2和CO2的反应____________________________;⑤向NaOH溶液中通入过量CO2___________________;⑥将Na2CO3溶液与石灰乳混合______________________________;⑦向Na2CO3稀溶液中通入过量CO2__________________________;
2Na2O2+2CO2===2Na2CO3+O2
⑧将NaHCO3溶液和NaOH溶液等物质的量混合_________________________;⑨将NaHCO3溶液与澄清石灰水等物质的量混合__________________________________;⑩将NaHCO3溶液与少量澄清石灰水混合___________________________________________。
2.铝及其重要化合物(1)知识网络构建
(2)重要反应必练写出下列反应的离子方程式。①Al和NaOH溶液的反应________________________________;②Al(OH)3和NaOH溶液的反应____________________________;③Al(OH)3和盐酸的反应____________________________;④Al2O3和NaOH的反应__________________________;
Al(OH)3+3H+===Al3++3H2O
⑤Al2O3和盐酸的反应___________________________;⑥NaAlO2和过量盐酸的反应_________________________;⑦向NaAlO2溶液中通入过量CO2气体_____________________________________;⑧将NaAlO2溶液与NaHCO3溶液混合_____________________________________;
Al2O3+6H+===2Al3++3H2O
⑨将NaAlO2溶液与AlCl3溶液混合_______________________________;⑩将AlCl3溶液与NaHCO3溶液混合________________________________。
3.铁及其化合物(1)知识网络构建
(2)重要反应必练写出下列反应的化学方程式,是离子反应的写离子方程式。①Fe和过量稀HNO3的反应___________________________________;②Fe高温下和水蒸气的反应____________________________;③铝与氧化铁的铝热反应__________________________;
④用赤铁矿冶炼铁的原理__________________________;⑤Fe(OH)2长时间露置于空气中_______________________________;⑥FeO和稀HNO3的反应_______________________________________;⑦Fe(OH)3和HI的反应_______________________________________;
4Fe(OH)2+O2+2H2O===4Fe(OH)3
2Fe(OH)3+6H++2I-===2Fe2++I2+6H2O
⑧FeBr2溶液和少量Cl2的反应_________________________;⑨FeBr2溶液和等物质的量的Cl2反应_____________________________________;⑩FeBr2溶液和过量Cl2的反应_____________________________________。
2Fe2++Cl2===2Fe3++2Cl-
2Fe2++2Br-+2Cl2===2Fe3++Br2+4Cl-
2Fe2++4Br-+3Cl2===2Fe3++2Br2+6Cl-
4.铜及其化合物(1)知识网络构建
(2)重要反应必练写出下列反应的化学方程式,是离子反应的写离子方程式。①用两个化学方程式表示Cl2的氧化性大于Sa:__________________;b:__________________。②铜在潮湿的空气中生锈__________________________________。
2Cu+O2+CO2+H2O===Cu2(OH)2CO3
③将Cu和浓H2SO4混合加热_______________________________________。④Cu与浓HNO3的反应_______________________________________。⑤Cu与稀HNO3反应________________________________________。⑥FeCl3溶液腐蚀铜板_________________________。
Cu+2Fe3+===2Fe2++Cu2+
⑦将氨水逐滴滴入CuSO4溶液过程中所发生的反应___________________________________;_______________________________________________。⑧用惰性电极电解CuSO4溶液_________________________________。⑨用Cu作电极电解H2SO4溶液_______________________。⑩胆矾加热分解_____________________________。
Cu(OH)2+4NH3·H2O===[Cu(NH3)4]2++2OH-+4H2O
1.硼硼单质有晶体硼和无定形硼两种,晶体硼相当稳定,无定形硼比较活泼,能发生如下反应:(1)高温下,与N2、S、X2等单质反应,如2B+N2 2BN。(2)高温下同金属反应生成金属硼化物。(3)赤热下,与水蒸气反应,2B+6H2O(g) 2B(OH)3+3H2。(4)与热的浓硫酸或浓硝酸反应,2B+3H2SO4(浓) 2H3BO3+3SO2↑,B+3HNO3(浓) H3BO3+3NO2↑。
2.硼酸(H3BO3)(1)一元弱酸,H3BO3+H2O H++[B(OH)4]-。(2)H3BO3受热时会逐渐脱水,首先生成偏硼酸(HBO2),继续升温可进一步脱水生成四硼酸(H2B4O7),更高温度时则转变为硼酸的酸酐(B2O3)。
3.硼氢化钠(NaBH4)硼氢化钠中的氢元素为-1价,具有还原性,故其可用作醛类、酮类和酰氯类的还原剂:
4.硼砂(Na2B4O7·10H2O)(1)制备:将偏硼酸钠溶于水形成较浓溶液,然后通入CO2调节pH,浓缩结晶分离出硼砂:4NaBO2+CO2+10H2O===Na2B4O7·10H2O+Na2CO3。(2)将硼砂溶于水,用硫酸溶液调节pH,可析出溶解度小的硼酸晶体:Na2B4O7+H2SO4+5H2O===4H3BO3↓+Na2SO4。
1.NaBH4与FeCl3反应可制取纳米铁:2FeCl3+6NaBH4+18H2O===2Fe+6NaCl+6H3BO3+21H2↑,下列说法正确的是A.该反应中氧化剂只有FeCl3
B.NaBH4的电子式为
C.NaBH4不能与水发生反应D.该反应中每生成1 ml Fe转移电子3 ml
NaBH4中H为-1价,水中H为+1价,两者发生归中反应可生成氢气,C项错误;题述氧化还原反应中,化合价升高的只有NaBH4中的H,由-1价升高到0价,可据此判断电子转移数目,每生成1 ml Fe,消耗3 ml NaBH4,转移电子12 ml,D项错误。
解析 反应2FeCl3+6NaBH4+18H2O===2Fe+6NaCl+6H3BO3+21H2↑中,FeCl3中的Fe由+3价降低到0价,水中部分H由+1价降低到0价,所以该反应中氧化剂为FeCl3和H2O,A项错误;
2.按要求回答问题(1)[2019·全国卷Ⅰ,26(3)]根据H3BO3的解离反应:H3BO3+H2O H++ ,Ka=5.81×10-10,可判断H3BO3是_______酸。
(2)[2015·全国卷Ⅰ, 27(1)(6)]写出Mg2B2O5·H2O与硫酸反应的化学方程式:____________________________________________。单质硼可用于生产具有优良抗冲击性能的硼钢。以硼酸和金属镁为原料可制备单质硼,用化学方程式表示制备过程:____________________________________________________。
(3)[2015·安徽理综,27(2)]请配平化学方程式:____NaBO2+____SiO2+____Na+____H2===____NaBH4+____Na2SiO3。(4)[2014·重庆理综,11(2)]NaBH4是一种重要的储氢载体,能与水反应得到NaBO2,且反应前后B的化合价不变,该反应的化学方程式为_____________________________。
NaBH4+2H2O===NaBO2+4H2↑
3.硼、镁及其化合物在工农业生产中应用广泛。已知硼镁矿的主要成分为Mg2B2O5·H2O,硼砂的化学式为Na2B4O7·10H2O。一种利用硼镁矿制取金属镁及粗硼的工艺流程如图所示:
(1)写出硼元素在元素周期表中的位置:_______________。
(2)将硼砂溶于水后,用硫酸调节溶液的pH≈3.5以制取硼酸(H3BO3),该反应的离子方程式为________________________________。(3)由MgCl2·6H2O制备MgCl2时,一定条件是________________。
解析 因MgCl2在蒸干灼烧时会发生水解,其水解的化学方程式为MgCl2+2H2O Mg(OH)2+2HCl,所以为了防止氯化镁水解生成氢氧化镁,需要在HCl氛围中加热。
(4)制得的粗硼在一定条件下反应生成BI3,BI3在一定条件下受热分解可以得到纯净的单质硼。0.200 0 g粗硼制成的BI3完全分解,将生成的I2配制成100 mL碘水,量取10.00 mL碘水于锥形瓶中,向其中滴加几滴淀粉溶液,用0.300 0 ml·L-1 Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液18.00 mL。(提示: )滴定终点的现象为_____________________________________________________________________,该粗硼样品的纯度为____%。
最后一滴Na2S2O3溶液,锥形瓶中溶液蓝色褪去,且半分钟内不恢复原色
解析 消耗的Na2S2O3的物质的量为0.300 0 ml·L-1×0.018 L=0.005 4 ml,
则硼的质量为11 g·ml-1×0.018 ml=0.198 g,
(5)H3BO3[也可写成B(OH)3]可以通过电解NaB(OH)4溶液的方法制备。工作原理如图所示。
①b膜为________(填“阴离子”或“阳离子”)交换膜,写出产品室发生反应的离子方程式:__________________________,理论上每生成1 ml H3BO3,N室可生成_____L(标准状况)气体。
阴极的电解液为氢氧化钠溶液,所以N室的电极反应式为2H2O+2e-===H2↑+2OH-,
生成1 ml H3BO3时,需要M室和原料室分别转入1 ml H+、1 ml ,则需转移1 ml e-,所以N室可生成0.5 ml氢气,其体积在标准状况下为11.2 L。
②N室中,进口和出口的溶液浓度大小关系为a%______(填“>”或“
相关课件
这是一份新高考化学一轮复习讲义课件 第4章 第26讲 常见非金属及其化合物重难点再落实,共60页。PPT课件主要包含了课时精练巩固提高,内容索引,②X为CO2,③X为强酸如HCl,2交叉型转化,3三角型转化,Fe3++Fe,3Fe2+,氢氟酸HF,非极性键等内容,欢迎下载使用。
这是一份新高考化学一轮复习讲义课件第6章 第18讲 原电池 化学电源,共60页。PPT课件主要包含了考点一,考点二,考点清单,自发进行,氧化还原,电解质,直接接触,自发的,Zn片,Cu片等内容,欢迎下载使用。
这是一份新高考化学一轮复习讲义课件第6章 第38讲 电解原理的综合应用(含解析),共57页。PPT课件主要包含了复习目标,真题演练明确考向,KCl,课时精练,N2O5,石墨Ⅰ等内容,欢迎下载使用。








