





所属成套资源:新高考化学一轮复习讲义课件 (含解析)
新高考化学一轮复习讲义课件 第8章 第39讲 酸碱中和反应及中和滴定
展开
这是一份新高考化学一轮复习讲义课件 第8章 第39讲 酸碱中和反应及中和滴定,共60页。PPT课件主要包含了复习目标,真题演练明确考向,课时精练巩固提高,内容索引,知识梳理·夯基础,指示剂,甲基橙,控制滴,定管的活塞,形瓶内溶液等内容,欢迎下载使用。
1.了解酸碱中和滴定的原理和滴定终点的判断方法,知道指示剂 选择的方法。2.掌握酸碱中和滴定的操作和数据处理误差分析方法。3.掌握滴定法在定量测定中的应用。
考点一 酸碱中和滴定的原理与操作
考点二 滴定曲线(pH曲线)分析与应用
答题规范 4 滴定终点判断
微专题22 氧化还原滴定
专项提能特训15 滴定过程的曲线分析
1.概念用已知浓度的酸(或碱)滴定未知浓度的碱(或酸),根据中和反应的等量关系来测定酸(或碱)的浓度。2.原理
3.酸碱中和滴定的关键(1)准确测定参加反应的酸、碱溶液的 。(2)选取适当 。(3)准确判断滴定 。
4.酸碱中和滴定指示剂选择的基本原则利用酸碱指示剂明显的颜色变化,表示反应已完全,指示滴定终点。因而指示剂变色要灵敏,变色范围要小,使变色范围尽量与滴定终点溶液的酸碱性一致。(1)强酸滴定强碱一般用甲基橙,但用酚酞也可以。(2)滴定终点为碱性时,一般用 作指示剂。(3)滴定终点为酸性时,一般用 作指示剂。
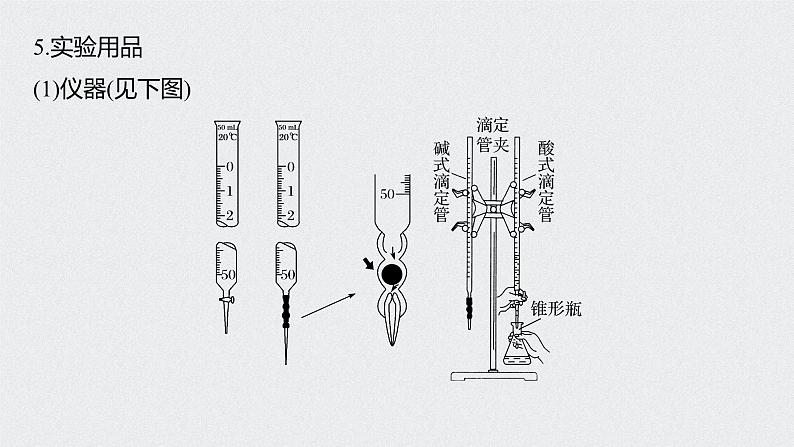
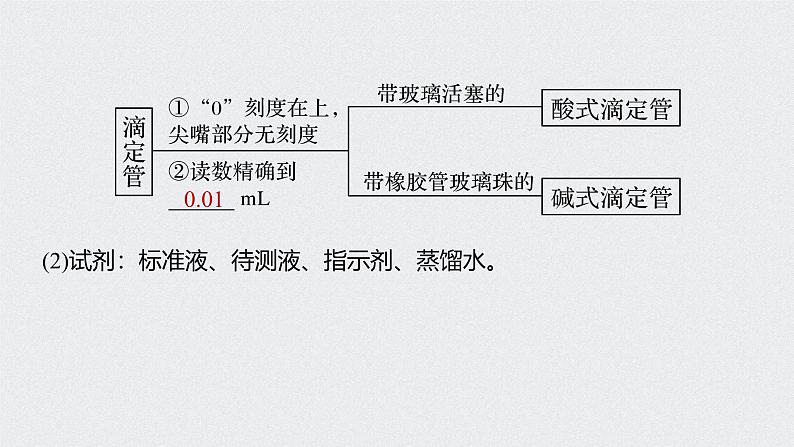
5.实验用品(1)仪器(见下图)
(2)试剂:标准液、待测液、指示剂、蒸馏水。
6.实验操作以标准盐酸滴定待测NaOH溶液为例(1)滴定前的准备①滴定管:查漏→洗涤→ →装液→排气泡→调液面→记录。②锥形瓶:注碱液→记体积→加指示剂。(2)滴定
(3)终点判断等到滴入最后一滴标准液,指示剂变色,且在半分钟内 原来的颜色,视为滴定终点并记录标准液的体积。(4)数据处理按上述操作重复 次,求出用去标准盐酸体积的平均值,根据c(NaOH)= 计算。
7.误差分析分析依据:c(待测)=
若V(标准)偏大⇒c(待测) ;若V(标准)偏小⇒c(待测) 。
以标准酸溶液滴定未知浓度的碱(酚酞作指示剂)为例,常见的因操作不正确而引起的误差有:
(1)KMnO4溶液应用碱式滴定管盛装( )错因: 。(2)将液面在0 mL处的25 mL的酸式滴定管中的液体全部放出,液体的体积为25 mL()错因: 。(3)达到滴定终点时,所得溶液一定为中性()错因: 。
高锰酸钾溶液能腐蚀碱式滴定管的橡胶管
滴定管25 mL以下没有刻度,液体的体积大于25 mL
滴定终点溶液的酸碱性主要看反应产物的成分和指示剂的变色范围,溶液不一定呈中性
(4)中和滴定实验时,滴定管、锥形瓶均用待盛液润洗( )错因: 。(5)酸碱指示剂越多变色越明显,指示剂至少加入2~3 mL()错因: 。
锥形瓶不能用待盛液润洗
酸碱指示剂本身就是弱酸或弱碱,一般加2~3滴
题组一 中和滴定的操作与指示剂的选择
1.某研究小组为测定食用白醋中醋酸的含量进行如下操作,正确的是 A.用碱式滴定管量取一定体积的待测白醋放入锥形瓶中B.称取4.0 g NaOH放到1 000 mL容量瓶中,加水至刻度,配成1.00 ml·L-1 NaOH标准溶液C.用NaOH溶液滴定白醋,使用酚酞作指示剂,溶液颜色恰好由无色变为 浅红色,且半分钟内不褪色时,为滴定终点D.滴定时眼睛要注视着滴定管内NaOH溶液的液面变化,防止滴定过量
2.实验室现有3种酸碱指示剂,其pH变色范围如下:甲基橙:3.1~4.4 石蕊:5.0~8.0 酚酞:8.2~10.0用0.100 0 ml·L-1NaOH溶液滴定未知浓度的CH3COOH溶液,恰好完全反应时,下列叙述中正确的是 A.溶液呈中性,可选用甲基橙或酚酞作指示剂B.溶液呈中性,只能选用石蕊作指示剂C.溶液呈碱性,可选用甲基橙或酚酞作指示剂D.溶液呈碱性,只能选用酚酞作指示剂
解析 NaOH溶液和CH3COOH溶液恰好完全反应时生成CH3COONa,CH3COO-水解显碱性,而酚酞的变色范围为8.2~10.0,比较接近。
题组二 滴定法在其他定量测定中的应用3.下列滴定中,指示剂的选择或滴定终点颜色变化有错误的是 提示:2KMnO4+5K2SO3+3H2SO4===6K2SO4+2MnSO4+3H2O、I2+Na2S===2NaI+S↓
解析 A项,锥形瓶中为酸,加入酚酞无色,达到滴定终点,溶液显碱性,溶液变为浅红色,故现象为无色→浅红色,正确;B项,锥形瓶中为碱,达到滴定终点,溶液显酸性,应选择指示剂甲基橙,现象是溶液由黄色变为橙色,错误。
4.中华人民共和国国家标准(GB2760-2011)规定葡萄酒中SO2最大使用量为0.25 g·L-1。某兴趣小组用图1装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行测定。
(1)B中加入300.00 mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,C中反应的化学方程式为____________________。
SO2+H2O2===H2SO4
(2)除去C中过量的H2O2,然后用0.090 0 ml·L-1NaOH标准溶液进行滴定,滴定前排气泡时,应选择图2中的________(填序号);简述排气泡的操作:________________________________________________________________________________________。
将胶管弯曲使玻璃尖嘴向上倾斜,用两指捏住胶管,轻轻挤压玻璃珠的中上部,使液体从尖嘴流出
(3)①若滴定终点时溶液的pH=8.8,则选择的指示剂为________;描述达到滴定终点的现象__________________________________________________________________。②若滴定终点时溶液的pH=4.2,则选择的指示剂为__________;描述达到滴定终点的现象_______________________________________________________________。(4)若用50 mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积______(填序号)。①=10 mL ②=40 mL ③40 mL
滴入最后一滴标准液,溶液由无色变为浅红色,且半分钟内不恢复原色
当滴入最后一滴标准液,溶液由红色变为橙色,且半分钟内不恢复原色
(5)滴定至终点时,消耗NaOH溶液25.00 mL,列式计算该葡萄酒中SO2含量_________________________________________________________________________________________________________________________________________________________________。(6)该测定结果比实际值偏高,分析原因并利用现有装置提出改进措施:_________________________________________________________________________________________________________。
n(NaOH)=0.090 0 ml·L-1×0.025 L=0.002 25 ml。根据反应关系SO2~H2SO4~2NaOH,
盐酸具有挥发性,反应过程中挥发出的盐酸滴定时消耗了NaOH标准液。改进措施:用非挥发性的强酸硫酸代替盐酸
题组三 数据处理与误差分析5.实验室用标准盐酸测定某NaOH溶液的浓度,用甲基橙作指示剂,下列操作中可能使测定结果偏低的是 A.取NaOH溶液时俯视读数B.滴定结束后,滴定管尖嘴处有一悬挂液滴C.锥形瓶内溶液颜色变化由黄色变橙色,立即记下滴定管液面所在刻度D.盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2~3次
解析 滴定结束后,滴定管尖嘴处有一悬挂液滴,会使消耗的盐酸的体积偏大,测定结果偏高,B错误;锥形瓶内溶液颜色变化由黄色变橙色,立即记下滴定管液面所在刻度,可能会导致滴定终点的误判,使消耗盐酸的体积偏小,测定结果偏低,C正确;盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2~3次,会使NaOH溶液的体积偏大,导致消耗盐酸的体积偏大,测定结果偏高,D错误。
6.某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂。请填写下列空白:(1)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视_____________________,直到因加入一滴盐酸后,溶液由黄色变为橙色,并_________________为止。
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是_____(填字母)。A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥C.酸式滴定管在滴定前有气泡,滴定后气泡消失D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,则起始读数为______mL,终点读数为_____mL,所用盐酸的体积为______mL。
(4)某学生根据3次实验分别记录有关数据如下表:
依据上表数据列式计算该NaOH溶液的物质的量浓度。
滴定管读数要领以凹液面的最低点为基准(如图)
正确读数(虚线部分)和错误读数(实线部分)。
答题模板当滴入最后一滴×××标准溶液后,溶液变成×××色,且半分钟内不恢复原来的颜色。解答此类题目注意三个关键点:(1)最后一滴:必须说明是滴入“最后一滴”溶液。(2)颜色变化:必须说明滴入“最后一滴”溶液后溶液“颜色的变化”。(3)半分钟:必须说明溶液颜色变化后“半分钟内不再恢复原来的颜色”。
(1)用a ml·L-1的盐酸滴定未知浓度的NaOH溶液,用酚酞作指示剂,达到滴定终点的现象是_________________________________________________________________;若用甲基橙作指示剂,滴定终点现象是_________________________________________________________________。(2)用标准碘溶液滴定溶有SO2的水溶液,以测定水中SO2的含量,应选用__________作指示剂,达到滴定终点的现象是_____________________________________________________________。
当滴入最后一滴标准液后,溶液由红色变为无色,且半分钟内不恢复红色
当滴入最后一滴标准液后,溶液由黄色变为橙色,且半分钟内不恢复黄色
当滴入最后一滴标准液后,溶液由无色变为蓝色,且半分钟内不褪色
(3)用标准酸性KMnO4溶液滴定溶有SO2的水溶液,以测定水中SO2的含量,是否需要选用指示剂____(填“是”或“否”),达到滴定终点的现象是_______________________________________________________________________。(4)用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再用KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+,滴定Ti3+时发生反应的离子方程式为________________________ ,达到滴定终点的现象是_______________________________________________________。
当滴入最后一滴酸性KMnO4溶液后,溶液由无色变为浅红色,且半分钟内不褪色
Ti3++Fe3+===
当滴入最后一滴标准液后,溶液变成
红色,且半分钟内不褪色
(5)用标准KI溶液滴定含有Fe3+的溶液,应选用__________作指示剂,滴定终点现象是_________________________________________________________________。
当滴入最后一滴标准KI溶液后,溶液的红色褪去,且半分钟内不恢复红色
1.图示强酸与强碱滴定过程中pH曲线(以0.100 0 ml·L-1 NaOH溶液滴定20.00 mL 0.100 0 ml·L-1盐酸为例)
2.强酸(碱)滴定弱碱(酸)pH曲线比较
恰好中和=酸碱恰好完全反应≠滴定终点≠溶液呈中性。
1.(2019·山西大同模拟)常温下,用0.10 ml·L-1 NaOH溶液分别滴定20.00 mL 0.10 ml·L-1 HCl溶液和20.00 mL 0.10 ml·L-1 CH3COOH溶液,得到两条滴定曲线,如图所示,则下列说法正确的是
A.图2是滴定盐酸的曲线B.a与b的关系是a<bC.E点对应离子浓度由大到小的 顺序可能为c(CH3COO-)> c(Na+)>c(H+)>c(OH-)D.这两次滴定都可以用甲基橙作为指示剂
解析 如果酸为强酸,则0.10 ml·L-1酸的pH为1,根据酸的初始pH知,图1为盐酸的滴定曲线,故A错误;根据图1知,a点氢氧化钠溶液的体积是20.00 mL,酸和碱的物质的量相等,二者恰好反应生成强酸强碱盐,其溶液呈中性;醋酸溶液中滴入氢氧化钠溶液,醋酸钠溶液呈碱性,所以氢氧化钠溶液的体积小于20.00 mL,a>b,故B错误;
E点溶液的成分为醋酸钠和醋酸,溶液呈酸性,说明醋酸的电离程度大于醋酸钠的水解程度,盐类水解程度较小,则溶液中离子浓度可能为c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故C正确;氢氧化钠和盐酸恰好反应呈中性,可以选择甲基橙或酚酞;氢氧化钠和醋酸恰好反应生成醋酸钠溶液,溶液呈碱性,只能选择酚酞,故D错误。
2.用0.100 0 ml·L-1的标准盐酸分别滴定20.00 mL的0.100 0 ml·L-1氨水和20.00 mL的0.100 0 ml·L-1氢氧化钠溶液的滴定曲线如图所示,横坐标为滴定百分数( ),纵坐标为滴定过程中溶液pH,甲基红是一种酸碱指示剂,变色范围为4.4~6.2,下列有关滴定过程说法正确的是
A.滴定氨水,当滴定分数为50%时,各离子浓度间存在关系:c( )+c(H+)=c(OH-)B.滴定分数为100%时,即为滴定过程中反应恰好完全的时刻C.从滴定曲线可以判断,使用甲基橙作为滴定过程中的指示剂准确性更佳D.滴定氨水,当滴定分数为150%时,所得溶液中离子浓度有大小关系:c(Cl-)> c(H+)>c( )>c(OH-)
解析 溶液中存在的电荷守恒应为c( )+c(H+)=c(OH-)+c(Cl-),故A错误;滴定分数为100%时,酸与碱的物质的量相等,即为滴定过程中反应恰好完全的时刻,故B正确;
从滴定曲线看甲基红变色范围更接近于滴定终点,使用甲基橙显示偏晚,故C错误;滴定分数为150%时,即加入盐酸30.00 mL,此时溶质是NH4Cl和HCl,物质的量之比为2∶1,则c( )>c(H+),故D错误。
3.(2019·山东淄博模拟)已知25 ℃时,向10 mL 0.01 ml·L-1NaCN溶液中逐滴加入0.01 ml·L-1的盐酸,滴定曲线如图1所示,CN-、HCN的物质的量分数(α)随pH变化的关系如图2所示。下列表述正确的是
A.b点时:c(Cl-)>c(HCN)B.d点时:c(Na+)+c(H+)=c(HCN)+c(OH-)+2c(CN-)C.图2中的e点对应图1中的c点D.选用酚酞试剂比选用甲基橙试剂作指示剂误差更小
解析 b点时,溶液中的溶质为等物质的量NaCl、NaCN和HCN,此时溶液呈碱性,说明CN-的水解程度大于HCN的电离程度,故c(HCN)>c(Cl-)>c(CN-),A项错误;d点恰好完全反应,根据电荷守恒:c(Na+)+c(H+)=c(Cl-)+c(OH-)+c(CN-),根据物料守恒:c(Cl-)=c(CN-)+c(HCN),两式相加可得:c(Na+)+c(H+)=c(HCN)+c(OH-)+2c(CN-),B项正确;图1中c点c(HCN)>c(CN-),C项错误。
4.298 K时,向20.0 mL 0.10 ml·L-1 H2A溶液中滴加0.10 ml·L-1 NaOH溶液,滴定曲线如图所示。下列说法正确的是
A.该滴定过程应该选择石蕊溶液作指示剂B.W点到X点发生的主要反应的离子方程式 为H2A+2OH-===A2-+2H2OC.Y点对应的溶液中c(Na+)+c(H+)=c(OH-) +2c(A2-)D.反应H2A+A2- 2HA-的平衡常数K= 1.0×107.4
解析 石蕊不能用作酸碱中和滴定的指示剂,根据图示滴定终点的pH,可知第二反应终点应用酚酞作指示剂,A项错误;
X点对应的溶液中溶质主要是NaHA,W点到X点发生的主要反应的离子方程式为H2A+OH-===HA-+H2O,B项错误;根据电荷守恒,c(Na+)+c(H+)=c(OH-)+c(HA-)+2c(A2-),因为Y点对应的溶液中c(HA-)=c(A2-),所以c(Na+)+c(H+)=c(OH-)+3c(A2-),C项错误;
图像题的分析步骤首先看横纵坐标,搞清楚是酸加入碱中,还是碱加入酸中;其次看起点,起点可以看出酸性或碱性的强弱,这在判断滴定终点时至关重要;再次找滴定终点和pH=7的中性点,判断滴定终点的酸碱性,然后确定中性点(pH=7)的位置;最后分析其他的特殊点(如滴定一半点,过量一半点等),分析酸、碱过量情况。
1.正误判断(1)用标准HCl溶液滴定NaHCO3溶液来测定其浓度,选择酚酞为指示剂( )(2018·全国卷Ⅲ,10B)(2)滴定接近终点时,滴定管的尖嘴可以接触锥形瓶内壁( )(2016·海南,8C)(3)用稀NaOH滴定盐酸,用酚酞作指示剂,当锥形瓶中溶液由红色变无色时停止滴定( )(2015·广东理综,12C)(4)中和滴定时,滴定管用所盛装的反应液润洗2~3次( )(2015·江苏,7B)
2.(2020·浙江7月选考,23)常温下,用0.1 ml·L-1氨水滴定10 mL浓度均为0.1 ml·L-1的HCl和CH3COOH的混合液,下列说法不正确的是 A.在氨水滴定前,HCl和CH3COOH的混合液中c(Cl-)>c(CH3COO-)B.当滴入氨水10 mL时,c( )+c(NH3·H2O)=c(CH3COO-)+c(CH3COOH)C.当滴入氨水20 mL时,c(CH3COOH)+c(H+)=c(NH3·H2O)+c(OH-)D.当溶液呈中性时,氨水滴入量大于20 mL,c( )<c(Cl-)
解析 HCl是强酸,CH3COOH是弱酸,浓度均为0.1 ml·L-1时,c(Cl-)>c(CH3COO-),A正确;
滴入10 mL氨水时,NH3·H2O和CH3COOH的物质的量相等,据物料守恒可得c( )+c(NH3·H2O)=c(CH3COO-)+c(CH3COOH),B正确;
滴入20 mL氨水时,恰好完全反应,所得溶液为等浓度的NH4Cl和CH3COONH4的混合溶液,据电荷守恒可知c( )+c(H+)=c(Cl-)+c(CH3COO-)+c(OH-),据物料守恒可得c( )+c(NH3·H2O)=c(CH3COOH)+c(CH3COO-)+c(Cl-),联立两式可得c(CH3COOH)+c(H+)=c(NH3·H2O)+c(OH-),C正确;
滴入20 mL氨水时,所得混合液呈酸性,若溶液呈中性,氨水滴入量要大于20 mL,结合电荷守恒关系c( )+c(H+)=c(Cl-)+c(CH3COO-)+c(OH-),溶液呈中性时,c(H+)=c(OH-),得c( )=c(Cl-)+c(CH3COO-),则有c( )>c(Cl-),D错误。
3.(2016·全国卷Ⅰ,12)298 K时,在20.0 mL 0.10 ml·L-1氨水中滴入0.10 ml·L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。已知0.10 ml·L-1氨水的电离度为1.32%,下列有关叙述正确的是 A.该滴定过程应该选择酚酞作为指示剂B.M点对应的盐酸体积为20.0 mLC.M点处的溶液中c( )=c(Cl-)=c(H+)=c(OH-)D.N点处的溶液中pH
相关课件
这是一份新高考化学一轮复习讲义课件 第8章 第39讲 专项提能特训15 滴定过程的曲线分析,共26页。PPT课件主要包含了c点以上等内容,欢迎下载使用。
这是一份新高考化学一轮复习讲义课件第8章 第48讲 酸碱中和反应及中和滴定(含解析),共60页。PPT课件主要包含了复习目标,氧化还原滴定,直接滴定型,连续反应型,过量试剂型,滴定终点判断,真题演练明确考向,课时精练等内容,欢迎下载使用。
这是一份新高考化学一轮复习课件 第8章 第48讲 酸碱中和反应及中和滴定,共60页。PPT课件主要包含了高考化学一轮复习策略,氧化还原滴定,滴定终点判断,真题演练明确考向,课时精练等内容,欢迎下载使用。









