




新高考化学一轮复习讲练测第15讲 化学反应的热效应(练)解析版
展开
这是一份新高考化学一轮复习讲练测第15讲 化学反应的热效应(练)解析版,文件包含新高考化学一轮复习讲练测第15讲化学反应的热效应练原卷版docx、新高考化学一轮复习讲练测第15讲化学反应的热效应练解析版docx等2份试卷配套教学资源,其中试卷共22页, 欢迎下载使用。
1.下列说法不正确的是( )
A.化学能可以转变成热能、电能等
B.化学反应必然伴随着能量变化
C.化学反应中的能量变化主要是由化学键的变化引起的
D.化学反应中能量变化的多少与反应物的质量无关
2.合成氨原料中的H2可用甲烷在高温条件下与水蒸气反应制得。部分1 ml物质完全燃烧生成常温下稳定氧化物的ΔH数据如下表:
已知1 ml H2O(g)转化生成1 ml H2O(l)时放出热量44.0 kJ。下列CH4和水蒸气在高温下反应得到H2和CO的热化学方程式正确的是( )
A.CH4(g)+H2O(g)===CO(g)+3H2(g)
ΔH1=+206.1 kJ·ml-1
B.CH4(g)+H2O(g)===CO(g)+3H2(g)
ΔH2=-206.1 kJ·ml-1
C.CH4(g)+H2O(g)===CO(g)+3H2(g)
ΔH3=+365.5 kJ·ml-1
D.CH4(g)+H2O(g)===CO(g)+3H2(g)
ΔH4=-365.5 kJ·ml-1
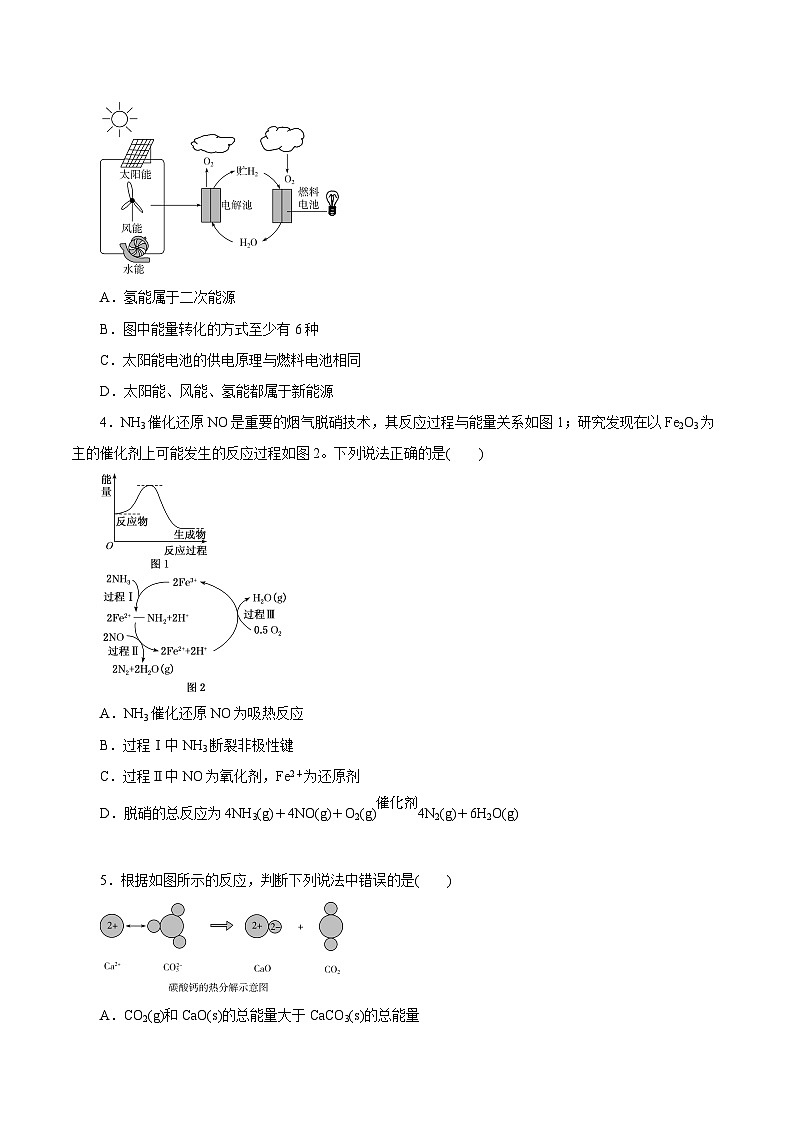
3.一种生产和利用氢能的途径如图所示。下列说法中错误的是( )
A.氢能属于二次能源
B.图中能量转化的方式至少有6种
C.太阳能电池的供电原理与燃料电池相同
D.太阳能、风能、氢能都属于新能源
4.NH3催化还原NO是重要的烟气脱硝技术,其反应过程与能量关系如图1;研究发现在以Fe2O3为主的催化剂上可能发生的反应过程如图2。下列说法正确的是( )
A.NH3催化还原NO为吸热反应
B.过程Ⅰ中NH3断裂非极性键
C.过程Ⅱ中NO为氧化剂,Fe2+为还原剂
D.脱硝的总反应为4NH3(g)+4NO(g)+O2(g) eq \(,\s\up7(催化剂)) 4N2(g)+6H2O(g)
5.根据如图所示的反应,判断下列说法中错误的是( )
A.CO2(g)和CaO(s)的总能量大于CaCO3(s)的总能量
B.该反应的焓变大于零
C.该反应中既有离子键断裂也有共价键断裂,化学键断裂吸收能量,化学键生成放出能量
D.由该反应可推出凡是需要加热才发生的反应均为吸热反应
6.通过以下反应均可获取H2。下列有关说法正确的是( )
①太阳光催化分解水制氢:2H2O(l)===2H2(g)+O2(g) ΔH1=571.6 kJ·ml-1
②焦炭与水反应制氢:C(s)+H2O(g)===CO(g)+H2(g) ΔH2=131.3 kJ·ml-1
③甲烷与水反应制氢:CH4(g)+H2O(g)===CO(g)+3H2(g) ΔH3=206.1 kJ·ml-1
A.反应①中电能转化为化学能
B.反应②为放热反应
C.反应③使用催化剂,ΔH3减小
D.反应CH4(g)===C(s)+2H2(g)的ΔH=74.8 kJ·ml-1
7.已知反应:C(s)+O2(g)===CO2(g) ΔH1
CO2(g)+C(s)===2CO(g) ΔH2
2CO(g)+O2(g)===2CO2(g) ΔH3
2Cu(s)+O2(g)===2CuO(s) ΔH4
CO(g)+CuO(s)===CO2(g)+Cu(s) ΔH5
下列说法正确的是( )
A.ΔH1>0,ΔH3<0 B.ΔH2=ΔH1-ΔH3
C.ΔH2<0,ΔH4>0 D.ΔH5=ΔH1+eq \f(1,2)ΔH4
8.以TiO2为催化剂的光热化学循环分解CO2反应为温室气体减排提供了一个新途径,该反应的机理及各分子化学键完全断裂时的能量变化如下图所示:
下列说法正确的是( )
A.过程①中钛氧键断裂会释放能量
B.该反应中,光能和热能转化为化学能
C.使用TiO2作催化剂可以降低反应的焓变,从而提高化学反应速率
D.CO2分解反应的热化学方程式为2CO2(g)===2CO(g)+O2(g) ΔH=+30 kJ·ml-1
9.火箭推进器常以联氨(N2H4)为燃料、过氧化氢为助燃剂。已知下列各物质反应的热化学方程式:
N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH1=-533.23 kJ·ml-1
H2O(g)===H2O(l) ΔH2=-44 kJ·ml-1
2H2O2(l)===2H2O(l)+O2(g) ΔH3=-196.4 kJ·ml-1
则联氨与过氧化氢反应的热化学方程式可表示为( )
A.N2H4(g)+2H2O2(l)===N2(g)+4H2O(l) ΔH=+817.63 kJ·ml-1
B.N2H4(g)+2H2O2(l)===N2(g)+4H2O(g) ΔH=-641.63 kJ·ml-1
C.N2H4(g)+2H2O2(l)===N2(g)+4H2O(l) ΔH=-641.63 kJ·ml-1
D.N2H4(g)+2H2O2(l)===N2(g)+4H2O(g) ΔH=-817.63 kJ·ml-1
10.化学反应放出或吸收的能量称为反应热。反应热(ΔH)又因化学反应的分类给予不同的名称。如我们学过的燃烧热(ΔHc),又如由稳定单质化合生成1 ml纯物质的热效应称为生成热(ΔHf),断裂化学键时,所吸收的能量称为键能(ΔHb)。下面两个图中的数据分别表示水与二氧化碳各1 ml 分解时能量变化的示意图,图中的各数据均以kJ为单位,下列说法正确的是( )
A.H2O(g)的生成热:ΔHf=243 kJ·ml-1
B.CO(g)的燃烧热:ΔHc=-570 kJ·ml-1
C.O—H键的键能:ΔHb=436 kJ·ml-1
D.CO(g)+H2O(g)===CO2(g)+H2(g)
ΔH=-42 kJ·ml-1
【练提升】
1.工业上,在一定条件下利用乙烯和水蒸气反应制备乙醇。化学原理:CH2===CH2(g)+H2O(g)===CH3CH2OH(g) ΔH。已知几种共价键的键能如下表所示:
下列说法中错误的是( )
A.上述合成乙醇的反应是加成反应
B.相同时间段内,反应中用三种物质表示的反应速率相等
C.碳碳双键的键能小于碳碳单键键能的2倍
D.上述反应式中,ΔH=-96 kJ·ml-1
2.已知:①Cu(s)+2H+(aq)===Cu2+(aq)+H2(g) ΔH1
②2H2O2(l)===2H2O(l)+O2(g) ΔH2
③2H2(g)+O2(g)===2H2O(l) ΔH3
则反应Cu(s)+H2O2(l)+2H+(aq)===Cu2+(aq)+2H2O(l)的ΔH=( )
A.ΔH1+eq \f(1,2)ΔH2+eq \f(1,2)ΔH3
B.ΔH1+eq \f(1,2)ΔH2-eq \f(1,2)ΔH3
C.ΔH1+2ΔH2+2ΔH3
D.2ΔH1+ΔH2+ΔH3
3.研究表明CO与N2O在Fe+作用下发生反应的能量变化及反应历程如图所示,两步反应分别为①N2O+Fe+===N2+FeO+(慢)、②FeO++CO===CO2+Fe+(快)。下列说法正确的是( )
A.反应①②都是氧化还原反应
B.两步反应均为放热反应,总反应的化学反应速率由反应②决定
C.Fe+使反应的活化能减小,FeO+是中间产物
D.若转移1 ml电子,则消耗11.2 L N2O
4.肼(N2H4)在不同条件下分解产物不同,200 ℃时在Cu表面分解的机理如图1。已知200 ℃时:
反应Ⅰ:3N2H4(g)===N2(g)+4NH3(g) ΔH1=-32.9 kJ·ml-1
反应Ⅱ:N2H4(g)+H2(g)===2NH3(g) ΔH2=-41.8 kJ·ml-1
下列说法不正确的是( )
A.图1所示过程①是放热反应、②是吸热反应
B.反应Ⅱ的能量过程示意图如图2所示
C.断开3 ml N2H4(g)中的化学键吸收的能量大于形成1 ml N2(g)和4 ml NH3(g)中的化学键释放的能量
D.200 ℃时,肼分解生成氮气和氢气的热化学方程式为N2H4(g)===N2(g)+2H2(g) ΔH=+50.7 kJ·ml-1
5.工业上,在一定条件下利用乙烯和水蒸气反应制备乙醇,化学原理为CH2==CH2(g)+H2O(g)===CH3CH2OH(g) ΔH。已知几种共价键的键能如下表所示:
下列说法中错误的是( )
A.上述合成乙醇的反应是加成反应
B.相同时间段内,反应中用三种物质表示的反应速率相等
C.碳碳双键的键能小于碳碳单键的键能的2倍
D.上述反应式中,ΔH=-96 kJ·ml-1
6.已知:①2H2(g)+O2(g)===2H2O(g) ΔH1
②3H2(g)+Fe2O3(s)===2Fe(s)+3H2O(g) ΔH2
③2Fe(s)+ eq \f(3,2) O2(g)===Fe2O3(s) ΔH3
④2Al(s)+ eq \f(3,2) O2(g)===Al2O3(s) ΔH4
⑤2Al(s)+Fe2O3(s)===Al2O3(s)+2Fe(s) ΔH5
下列关于上述反应焓变的判断正确的是( )
A.ΔH10
B.ΔH5
相关试卷
这是一份新高考化学一轮复习讲练测第33讲 烃(练)(解析版),文件包含新高考化学一轮复习讲练测第33讲烃练原卷版docx、新高考化学一轮复习讲练测第33讲烃练解析版docx等2份试卷配套教学资源,其中试卷共20页, 欢迎下载使用。
这是一份新高考化学一轮复习讲练测第15讲 化学反应的热效应 (讲)(解析版),文件包含新高考化学一轮复习讲练测第15讲化学反应的热效应讲原卷版docx、新高考化学一轮复习讲练测第15讲化学反应的热效应讲解析版docx等2份试卷配套教学资源,其中试卷共36页, 欢迎下载使用。
这是一份新高考化学一轮复习讲练测第15讲 化学反应的热效应 (练)(解析版),文件包含新高考化学一轮复习讲练测第15讲化学反应的热效应练原卷版docx、新高考化学一轮复习讲练测第15讲化学反应的热效应练解析版docx等2份试卷配套教学资源,其中试卷共23页, 欢迎下载使用。








