



高考化学二轮复习易错题易错点07 阿伏加德罗常数的判断(解析版)
展开典例分析
例题1、用NA表示阿伏加德罗常数,下列说法正确的是( )
①36g 18O2中所含的中子数为16NA②78g Na2O2与足量水完全反应,转移电子数为1NA③标准状况下,2.24 L Cl2溶于水中达到饱和,可得到HClO分子的数目是0.1NA④在标准状况下,22.4 LHF的分子数目为1NA⑤3.4g过氧化氢中含有的离子数为0.3NA⑥在常温常压下,0.1 ml铁与0.1 mlCl2充分反应,转移的电子数为0.3NA⑦配制480mL2ml·L-1NaCl溶液,需要用托盘天平称量1NA氯化钠固体⑧S2和S8的混合物共6.4 g,其中所含硫原子数一定为0.2NA
A.只有②⑧正确 B.只有②④⑦⑧正确 C.只有①②③⑤⑥正确 D.都不正确
【解析】①36 g 18O2的物质的量为1 ml,含有中子20 ml,错误;②78 g Na2O2的物质的量为1 ml,与足量水完全反应,转移1 ml电子,正确;③氯气与水的反应属于可逆反应,不能完全反应,得到的HClO分子的数目少于0.1NA,错误;④在标准状况下,HF是液体,22.4 L HF的物质的量大于1 ml,错误;⑤3.4 g过氧化氢的物质的量为0.1 ml,过氧化氢是共价化合物,其中没有离子,错误;⑥在常温常压下,铁与干燥的氯气不反应,错误;⑦配制480 mL 2 ml·L-1 NaCl溶液,应该选用500 mL的容量瓶,需要用托盘天平称量0.5 L×2 ml·L-1×58.5 g·ml-1=58.5 g氯化钠固体,不能称量氯化钠的数目,错误;⑧S2和S8的混合物共6.4 g,含有S原子的物质的量为eq \f(6.4 g,32 g·ml-1)=0.2 ml,其中所含硫原子数一定为0.2NA,正确。
【答案】A
例题2、用NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
①31g白磷中含有1.5NA个P-P
②1L0.1 ml/L的Na2CO3溶液中含阴离子总数为0.1NA个
③标准状况下,22.4 L HF含NA个分子
④电解精炼铜时转移了NA个电子,阳极溶解32 g铜
⑤标准状况下,2.24 L Cl2溶于水,转移的电子数目为0.1NA
⑥常温下,含0.2 ml H2SO4的浓硫酸与足量铜反应,生成SO2的分子数小于0.1 NA
⑦142gNa2SO4和Na2HPO4固体混合物中,阴、阳离子总数为3NA
⑧NA个Fe(OH)3胶体粒子的质量为107g
A. ①③④⑧ B. ①⑥⑦ C. ③⑤⑦ D. ①⑥⑧
【解析】①1ml白磷中含有6 ml P-P键,31g白磷(0.25ml)中含有P-P键1.5NA个,正确;②CO32-+H20HCO3-+OH-,1个CO32-水解产生2个阴离子,溶液中阴离子总数增大,所以1L、0.1 ml/L的Na2CO3溶液中含阴离子总数大于为0.1NA个,错误;③标准状况下,HF为液体,不能计算,错误;④粗铜中含有锌、铁、银等杂质,锌、铁先失电子,反应完成后,铜再失电子,阳极溶解铜小于32 g,错误;⑤氯气和水反应为可逆反应,0.1ml氯气反应转移电子数小于0.1NA,错误;⑥浓硫酸与足量铜加热反应,随着反应的进行,浓硫酸变为稀硫酸,稀硫酸与铜不反应,所以生成SO2的分子数小于0.1 NA,错误;⑦142g全为Na2SO4 ,含有阴、阳离子总数为3NA,142g全为Na2HPO4,含有阴、阳离子总数为3NA,142gNa2SO4和Na2HPO4固体混合物中,阴、阳离子总数为3NA,正确;⑧胶体粒子为很多微粒的集合体,NA个Fe(OH)3胶体粒子的质量为大于107g;错误。
【答案】B
[解题指导] 判断一定量的物质中所含某种粒子数目的多少,是高考命题的热点之一。命题者青睐将阿伏加德罗常数与气体摩尔体积(涉及外界条件、物质状态等)、物质结构(涉及质子数、中子数、电子数、化学键数等)、电离与水解(涉及弱电解质的电离特点及盐类的水解特点、溶液中离子浓度)、氧化还原反应(涉及电子转移数目)、可逆反应等结合。阿伏加德罗常数类试题具有较强的综合性,在复习备考中除了需要注意相关的解题技巧外,还需要对相关知识有比较深入的认识,将知识准确、合理的应用。以阿伏加德罗常数为基础点进行辐射,将相关知识总结归纳,在准确把握各量与阿伏加德罗常数之间关系的前提下,着重关注易错点,并通过练习加强理解掌握,这样才能通过复习切实提高得分率。同时还要注意以下细微易错之处:
1.注意外界条件和物质状态:若题目给出的是物质的体积,则要注意外界条件和物质的状态,如水在标准状况下为液态、SO3在标准状况下为固态、标准状况下碳原子数大于4的烃为液态或固态;气体的体积受温度和压强的影响,应用阿伏加德罗常数时,要注意条件是否是标准状况,是否是同温同压;物质的量、质量不受任何条件的影响,如任何条件下2 g H2的物质的量必是1 ml,所含分子数为NA,1 ml H2在任何条件下其质量都为2 g,所含分子数为NA。
2.明确物质的组成和结构:特殊物质的原子个数、电子个数,如Ne、O3等;特殊物质的摩尔质量,如D2O、18O2等;−些物质中的化学键数目,如SiO2、CH4、CO2等;最简式相同的物质中的微粒数目与物质的组成有关,如NO2和N2O4、乙烯和丙烯等;摩尔质量相同的物质中的分子数相同,原子数不一定相同,如:N2、CO、C2H4等;物质中所含化学键的数目与物质的结构有关,如H2O2、CnH2n+2中化学键的数目分别为3、3n+1。
3.注意氧化还原反应中的微粒:考查指定物质参加氧化还原反应时,常设置氧化还原反应中氧化剂、还原剂、氧化产物、还原产物、被氧化、被还原、电子转移(得失)数目方面的陷阱。如Na2O2、NO2与H2O的反应;电解AgNO3溶液、CuSO4溶液的反应;Cl2与H2O、NaOH、Fe的反应等等,分析该类题目时还要注意反应产物以及过量计算问题。
4.弱电解质的电离或盐类的水解:考查电解质溶液中粒子数目及粒子浓度大小关系时,常涉及弱电解质的电离平衡及盐类的水解平衡。弱电解质在水溶液中部分电离;可水解的盐溶液中,离子发生微弱水解,电离产生的离子数量均小于理论数量。如1 L 0.1 ml·L-1的乙酸溶液和1 L 0.1 ml·L-1的乙酸钠溶液中CH3COO-的数目不相等且都小于0.1NA。
5.一些特殊的反应:如一氧化氮和氧气不需要条件即可反应,二氧化氮和四氧化二氮之间存在相互转化,合成氨反应属于可逆反应等。
1.(2022·辽宁·高考真题)设为阿伏加德罗常数的值。下列说法正确的是
A.中含有的中子数为
B.分子中含有的键数目为
C.标准状况下,气体中数目为
D.的溶液中数目为
2.(2022·浙江·高考真题)设NA为阿伏加德罗常数的值,下列说法正确的是
A.在25℃时,1LpH为12的Ba(OH)2溶液中含有OH-数目为0.01NA
B.1.8g重水(D2O)中所含质子数为NA
C.足量的浓盐酸与8.7gMnO2反应,转移电子的数目为0.4NA
D.32g甲醇的分子中含有C—H键的数目为4NA
3.(2021·湖北·高考真题)NA为阿伏加德罗常数的值。下列说法错误的是
A.23gCH3CH2OH中sp3杂化的原子数为NA
B.0.5mlXeF4中氙的价层电子对数为3NA
C.1ml[Cu(H2O)4]2+中配位键的个数为4NA
D.标准状况下,11.2LCO和H2的混合气体中分子数为0.5NA
4.(2021·天津·高考真题)设NA为阿伏加德罗常数的值,下列叙述正确的是
A.1ml/LHCl溶液中,HCl分子的数目为NA
B.22.4L氢气中,H2分子的数目为NA
C.180g葡萄糖中,C原子的数目为6NA
D.1mlN2中,σ键的数目为3NA
5.(2021·浙江·高考真题)设为阿伏加德罗常数的值,下列说法不正确的是
A.标准状况下,中含有中子数为
B.(分子结构:)中的共价键数目为
C.的水溶液中含有氧原子数为
D.三肽(相对分子质量:189)中的肽键数目为
6.(2021·广东·高考真题)设为阿伏加德罗常数的值。下列说法正确的是
A.含有键的数目为
B.的盐酸含有阴离子总数为
C.与混合后的分子数目为
D.与足量反应生成的分子数目为
7.(2021·河北·高考真题)NA是阿伏加德罗常数的值,下列说法错误的是
A.22.4L(标准状况)氟气所含的质子数为18NA
B.1ml碘蒸气和1ml氢气在密闭容器中充分反应,生成的碘化氢分子数小于2NA
C.电解饱和食盐水时,若阴阳两极产生气体的总质量为73g,则转移电子数为NA
D.1L1ml•L-1溴化铵水溶液中NH与H+离子数之和大于NA
8.(2021·湖南·高考真题)为阿伏加德罗常数的值。下列说法正确的是
A.含有的中子数为
B.溶液中含有的数为
C.与在密闭容器中充分反应后的分子数为
D.和(均为标准状况)在光照下充分反应后的分子数为
9.(2012·江苏·高考真题)设NA表示阿伏加德罗常数的值。下列说法正确的是
A.常温常压下,18gH2O中含有的原子总数为3NA
B.标准状况下,0.1mlCl2溶于水,转移的电子数目为0.1NA
C.标准状况下,11.2LCH3CH2OH中含有的分子数目为0.5NA
D.常温常压下,2.24LCO和CO2混合气体中含有的碳原子数目为0.1NA
10.(2022·青海·海东市第一中学二模)设为阿伏加德罗常数的值,下列叙述中正确的是
A.和的混合物中含有硫,则含有的氧原子数为
B.溴化铵水溶液中与数目之和大于
C.电解饱和食盐水时,若阴、阳两极产生气体的总质量为,则转移电子数为
D.80℃时,的硫酸溶液中,含有的数目为
11.(2022·湖北·襄阳五中模拟预测)为阿伏加德罗常数的值。下列说法错误的是
A.和于密闭容器中充分反应后,其分子总数为
B.中键数目为
C.醋酸钠水溶液中与离子数之和略大于
D.标准状况下,乙烯和环丙烷的混合气体中所含原子数小于
12.(2022·江西·模拟预测)设NA为阿伏伽德罗常数,下列有关说法不正确的是
A.1LpH=5的某溶液中,含有H+数目为10-5NA
B.10g质量分数为46%的乙醇水溶液中含有的氧原子数目为0.4NA
C.标准状况下,22.4LHF中含有的原子数为2NA
D.28g乙烯和环丙烷的混合气体中含C-H键的数目为4NA
13.(2022·内蒙古·海拉尔第二中学模拟预测)为阿伏加德罗常数的值。下列说法正确的是
A.1 ml NH4F晶体中含有的共价键数目为3NA
B.常温下,将7.1gCl2通入水中,转移的电子数目为0.1NA
C.12.0g熔融的NaHSO4中含有的阳离子数目为0.2NA
D.和(均为标准状况)在光照下充分反应后的分子数为
14.(2022·江西景德镇·二模)设NA代表阿伏加德罗常数值。下列说法正确的是
A.电解精炼Cu时阳极减少32g时,转移电子数一定为NA
B.100gCaCO3 和KHCO3混合固体含有阳离子数大于NA
C.在溶有0.05mlAlCl3的水溶液中,Al3+所带的电荷总数小于0.15NA
D.100g 质量分数为98%的浓硫酸中氧原子数目为4NA
15.(2022·四川内江·模拟预测)NA表示阿伏加德罗常数的值,下列说法正确的是
A.常温下1L1ml·L-1Na2CO3溶液中含CO的数目小于NA
B.标准状况下,22.4LHF含NA个分子
C.17g-OH与17gOH-所含电子的数目均为10NA
D.0.05ml·L-1NaHSO4溶液中,阳离子的数目之和为0.1NA
16.(2022·湖北·天门市教育科学研究院模拟预测)NA为阿伏伽德罗常数的值,下列说法正确的是
A.1 ml [Ag(NH3)2]+中含有σ键数为8NA
B.标准状况下,2.24LCl2溶于水,转移电子数为0.1NA
C.25°C时,500 mL pH=13的Ba(OH)2溶液中含有OH-的数目为0.1NA
D.1ml苯乙烯中含有sp2杂化碳原子数为2NA
17.(2022·四川省泸县第二中学二模)已知NA是阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,1.12L 18O2中含有的中子数为NA
B.室温下,1 L pH=13的Ba(OH)2溶液中含OH- 的数目为0.2NA
C.3.4g( )中含有的极性键数目0.2NA
D.等物质的量的I2(g)和 H2(g)在密闭容器中充分反应,容器内分子总数一定为2NA
18.(2022·贵州遵义·三模)设NA表示阿伏加德罗常数的值,下列说法正确的是
A.0.1mlI2与lmlH2反应,生成HI分子数为0.2NA
B.25℃时,1L0.2ml/LCH3COONH4溶液(pH=7)中,数为0.2NA
C.标准状况下,11.2L苯中,含有0.5NA个苯分子
D.20gCa2+含有的电子数为9NA
19.(2022·天津·耀华中学一模)2021年,我国科学家首次在实验室实现CO2到淀粉的全合成,其合成路线如图,设NA为阿伏伽德罗常数的值,下列有关说法不正确的是
A.标况下,11.2LCO2中含有共用电子对数目为2NA
B.反应②、③无法在高温下进行
C.反应②中,3.2gCH3OH生成HCHO时转移电子数目为0.2NA
D.量取1ml DHA与乙酸发生取代反应,消耗乙酸分子数目为2NA
20.(2022·陕西商洛·一模)研发CO2利用技术,降低空气中CO2含量成为研究热点。在不同催化剂的作用下,将CO2催化加氢实现资源化利用,由此可获得甲醇、甲烷、乙烯等。设NA为阿伏加德罗常数的值,下列说法正确的是
A.8 g CH3OH中含有共用电子对的数目为1. 25NA
B.标准状况下,22 g CO2中含有的原子数为0. 5NA
C.等物质的量的CH3OH和CH4,CH3OH的质子数比CH4多8 NA
D.常温下,NA个H2分子所占的体积约为22.4 L
21.(2022·黑龙江·哈尔滨三中三模)NA代表阿伏加德罗常数的值。下列叙述正确的是
A.60g丙醇中存在的碳氢键总数为8NA
B.钠在空气中燃烧可生成多种氧化物,23g钠充分燃烧时转移电子数为1NA
C.1 L0.1ml·L-1的NaHCO3溶液中和的离子数之和为0.1 NA
D.235g 核素U发生裂变反应:U+n Sr+ Xe + 10n, 净产生的中子(n)数为10 NA
22.(2022·湖南·长郡中学模拟预测)2021年9月24日,中科院天津工业生物技术研究所成果——“无细胞化学酶系统催化合成淀粉”在国际学术期刊《自然》上发表。其中一步核心反应如图所示,设为阿伏加德罗常数的值。
下列说法错误的是
A.30g HCHO与DHA的混合物中所含氧原子数为2
B.反应①中消耗,转移电子数为6
C.1ml DHA分子含极性共价键9ml
D.1ml淀粉完全水解消耗n ml水分子
23.(2022·陕西省安康中学高三阶段练习)表示阿伏加德罗常数的值。俗名为“臭碱”的硫化钠广泛应用于冶金染料、皮革、电镀等工业。硫化钠的一种制备方法是。下列有关说法正确的是
A.12g石墨晶体含碳碳键数
B.1L溶液中含阴离子的数目小于
C.生成1ml氧化产物时转移电子数为
D.通常状况下中含质子的数目为
24.(2022·湖北·高三阶段练习)是21世纪理想的能源,工业上制备氢气的常见方法有以下三种:①电解水法制备;②水煤气法制备;③电解饱和食盐水法制备。设NA为阿伏加德罗常数的值,下列说法正确的是
A.方法①中,当阴极产生a ml气体时,转移的电子数为4aNA
B.方法②中,制备22.4L时,断裂的极性键的数目为NA
C.方法③中,每电解117gNaCl时,产生的气体的分子数为NA
D.用这三种方法分别制备1ml,转移的电子数均为2NA
25.(2022·广东·高三开学考试)如图所示为乙烯在催化作用下制备聚乙烯的反应过程,设为阿伏加德罗常数的值,下列相关说法不正确的是
A.聚乙烯含有个键
B.每消耗一个乙烯分子,含R的碳链增加两个碳原子
C.总反应属于加聚反应
D.反应过程中涉及配位键的形成与断裂,也涉及键的形成与断裂
参考答案
1.A【详解】A.1个原子中含有10个中子,的物质的量为,故中含有中子的物质的量为,中子数为,故A正确;
B.乙烯分子的结构式为,1个乙烯分子中含有5个键, 的物质的量为,所以分子中含有的键数目为,B错误;
C.是共价化合物,分子中不存在,故C错误;
D.没有给出溶液的体积,无法计算的溶液中的数目,故D错误;
选A。
2.A【详解】A.1LpH为12的Ba(OH)2溶液中含有OH-的浓度为0.01ml/L,物质的量0.01ml/L 1L=0.01ml,OH-的数目为0.01NA,A正确;
B.1.8g重水(D2O)的物质的量为:0.09ml,所含质子数为0.9NA,B错误;
C.足量的浓盐酸与8.7gMnO2(0.1ml)反应,+4价Mn转化生成Mn2+,转移电子的数目为0.2NA,C错误;
D.甲醇的结构简式为:CH3OH,32g (1ml)的分子中含有C—H键的数目为3NA,D错误;
答案选A。
3.A【详解】A.中C和O均为杂化,23g乙醇为0.5ml,杂化的原子数为,选项A错误;
B.中氙的孤电子对数为,价层电子对数为,则中氙的价层电子对数为,选项B正确;
C.1个中含有4个配位键,1ml含配位键的个数为,选项C正确;
D.标准状况下。11.2LCO和的混合气体为0.5ml,分子数为,选项D正确。
答案选A。
4.C【详解】A.体积未知,HCl分子的数目不能计算,故A错误;
B.没有标准状态,不能计算H2分子的数目,故B错误;
C.葡萄糖的分子式为C6H12O6,故180g葡萄糖的分子的物质的量为1ml,C原子的数目为6NA,故C正确;
D.1mlN2中有1mlσ键,故σ键的数目为NA,故D错误;
故选C。
5.C【详解】A.标准状况下,的物质的量为:0.05ml,一个中含有中子数为:个,所以中含有中子数为,A正确;
B.的物质的量为:0.25ml,根据白磷的分子结构可知一个白磷分子里含有六条共价键,所以共价键数目为:,B正确;
C.的水溶液中含有溶质氢氧化钠和溶剂水,氧原子数目为二者氧原子数目的加和,C错误;
D.三肽的物质的量为:0.1ml,三分子氨基酸脱水缩合形成三肽,三肽中含有两个肽键,所以三肽中的肽键数目为,D正确;
答案为:C。
6.A【详解】A.1个分子中含有3个键,微粒个数与物质的量成正比,故含有3ml键,键的数目为,A正确;
B.盐酸为氯化氢的水溶液,氯化氢会全部电离出阴离子Cl-,水会部分电离出阴离子OH-,水的质量及电离程度未知,故无法计算的盐酸含有阴离子总数,B错误;
C.未提到具体的温度、压强(如标况下),故无法计算与混合后的分子数目,C错误;
D.为1ml,钠与足量的水反应生成氢气的关系式为:,故1ml Na应对应生成0.5ml H2,分子数目应为0.5,D错误;
故选A。
7.C【详解】A.在标准状况下氟气的物质的量为1ml,其质子数为1ml=,A正确;
B.碘蒸气与氢气发生的反应为:,反应为可逆反应,有一定的限度,所以充分反应,生成的碘化氢分子数小于,B正确;
C.电解饱和食盐水时电极总反应为:2NaCl+2H2O2NaOH+H2↑+Cl2↑,若阴阳两极产生气体分别是氢气与氯气,且物质的量之比为1:1,若气体的总质量为,则说明反应生成的氢气与氯气的物质的量各自为1ml,根据关系式H22e-可知,转移的电子数为,C错误;
D.溴化铵水溶液存在电荷守恒,即c()+c()=c(Br-)+c(OH-),则物质的量也满足n()+n()=n(Br-)+n(OH-),因为n(Br-)=,所以该溶液中与离子数之和大于,D正确;
故选C。
8.D【详解】A.的物质的量为=0.9ml,1个含0+(18-8)=10个中子,则含有的中子数为,A错误;
B.未给溶液体积,无法计算,B错误;
C.存在2NO+O2=2NO2,2NO2N2O4,因此与在密闭容器中充分反应后的分子数小于,C错误;
D.甲烷和氯气在光照下发生取代,1ml氯气可取代1mlH,同时产生1mlHCl分子,标准状况下的物质的量为0.5ml,的物质的量为1ml,0.5mlCH4含4mlH,最多可消耗4mlCl2,因此CH4过量,根据1ml氯气可取代1mlH,同时产生1mlHCl分子可知1mlCl2完全反应可得1mHCl,根据C守恒,反应后含C物质的物质的量=甲烷的物质的量=0.5ml,因此和(均为标准状况)在光照下充分反应后的分子数为,D正确;
选D。
9.A【详解】A.常温常压下,18gH2O的物质的量为1ml,一个分子中含有3个原子,则含有的原子总数为3NA,A说法正确;
B.标准状况下,0.1mlCl2溶于水,少量的氯气与水反应,则转移的电子数目无法确定,B说法错误;
C.标准状况下,CH3CH2OH为液体,则11.2LCH3CH2OH的物质的量大于0.5ml,则含有的分子数目大于0.5NA,C说法错误;
D.常温常压下,气体摩尔体积大于22.4L/ml,则2.24LCO和CO2混合气体的物质的量小于0.1ml,则含有的碳原子数目小于0.1NA,D说法错误;
答案为A。
10.B【详解】A.根据二者化学式和,的物质的量为,则,,,即,A项错误;
B.溴化铵水溶液中存在,水解消耗的数和生成的数是相等的,另外还存在水的电离:,所以溶液中与物质的量之和大于,即离子数大于,B项正确;
C.电解饱和食盐水时,阴极产生氢气,阳极产生氯气,电极反应分别为,,又两极产生气体的总质量为36.5g,可知生成的为,生成的为35.5g,则转移电子的物质的量为1ml,数目为,C项错误;
D.80℃时水的离子积大于,的硫酸溶液中,氢氧根离子的浓度大于,故溶液中氢氧根离子的数目大于,D项错误;
故选B。
11.C【详解】A. 和于密闭容器中充分反应后,其分子总数小于,A正确;
B.乙醇中的碳原子、氧原子的价层电子对数均为4,故均为sp3杂化、1个乙醇分子内键数目为6,则即0.5ml中键数目为,B正确;
C.醋酸钠水溶液体积不知道,难以计算与离子数之和,C错误;
D. 标准状况下,即0.5ml乙烯和环丙烷的混合气体中所含原子数范围为、所含原子数小于,D正确;
答案选C。
12.C【详解】A.溶液中c(H+)浓度为1×10-5ml/L,溶液体积为1L,则n(H+)为1×10-5ml,H+数目为10-5NA,A项正确;
B.乙醇水溶液中除乙醇中含氧原子外,H2O中还含有氧原子,10g46%的乙醇中,n(CH3CH2OH)为0.1ml,H2O质量为5.4g,H2O的物质的量为0.3ml,则溶液中氧原子数目为0.4NA,B项正确;
C.HF在标准状况下不是气体,则22.4LHF无法确定其物质的量,更无法知道原子数,C项错误;
D.乙烯和环丙烷的最简式均为CH2,则28gCH2的物质的量为2ml,所以C-H键数目为4NA,D项正确。
故答案选C。
13.D【详解】A.NH中含有4个共价键,1 ml NH4F晶体中含有的共价键数目为4NA,故A错误;
B.氯气和水反应生成盐酸和次氯酸,该反应可逆,常温下,将7.1gCl2通入水中,转移的电子数目小于0.1NA,故B错误;
C.熔融状态下NaHSO4电离出,12.0g熔融的NaHSO4中含有的阳离子数目为0.1NA,故C错误;
D.氯气和甲烷发生取代反应生成氯代甲烷核外氯化氢,反应前后气体分子数不变,和(均为标准状况)在光照下充分反应后的分子数为,故D正确;
选D。
14.C【详解】A.电解精炼铜,阳极铁、锌优先铜放电,所以电解精炼Cu时阳极减少32g时,转移电子数不一定为NA,A项错误;
B.碳酸钙和碳酸氢钾摩尔质量都是100g/ml,1ml固体都含有1ml阳离子,则100gCaCO3 和KHCO3混合固体物质的量为1ml,含有阳离子数等于NA,B项错误;
C.铝离子在水中会水解为氢氧化铝,则在溶有0.05mlAlCl3的水溶液中,Al3+所带的电荷总数小于0.15NA,C项正确;
D.100g 质量分数为98%的浓硫酸中硫酸的质量为98g,其物质的量为1ml,则硫酸中氧原子数目为4NA,但是水中还含有氧原子,则总的氧原子数目大于4NA,D项错误;
答案选C。
15.A【详解】A.Na2CO3溶液中CO水解后离子数目减少,故含0.1mlNa2CO3溶液中CO的数目小于NA,故A正确;
B.标准状况下,HF不是气体,故无法计算其物质的量,故B错误;
C.1个-OH中含有9个电子,故17g-OH所含电子的数目均为9NA,故C错误;
D.NaHSO4溶液的体积未知,故无法计算其物质的量,故D错误;
故选A。
16.A【详解】A. [Ag(NH3)2]+中含有N-Hσ键、N-Agσ键,1 ml [Ag(NH3)2]+中含有σ键数为8NA,故A正确;
B. 氯气与水反应是可逆反应,标准状况下,2.24LCl2溶于水,转移电子数小于0.1NA,故B错误;
C. 25°C时,500 mL pH=13的Ba(OH)2溶液中含有OH-的数目为0.1ml/L×0.5L×NA=0.05NA,故C错误;
D. 苯乙烯分子中的8个碳原子均为sp2,1ml苯乙烯中含有sp2杂化碳原子数为8NA,故D错误;
故选A。
17.A【详解】A.标准状况下,1.12L 18O2物质的量,每个18O2含有的中子数(18-8)×2=20,所以0.05ml18O2含有的中子数为NA,A项正确;
B.室温下,1 L pH=13的Ba(OH)2溶液中含c(H+ )为10-13ml/L,根据水的离子积常数可得c(OH- )为0.1ml/L,所以含OH-的数目为0.1NA,B项错误;
C.的分子式为C4H4O,3.4g的物质的量,每个含有4个C—H和2个C—O即6个极性键,所以0.05ml的含有的极性键数目0.3NA,C项错误;
D.等物质的量的I2(g)和 H2(g)在密闭容器中充分反应,但是不知道具体的物质的量,所以无法确定分子数目,D项错误;
故答案选:A。
18.D【详解】A. 0.1mlI2与lmlH2反应,是可逆反应,生成HI分子数小于0.2NA,故A错误;
B. 25℃时,1L0.2ml/LCH3COONH4溶液(pH=7)中,部分水解,数少于0.2NA,故B错误;
C. 标准状况下,11.2L苯为液态,不能用气体摩尔体积计算苯分子,故C错误;
D. 20gCa2+含有的电子数为=9NA,故D正确;
故选D。
19.D【详解】A.1个CO2含有4个共用电子对,所以标况下,11.2LCO2中含有共用电子对数目为=2NA,A正确;
B.反应②、③均在酶催化作用下发生反应,温度过高,酶会失活,所以不能在高温下进行,B正确;
C.反应②中,若1mlCH3OH生成HCHO,转移电子的物质的量为2ml,3.2gCH3OH生成HCHO时转移电子数目为=0.2NA,C正确;
D.根据上图可知,1mlDHA中含2ml羧基,但酯化反应是可逆反应,所以量取1ml DHA与乙酸发生取代反应,消耗乙酸分子数目少于2NA,D错误;
故选D。
20.A【详解】A.1个CH3OH中含5对共用电子对,8gCH3OH物质的量为=0.25ml,则所含共用电子对的数目为1.25NA,A项正确;
B.22gCO2物质的量为=0.5ml,所含原子数为1.5NA,B项错误;
C.1个CH3OH分子比1个CH4分子多8个质子,但CH3OH和CH4物质的量未知,不能计算等物质的量的CH3OH和CH4质子数的差值,C项错误;
D.NA个H2分子物质的量为1ml,但H2所处压强未知,不能计算H2的体积,D项错误;
答案选A。
21.B【详解】A. 60g丙醇的物质的量为1ml,存在的碳氢键总数为(3+2+2)NA =7NA,A错误;
B. 钠在空气中燃烧可生成多种氧化物,23g钠的物质的量为1ml,充分燃烧时生成+1价的钠离子,转移电子数为1NA,B正确;
C. 1 L0.1ml·L-1的NaHCO3溶液中、、H2CO3的个数之和为0.1 NA,C错误;
D. 235g 核素U的物质的量为1ml,发生裂变反应:U+n Sr+ Xe + 10n, 净产生的中子(n)数为9 NA,D错误;
故选B。
22.A【详解】转化过程中各步反应方程式分别为:①;②;③;④。
A.HCHO与DHA的最简式相同,均为CH2O,30g HCHO与DHA的混合物的物质的量为1ml,所含氧原子数为,故A错误;
B.反应①消耗,同时消耗,转移电子数为,故B正确;
C.DHA的结构简式为,一个DHA分子含9个极性共价键,则1ml DHA分子含9ml极性共价键,故C正确;
D.淀粉水解的方程式为,1ml淀粉完全水解消耗n ml水分子,故D正确;
答案选A。
23.C【详解】A.石墨中1个C对应1.5个碳碳键,即12g石墨晶体中含有碳碳键的数目为1.5NA,A项错误;
B.1L 0.1ml/L Na2S溶液中含有0.1ml Na2S,硫离子水解生成HS-和氢氧根离子,阴离子的数目大于0.1NA,B项错误;
C.根据方程式,氧化产物为二氧化碳,生成1ml氧化产物时转移电子数为4NA,C项正确;
D.通常状况下,气体摩尔体积不是22.4L/ml,故11.2L CO2物质的量不是0.5ml,所含质子的数目不是11NA,D项错误;
答案选C。
24.D【详解】A.方法①为电解水法,阴极发生还原反应产生H2,amlH2生成转移电子数为2aNA,A错误;
B.未说明标准状况,气体体积不能进行计算,B错误;
C.电解117gNaCl即2ml将生成1mlCl2和1mlH2,共2ml气体,C错误;
D.这三种方法对应的三个氧化还原反应中H2O都只作且是唯一的氧化剂,H2O中的H元素得2ml电子生成1mlH2,D正确;
答案选D。
25.A【详解】A.乙烯中有键,聚乙烯中没有键,选项A错误;
B.每消耗一个乙烯分子,含R的碳链增加一个结构,增长两个碳原子,选项B正确;
C.总反应是,属于加聚反应,选项C正确;
D.乙烯分子中的键断裂并与之间形成配位键,R与之间有键的断裂,与形成,R与C之间也形成了键,选项D正确;
答案选A。
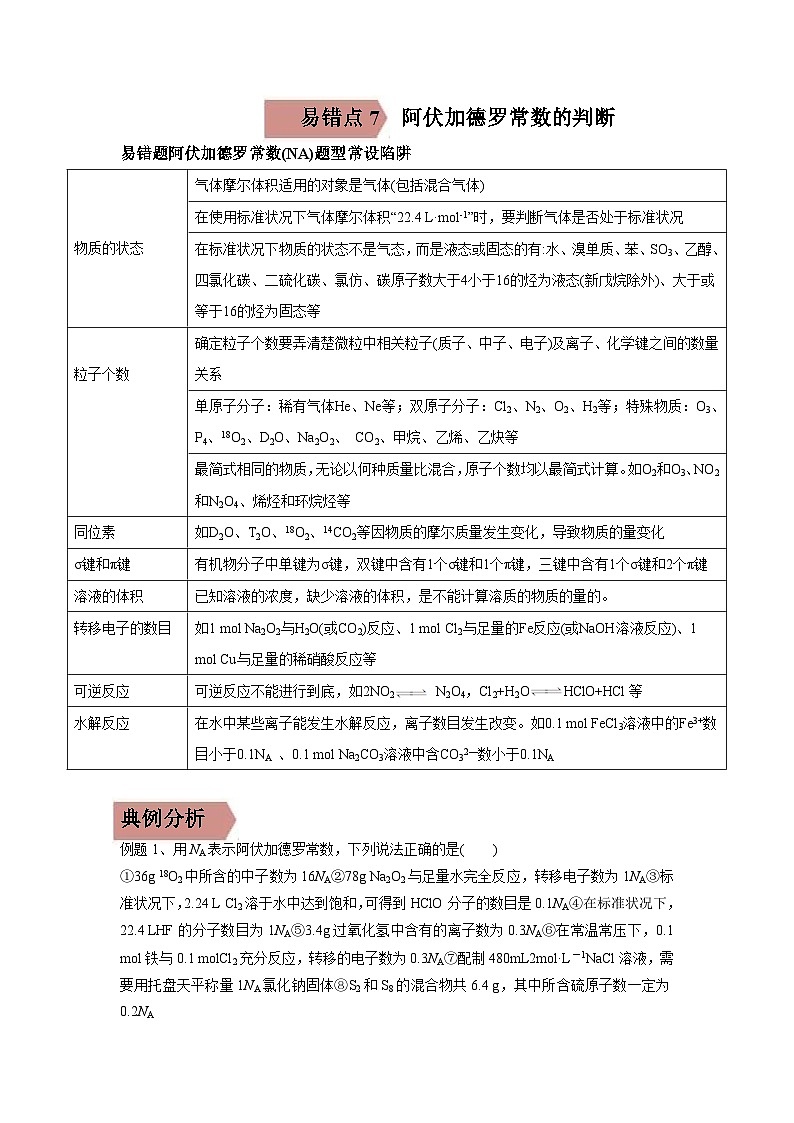
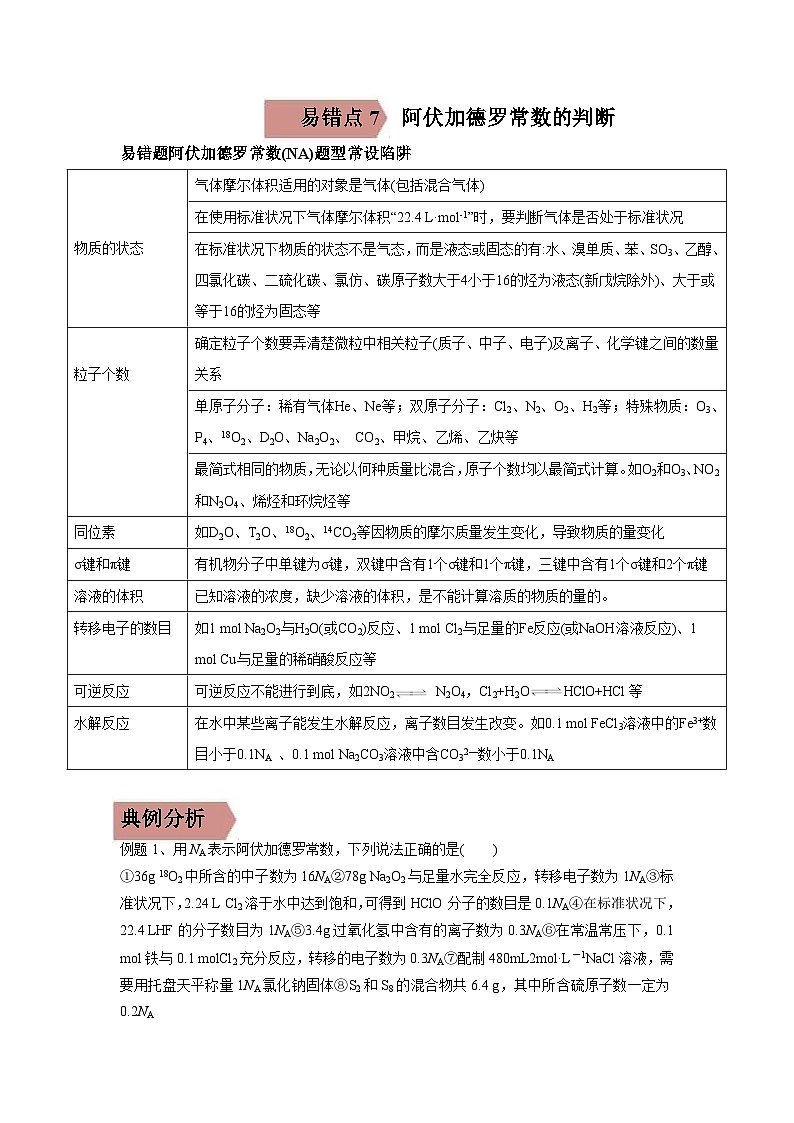
物质的状态
气体摩尔体积适用的对象是气体(包括混合气体)
在使用标准状况下气体摩尔体积“22.4 L·ml-1”时,要判断气体是否处于标准状况
在标准状况下物质的状态不是气态,而是液态或固态的有:水、溴单质、苯、SO3、乙醇、四氯化碳、二硫化碳、氯仿、碳原子数大于4小于16的烃为液态(新戊烷除外)、大于或等于16的烃为固态等
粒子个数
确定粒子个数要弄清楚微粒中相关粒子(质子、中子、电子)及离子、化学键之间的数量关系
单原子分子:稀有气体He、Ne等;双原子分子:Cl2、N2、O2、H2等;特殊物质:O3、P4、18O2、D2O、Na2O2、 CO2、甲烷、乙烯、乙炔等
最简式相同的物质,无论以何种质量比混合,原子个数均以最简式计算。如O2和O3、NO2和N2O4、烯烃和环烷烃等
同位素
如D2O、T2O、18O2、14CO2等因物质的摩尔质量发生变化,导致物质的量变化
σ键和π键
有机物分子中单键为σ键,双键中含有1个σ键和1个π键,三键中含有1个σ键和2个π键
溶液的体积
已知溶液的浓度,缺少溶液的体积,是不能计算溶质的物质的量的。
转移电子的数目
如1 ml Na2O2与H2O(或CO2)反应、1 ml Cl2与足量的Fe反应(或NaOH溶液反应)、1 ml Cu与足量的稀硝酸反应等
可逆反应
可逆反应不能进行到底,如2NO2 N2O4,Cl2+H2OHClO+HCl等
水解反应
在水中某些离子能发生水解反应,离子数目发生改变。如0.1 ml FeCl3溶液中的Fe3+数目小于0.1NA 、0.1 ml Na2CO3溶液中含CO32—数小于0.1NA
高考化学热点试题热点04有关阿伏加德罗常数的正误判断含解析答案: 这是一份高考化学热点试题热点04有关阿伏加德罗常数的正误判断含解析答案,共8页。试卷主要包含了为阿伏加德罗常数的值,火箭表面耐高温涂层的制备反应为,设为阿伏加德罗常数的值,设NA为阿伏加德罗常数的值等内容,欢迎下载使用。
阿伏加德罗常数的判断-2024年高考化学二轮热点题型: 这是一份阿伏加德罗常数的判断-2024年高考化学二轮热点题型,文件包含阿伏加德罗常数的判断解析版pdf、阿伏加德罗常数的判断学生版pdf等2份试卷配套教学资源,其中试卷共51页, 欢迎下载使用。
新高考化学二轮复习重难点05 阿伏加德罗常数的相关判断(含解析): 这是一份新高考化学二轮复习重难点05 阿伏加德罗常数的相关判断(含解析),共15页。试卷主要包含了气体摩尔体积 阿伏加德罗定律等内容,欢迎下载使用。












