

2025届高三化学一轮复习课时小练:硫及其化合物的相互转化
展开
这是一份2025届高三化学一轮复习课时小练:硫及其化合物的相互转化,共13页。试卷主要包含了选择题,综合题等内容,欢迎下载使用。
1.自然界中不同价态硫元素之间的转化如图所示,下列说法正确的是( )
A.上图中,酸雨的含硫成分只有H2SO3,由SO2溶于水生成
B.芒硝在浓硫酸中失水的过程体现了浓硫酸的脱水性
C.黄铁矿燃烧产生的尾气,与空气混合后通入碳酸钙的浆状物,可用来制备石膏
D.凝聚法是将SO2通入H2S稀溶液中得到S胶体,该反应中氧化剂与还原剂的物质的量之比为2∶1
2.三大化石燃料燃烧会产生大气污染物,特别是含硫煤燃烧后产生的SO2危害巨大。为了保护环境,科学家提出了下列解决方法,同时还能获得某种重要的工业产品。下列说法错误的是( )
A.不用O2直接氧化SO2是因为氧化速率太慢
B.图中涉及的反应之一为4FeSO4+O2+2H2SO4===2Fe2(SO4)3+2H2O
C.反应一段时间后,溶液中Fe2(SO4)3的浓度会减小
D.理论上每吸收标况下224 mL SO2可以获得0.98 g H2SO4
3.《环境科学》曾刊发我国科研部门采用零价铁活化过二硫酸钠(Na2S2O8,其中S为+6价)去除废水中的正五价砷的研究成果,其反应机理模型如图,(设NA为阿伏加德罗常数的值)下列说法正确的是( )
A.1 ml SOeq \\al(-,4)· (自由基)中含50NA个电子
B.pH越大,越不利于去除废水中的正五价砷
C.1 ml过二硫酸钠中含NA个过氧键
D.转化过程中,若共有1 ml S2Oeq \\al(2-,8)被还原,则参加反应的Fe为56 g
4.自然界中的分解者可将含硫有机物分解为H2S,硫黄细菌和硫化细菌可将H2S进一步变为硫单质或硫酸盐,下列关于硫化氢的说法正确的是( )
A.H2S是一种无色、有臭鸡蛋气味的有毒气体
B.H2S分子中所有原子的最外层都达到8电子结构
C.将H2S通入FeSO4溶液中,产生沉淀
D.H2S分子很稳定,受热难分解
5.用下列两种途径制取H2SO4,某些反应条件和产物已省略,下列有关说法不正确的是( )
途径① Seq \(――→,\s\up7(浓硝酸))H2SO4,
途径② Seq \(――→,\s\up7(O2))SO2eq \(――→,\s\up7(O2))SO3eq \(――→,\s\up7(H2O))H2SO4
A.途径①反应中体现了浓硝酸的强氧化性和酸性
B.途径②的第二步反应在实际生产中可以通过增大O2的浓度来降低成本
C.由途径①和②分别制取1 ml H2SO4,理论上各消耗1 ml S,各转移6 ml电子
D.途径②与途径①相比更能体现“绿色化学”的理念
6.下列反应能产生SO2的是( )
①煅烧黄铁矿 ②亚硫酸钠与浓硫酸反应 ③点燃硫化氢气体 ④蔗糖和浓硫酸反应
A.①②③B.②④
C.②③④D.①②③④
7.硫在空气中燃烧生成气体A,把A溶于水得溶液B,向B中滴加溴水,溴水褪色,B变成C,向C中加Na2S产生气体D,把D通入B溶液得浅黄色沉淀E。A、B、C、D、E都含同一种元素。按A、B、C、D、E顺序排列的是( )
A.SO2、H2SO4、H2SO3、H2S、S
B.SO2、H2SO3、H2SO4、H2S、S
C.SO2、H2SO3、H2SO4、SO3、Na2S2O3
D.SO3、H2SO4、H2SO3、SO2、Na2S2O3
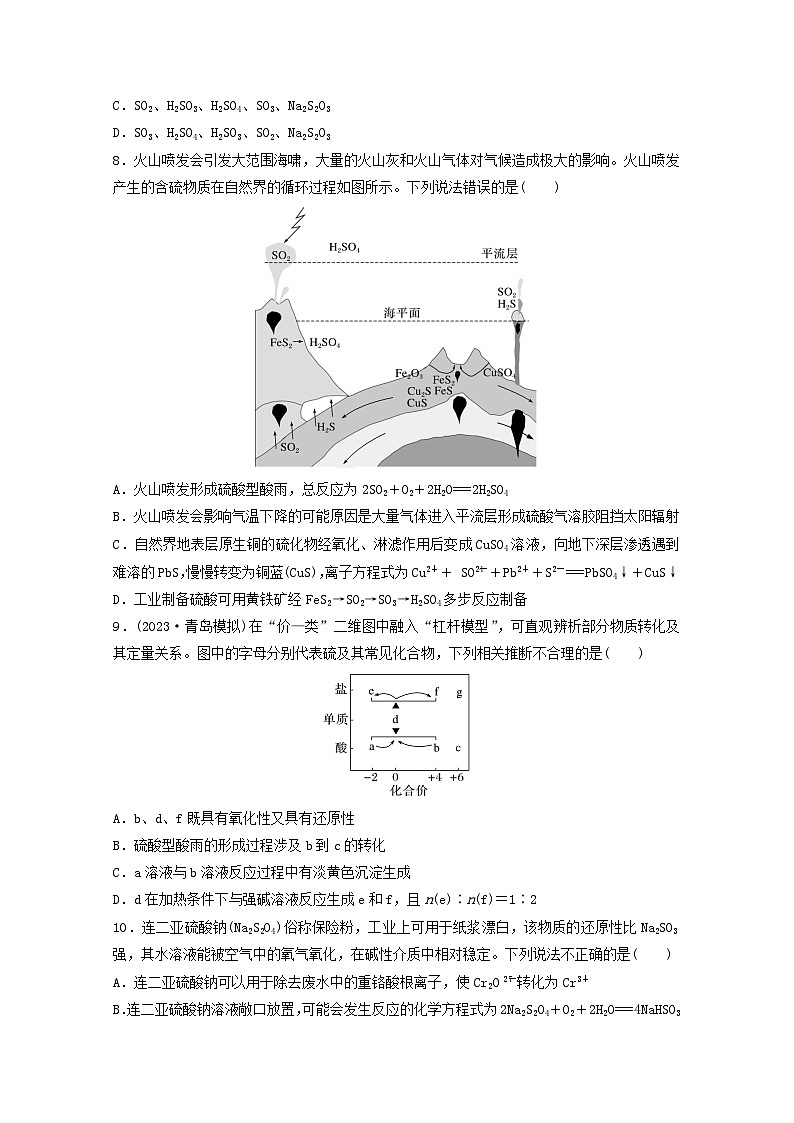
8.火山喷发会引发大范围海啸,大量的火山灰和火山气体对气候造成极大的影响。火山喷发产生的含硫物质在自然界的循环过程如图所示。下列说法错误的是( )
A.火山喷发形成硫酸型酸雨,总反应为2SO2+O2+2H2O===2H2SO4
B.火山喷发会影响气温下降的可能原因是大量气体进入平流层形成硫酸气溶胶阻挡太阳辐射
C.自然界地表层原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液,向地下深层渗透遇到难溶的PbS,慢慢转变为铜蓝(CuS),离子方程式为Cu2++ SOeq \\al(2-,4)+Pb2++S2-===PbSO4↓+CuS↓
D.工业制备硫酸可用黄铁矿经FeS2→SO2→SO3→H2SO4多步反应制备
9.(2023·青岛模拟)在“价—类”二维图中融入“杠杆模型”,可直观辨析部分物质转化及其定量关系。图中的字母分别代表硫及其常见化合物,下列相关推断不合理的是( )
A.b、d、f既具有氧化性又具有还原性
B.硫酸型酸雨的形成过程涉及b到c的转化
C.a溶液与b溶液反应过程中有淡黄色沉淀生成
D.d在加热条件下与强碱溶液反应生成e和f,且n(e)∶n(f)=1∶2
10.连二亚硫酸钠(Na2S2O4)俗称保险粉,工业上可用于纸浆漂白,该物质的还原性比Na2SO3强,其水溶液能被空气中的氧气氧化,在碱性介质中相对稳定。下列说法不正确的是( )
A.连二亚硫酸钠可以用于除去废水中的重铬酸根离子,使Cr2Oeq \\al(2-,7)转化为Cr3+
B.连二亚硫酸钠溶液敞口放置,可能会发生反应的化学方程式为2Na2S2O4+O2+2H2O===4NaHSO3
C.连二亚硫酸钠用于纸浆漂白的原理与ClO2的漂白原理相同
D.在包装保存保险粉时加入少量Na2CO3固体,可以提高保险粉的稳定性
11.硫是生物必需的营养元素之一,下列关于自然界中硫循环(如图所示)的说法正确的是( )
A.含硫杆菌及好氧/厌氧菌促进了硫的循环
B.硫循环中含硫化合物均为无机物
C.上述硫循环中硫元素均被氧化
D.烧煤时加石灰石,可减少酸雨及温室气体的排放
12.实验室通过如图所示装置制备Na2S2O3,反应原理:2Na2S+Na2CO3+4SO2===3Na2S2O3+CO2。下列有关说法错误的是( )
A.导管a的作用是有利于硫酸滴入
B.装置A中的反应体现硫酸的酸性
C.装置B、D作用完全相同
D.装置C中先有淡黄色浑浊产生,后又变澄清,说明过程中有硫单质生成
二、综合题
13.硫代硫酸钠在纺织业等领域有广泛应用。某兴趣小组用下图装置制备Na2S2O3·5H2O。
合成反应:SO2+Na2CO3===Na2SO3+CO2 2Na2S+3SO2===2Na2SO3+3S
Na2SO3+Seq \(=====,\s\up7(△))Na2S2O3
滴定反应:I2+2Na2S2O3===2NaI+Na2S4O6
已知:Na2S2O3·5H2O易溶于水,难溶于乙醇,50 ℃开始失结晶水。
实验步骤:
Ⅰ.Na2S2O3制备:装置A制备的SO2经过单向阀通入装置C中的混合溶液,加热、搅拌,至溶液pH约为7时,停止通入SO2气体,得产品混合溶液。
Ⅱ.产品分离提纯:产品混合溶液经蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得到Na2S2O3·5H2O产品。
Ⅲ.产品纯度测定:以淀粉作指示剂,用Na2S2O3·5H2O产品配制的溶液滴定碘标准溶液至滴定终点,计算Na2S2O3·5H2O含量。
请回答:
(1)步骤Ⅰ单向阀的作用是____________________;装置C中的反应混合溶液pH过高或过低将导致产率降低,原因是_______________________________________________________。
(2)步骤Ⅱ下列说法正确的是________。
A.快速蒸发溶液中水分,可得较大晶体颗粒
B.蒸发浓缩至溶液表面出现晶膜时,停止加热
C.冷却结晶后的固液混合物中加入乙醇可提高产率
D.可选用冷的Na2CO3溶液作洗涤剂
(3)步骤Ⅲ
①滴定前,有关滴定管的正确操作为(选出正确操作并按序排列):
检漏→蒸馏水洗涤→( )→( )→( )→( )→( )→开始滴定。
A.烘干
B.装入滴定液至零刻度以上
C.调整滴定液液面至零刻度或零刻度以下
D.用洗耳球吹出润洗液
E.排除气泡
F.用滴定液润洗2至3次
G.记录起始读数
②装标准碘溶液的碘量瓶(带瓶塞的锥形瓶)在滴定前应盖上瓶塞,目的是_____________________________________________________________________________。
③滴定法测得产品中Na2S2O3·5H2O含量为100.5%,则Na2S2O3·5H2O产品中可能混有的物质是________。
14.实验小组制备焦亚硫酸钠(Na2S2O5)并探究其性质。
资料:焦亚硫酸钠为白色晶体,可溶于水。
(1)制备Na2S2O5(夹持装置略)
①A为SO2发生装置,A中反应的化学方程式是
________________________________。
②将尾气处理装置C补充完整并标明所用试剂。
(2)探究Na2S2O5的性质
①由实验Ⅰ可知,Na2S2O5溶于水,溶液呈酸性的原因是_____________________________
______________________________________________________________________________
(用化学方程式表示)。
②实验Ⅱ中向白色沉淀中滴加过量盐酸,沉淀溶解,用平衡原理解释原因:______________________________________________________________________________
______________________________________________________________________________。
③实验Ⅲ中经测定溶液中产生Mn2+,该反应的离子方程式是_________________________
______________________________________________________________________________。
④从上述实验探究中,体现出Na2S2O5具有__________________性质(至少说出两点)。
硫及其化合物的相互转化
一、选择题
1.自然界中不同价态硫元素之间的转化如图所示,下列说法正确的是( )
A.上图中,酸雨的含硫成分只有H2SO3,由SO2溶于水生成
B.芒硝在浓硫酸中失水的过程体现了浓硫酸的脱水性
C.黄铁矿燃烧产生的尾气,与空气混合后通入碳酸钙的浆状物,可用来制备石膏
D.凝聚法是将SO2通入H2S稀溶液中得到S胶体,该反应中氧化剂与还原剂的物质的量之比为2∶1
答案 C
2.三大化石燃料燃烧会产生大气污染物,特别是含硫煤燃烧后产生的SO2危害巨大。为了保护环境,科学家提出了下列解决方法,同时还能获得某种重要的工业产品。下列说法错误的是( )
A.不用O2直接氧化SO2是因为氧化速率太慢
B.图中涉及的反应之一为4FeSO4+O2+2H2SO4===2Fe2(SO4)3+2H2O
C.反应一段时间后,溶液中Fe2(SO4)3的浓度会减小
D.理论上每吸收标况下224 mL SO2可以获得0.98 g H2SO4
答案 C
3.《环境科学》曾刊发我国科研部门采用零价铁活化过二硫酸钠(Na2S2O8,其中S为+6价)去除废水中的正五价砷的研究成果,其反应机理模型如图,(设NA为阿伏加德罗常数的值)下列说法正确的是( )
A.1 ml SOeq \\al(-,4)· (自由基)中含50NA个电子
B.pH越大,越不利于去除废水中的正五价砷
C.1 ml过二硫酸钠中含NA个过氧键
D.转化过程中,若共有1 ml S2Oeq \\al(2-,8)被还原,则参加反应的Fe为56 g
答案 C
4.自然界中的分解者可将含硫有机物分解为H2S,硫黄细菌和硫化细菌可将H2S进一步变为硫单质或硫酸盐,下列关于硫化氢的说法正确的是( )
A.H2S是一种无色、有臭鸡蛋气味的有毒气体
B.H2S分子中所有原子的最外层都达到8电子结构
C.将H2S通入FeSO4溶液中,产生沉淀
D.H2S分子很稳定,受热难分解
答案 A
5.用下列两种途径制取H2SO4,某些反应条件和产物已省略,下列有关说法不正确的是( )
途径① Seq \(――→,\s\up7(浓硝酸))H2SO4,
途径② Seq \(――→,\s\up7(O2))SO2eq \(――→,\s\up7(O2))SO3eq \(――→,\s\up7(H2O))H2SO4
A.途径①反应中体现了浓硝酸的强氧化性和酸性
B.途径②的第二步反应在实际生产中可以通过增大O2的浓度来降低成本
C.由途径①和②分别制取1 ml H2SO4,理论上各消耗1 ml S,各转移6 ml电子
D.途径②与途径①相比更能体现“绿色化学”的理念
答案 A
6.下列反应能产生SO2的是( )
①煅烧黄铁矿 ②亚硫酸钠与浓硫酸反应 ③点燃硫化氢气体 ④蔗糖和浓硫酸反应
A.①②③B.②④
C.②③④D.①②③④
答案 D
7.硫在空气中燃烧生成气体A,把A溶于水得溶液B,向B中滴加溴水,溴水褪色,B变成C,向C中加Na2S产生气体D,把D通入B溶液得浅黄色沉淀E。A、B、C、D、E都含同一种元素。按A、B、C、D、E顺序排列的是( )
A.SO2、H2SO4、H2SO3、H2S、S
B.SO2、H2SO3、H2SO4、H2S、S
C.SO2、H2SO3、H2SO4、SO3、Na2S2O3
D.SO3、H2SO4、H2SO3、SO2、Na2S2O3
答案 B
8.火山喷发会引发大范围海啸,大量的火山灰和火山气体对气候造成极大的影响。火山喷发产生的含硫物质在自然界的循环过程如图所示。下列说法错误的是( )
A.火山喷发形成硫酸型酸雨,总反应为2SO2+O2+2H2O===2H2SO4
B.火山喷发会影响气温下降的可能原因是大量气体进入平流层形成硫酸气溶胶阻挡太阳辐射
C.自然界地表层原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液,向地下深层渗透遇到难溶的PbS,慢慢转变为铜蓝(CuS),离子方程式为Cu2++ SOeq \\al(2-,4)+Pb2++S2-===PbSO4↓+CuS↓
D.工业制备硫酸可用黄铁矿经FeS2→SO2→SO3→H2SO4多步反应制备
答案 C
9.(2023·青岛模拟)在“价—类”二维图中融入“杠杆模型”,可直观辨析部分物质转化及其定量关系。图中的字母分别代表硫及其常见化合物,下列相关推断不合理的是( )
A.b、d、f既具有氧化性又具有还原性
B.硫酸型酸雨的形成过程涉及b到c的转化
C.a溶液与b溶液反应过程中有淡黄色沉淀生成
D.d在加热条件下与强碱溶液反应生成e和f,且n(e)∶n(f)=1∶2
答案 D
10.连二亚硫酸钠(Na2S2O4)俗称保险粉,工业上可用于纸浆漂白,该物质的还原性比Na2SO3强,其水溶液能被空气中的氧气氧化,在碱性介质中相对稳定。下列说法不正确的是( )
A.连二亚硫酸钠可以用于除去废水中的重铬酸根离子,使Cr2Oeq \\al(2-,7)转化为Cr3+
B.连二亚硫酸钠溶液敞口放置,可能会发生反应的化学方程式为2Na2S2O4+O2+2H2O===4NaHSO3
C.连二亚硫酸钠用于纸浆漂白的原理与ClO2的漂白原理相同
D.在包装保存保险粉时加入少量Na2CO3固体,可以提高保险粉的稳定性
答案 C
11.硫是生物必需的营养元素之一,下列关于自然界中硫循环(如图所示)的说法正确的是( )
A.含硫杆菌及好氧/厌氧菌促进了硫的循环
B.硫循环中含硫化合物均为无机物
C.上述硫循环中硫元素均被氧化
D.烧煤时加石灰石,可减少酸雨及温室气体的排放
答案 A
12.实验室通过如图所示装置制备Na2S2O3,反应原理:2Na2S+Na2CO3+4SO2===3Na2S2O3+CO2。下列有关说法错误的是( )
A.导管a的作用是有利于硫酸滴入
B.装置A中的反应体现硫酸的酸性
C.装置B、D作用完全相同
D.装置C中先有淡黄色浑浊产生,后又变澄清,说明过程中有硫单质生成
答案 C
二、综合题
13.硫代硫酸钠在纺织业等领域有广泛应用。某兴趣小组用下图装置制备Na2S2O3·5H2O。
合成反应:SO2+Na2CO3===Na2SO3+CO2 2Na2S+3SO2===2Na2SO3+3S
Na2SO3+Seq \(=====,\s\up7(△))Na2S2O3
滴定反应:I2+2Na2S2O3===2NaI+Na2S4O6
已知:Na2S2O3·5H2O易溶于水,难溶于乙醇,50 ℃开始失结晶水。
实验步骤:
Ⅰ.Na2S2O3制备:装置A制备的SO2经过单向阀通入装置C中的混合溶液,加热、搅拌,至溶液pH约为7时,停止通入SO2气体,得产品混合溶液。
Ⅱ.产品分离提纯:产品混合溶液经蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得到Na2S2O3·5H2O产品。
Ⅲ.产品纯度测定:以淀粉作指示剂,用Na2S2O3·5H2O产品配制的溶液滴定碘标准溶液至滴定终点,计算Na2S2O3·5H2O含量。
请回答:
(1)步骤Ⅰ单向阀的作用是____________________;装置C中的反应混合溶液pH过高或过低将导致产率降低,原因是_______________________________________________________。
(2)步骤Ⅱ下列说法正确的是________。
A.快速蒸发溶液中水分,可得较大晶体颗粒
B.蒸发浓缩至溶液表面出现晶膜时,停止加热
C.冷却结晶后的固液混合物中加入乙醇可提高产率
D.可选用冷的Na2CO3溶液作洗涤剂
(3)步骤Ⅲ
①滴定前,有关滴定管的正确操作为(选出正确操作并按序排列):
检漏→蒸馏水洗涤→( )→( )→( )→( )→( )→开始滴定。
A.烘干
B.装入滴定液至零刻度以上
C.调整滴定液液面至零刻度或零刻度以下
D.用洗耳球吹出润洗液
E.排除气泡
F.用滴定液润洗2至3次
G.记录起始读数
②装标准碘溶液的碘量瓶(带瓶塞的锥形瓶)在滴定前应盖上瓶塞,目的是_____________________________________________________________________________。
③滴定法测得产品中Na2S2O3·5H2O含量为100.5%,则Na2S2O3·5H2O产品中可能混有的物质是________。
答案 (1)防止倒吸 pH过高,Na2CO3、Na2S反应不充分;pH过低,导致Na2S2O3转化为S和SO2
(2)BC
(3)①F B E C G ②防止碘挥发 ③Na2SO3或失去部分结晶水的Na2S2O3·5H2O
14.实验小组制备焦亚硫酸钠(Na2S2O5)并探究其性质。
资料:焦亚硫酸钠为白色晶体,可溶于水。
(1)制备Na2S2O5(夹持装置略)
①A为SO2发生装置,A中反应的化学方程式是
________________________________。
②将尾气处理装置C补充完整并标明所用试剂。
(2)探究Na2S2O5的性质
①由实验Ⅰ可知,Na2S2O5溶于水,溶液呈酸性的原因是_____________________________
______________________________________________________________________________
(用化学方程式表示)。
②实验Ⅱ中向白色沉淀中滴加过量盐酸,沉淀溶解,用平衡原理解释原因:______________________________________________________________________________
______________________________________________________________________________。
③实验Ⅲ中经测定溶液中产生Mn2+,该反应的离子方程式是_________________________
______________________________________________________________________________。
④从上述实验探究中,体现出Na2S2O5具有__________________性质(至少说出两点)。
答案 (1)①Na2SO3+H2SO4===Na2SO4+SO2↑+H2O ②
(2)①Na2S2O5+H2O===2NaHSO3、HSOeq \\al(-,3)H++SOeq \\al(2-,3)
②BaSO3存在平衡:BaSO3(s)Ba2+(aq)+SOeq \\al(2-,3)(aq),加入盐酸,SOeq \\al(2-,3)+H+===HSOeq \\al(-,3)、HSOeq \\al(-,3)+H+===SO2↑+H2O,平衡右移,沉淀溶解
③5S2Oeq \\al(2-,5)+4MnOeq \\al(-,4)+2H+===10SOeq \\al(2-,4)+4Mn2++H2O ④还原性、不稳定性、盐的通性
实验编号
实验操作及现象
实验Ⅰ
取B中少量白色晶体于试管中,加入适量蒸馏水,得溶液a,测得溶液呈酸性
实验Ⅱ
取少量溶液a于试管中,滴加足量氢氧化钡溶液,有白色沉淀生成,过滤后,将沉淀放入试管中,滴加过量盐酸,充分振荡,产生气泡,白色沉淀溶解
实验Ⅲ
取B中少量白色晶体于试管中,滴加1 mL 2 ml·L-1酸性KMnO4溶液,剧烈反应,溶液紫红色很快褪去
实验Ⅳ
取B中少量白色晶体于大试管中加热,将产生的气体通入品红溶液中,红色褪去;将褪色后的溶液加热,红色恢复
实验编号
实验操作及现象
实验Ⅰ
取B中少量白色晶体于试管中,加入适量蒸馏水,得溶液a,测得溶液呈酸性
实验Ⅱ
取少量溶液a于试管中,滴加足量氢氧化钡溶液,有白色沉淀生成,过滤后,将沉淀放入试管中,滴加过量盐酸,充分振荡,产生气泡,白色沉淀溶解
实验Ⅲ
取B中少量白色晶体于试管中,滴加1 mL 2 ml·L-1酸性KMnO4溶液,剧烈反应,溶液紫红色很快褪去
实验Ⅳ
取B中少量白色晶体于大试管中加热,将产生的气体通入品红溶液中,红色褪去;将褪色后的溶液加热,红色恢复
相关试卷
这是一份人教版 (2019)必修 第二册第五章 化工生产中的重要非金属元素第二节 氮及其化合物课时练习,共17页。试卷主要包含了选择题,综合题等内容,欢迎下载使用。
这是一份高中化学沪科技版(2020)必修第二册氧化物精练,共12页。试卷主要包含了选择题,综合题等内容,欢迎下载使用。
这是一份高中化学人教版 (2019)必修 第一册第一节 铁及其化合物一课一练,共13页。试卷主要包含了选择题,综合题等内容,欢迎下载使用。








