






人教版 (2019)必修 第二册第一节 化学反应与能量变化一等奖ppt课件
展开
这是一份人教版 (2019)必修 第二册第一节 化学反应与能量变化一等奖ppt课件,共43页。PPT课件主要包含了课堂小结等内容,欢迎下载使用。
思考:火箭发射的动力是什么?
2022年6月5日10时44分,搭载神舟十四号载人飞船的长征二号F遥十四运载火箭在酒泉发射中心精准点火发射。
第1课时 化学反应与热能
现代社会中,人类的一切活动(从衣食住行到文化娱乐,从社会生产到学科研究等)都离不开能量,而许多能量的利用与化学反应中能量变化密切相关。从煤、石油、天然气等提供的热能,到各种化学电池提供的电能,都是通过化学反应获得的。
实验探究【6-1】【6-2】
注:(1)吸热反应和放热反应属于化学反应,一些物质溶于水,也会有吸热和放热现象:浓H2SO4、NaOH(s)等溶于水要放热 ;NH4NO3(s)、KNO3(s)、NH4Cl(s)等溶于水要吸热 ,但不能说是放热反应和吸热反应。 (2)物质的三态变化也会有吸热和放热现象,但也不能说是放热反应和吸热反应。
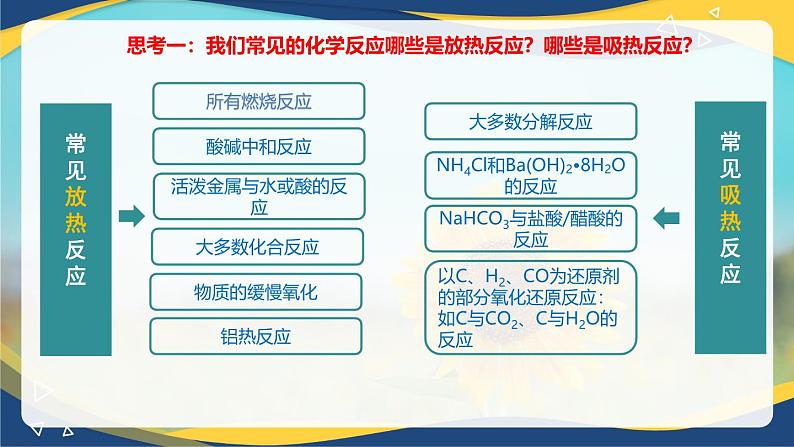
一、吸热反应与放热反应
1. 分类
放热反应:把释放热量的化学反应
吸热反应:把吸收热量的化学反应
活泼金属与水或酸的反应
NH4Cl和Ba(OH)2•8H2O的反应
以C、H2、CO为还原剂的部分氧化还原反应:如C与CO2、C与H2O的反应
NaHCO3与盐酸/醋酸的反应
思考一:我们常见的化学反应哪些是放热反应?哪些是吸热反应?
注意:吸热反应、放热反应是指反应过程中吸收还是放出热量,与反应是否需要加热等条件没有直接联系。 如:大多数燃烧反应都需要加热,但燃烧反应都是放热反应; NH4Cl和Ba(OH)2•8H2O的反应 在常温下就可反生,但它是吸热反应。
思考二:吸热反应一定需要加热,放热反应一定不需要加热,这种说法正确吗?
讨论一:化学反应过程中为什么有能量变化?讨论二:为什么有的化学反应释放热量,有的化学反应吸收热量?
2. 化学反应伴随能量变化的原因
旧物质反应生成新物质
旧化学键断裂、新化学键形成
①反应物总能量 小于 生成物总能量,为吸热反应。
②反应物的总能量大于生成物的总能量时 为放热反应
放热还是吸热取决于反应物和生成物总能量的相对大小
化学反应中能量变化的原因---宏观角度
以 H2(g)+Cl2(g)===2HCl(g)的反应过程如图所示:
旧键断裂 新键形成
化学反应中能量变化的原因---微观角度
在25℃、101kPa条件下 H2 + Cl2 ═ 2HCl 反应为例
断1 ml H-H键吸收436 kJ断1 ml Cl-Cl键吸收243 kJ
形成2 ml H-Cl键放出2×431 kJ即862 kJ能量
反应结果:放出能量=(431+431)—(436+243)KJ=183KJ
晋中市高中化学“空中课堂”
化学键的断裂与形成是化学反应中能量变化的主要原因。(微观角度)
化学反应过程中放出的能量多于吸收的能量,则有能量向环境释放,为放热反应;
化学反应过程中放出的能量小于吸收的能量,则需从环境中吸收能量,为吸热反应。
放热还是吸热取决于断键吸收的总能量与成键放出的总能量的相对大小
1.宏观角度:反应物和生成物的总能量相对大小判断 Q(反应物)>Q(生成物)→放热反应; Q(反应物) E(产物成键放出能量)→吸热反应。
判断吸热反应和放热反应的两种方法:
讨论一:你知道人类是如何利用化学反应中热能的?举例说明。讨论二:目前能源的利用面临那些问题?讨论三:你们有什么解决以上问题的好办法?
1.人类利用能源的三个阶段
二、化学反应中热能的利用
2. 现阶段人类获取热能的主要途径
3. 化石燃料获取能量面临的问题
储量有限,短期内不可再生
煤、石油产品燃烧排放的粉尘、SO2、NOx、CO等是大气污染物的主要来源。
4. 能源可持续发展的措施
节能: (1)燃料燃烧阶段——可通过改进锅炉的炉型和燃料空气比、清理积灰等方法提高燃 料的燃烧效率; (2)能量利用阶段——可通过使用节能灯,改进电动机的材料和结构,以及发电厂、钢铁厂余热与城市供热联产等措施促进能源循环利用,有效提高能量利用率。
寻找新能源: (1)特点:资源丰富、可以再生,对环境无污染。 (2)人们比较关注的新能源:太阳能、风能、地热能、海洋能和氢能等。
可再生能源:在自然界中可以不断再生并有规律地得到补充的能源非再生能源:经过亿万年的形成,短期内无法恢复的能源。
我们日常使用的电能主要来自火力发电。火力发电是通过化石燃料燃烧时发生的氧化还原反应,使化学能转化为热能,加热水使之汽化为蒸汽以推动蒸汽轮机,带动发电机发电。火力发电过程中,化学能经过一系列能量转化过程,间接转化为电能。其中,燃烧(氧化还原反应)是关键。
第2课时 化学反应与电能
【实验6-3】(1) 将锌片和铜片插入盛有稀硫酸的烧杯中,观察现象。(2) 用导线连接锌片和铜片,观察、比较导线连接前后的现象。(3)如图6-6所示,用导线在锌片和铜片之间串联一个电流表,观察电流表的指针是否偏转。
===Zn2++H2↑
铜排在金属活动性顺序表氢的后面,不能从酸溶液中置换出氢气
溶液中的氢离子在铜片表面获得电子发生还原反应产生氢气,从铜片上放出
将化学能直接转变成电能的装置,称为原电池。
Zn-2e-=Zn2+
2H++2e-=H2↑
Zn+2H+=Zn2++H2↑(两个电极反应之和)
Zn-2e-=Zn2+
原电池总反应:Zn+2H+=Zn2++H2↑
2H++2e-=H2↑
5.实验探究形成原电池的条件
形成条件一:活泼性不同的两个电极材料
负极:较活泼的金属正极:较不活泼的金属、石墨等
形成条件二:电极材料需插进电解质溶液中;
形成条件三:必须形成闭合回路
① 两种活泼性不同的金属作电极 (或其中一种为能导电的非金属,如“碳棒”)其中较活泼金属为负极较不活泼金属(或非金属)为正极 ② 电解质溶液 ③ 形成闭合回路 ④ 能自发进行氧化还原反应
原电池以氧化还原反应为基础,使氧化反应和还原反应分别在两个电极上进行,并配合溶液中阴阳离子的定向移动,从而产生电流,实现化学能向电能的转化。
如实验室用Zn和稀H2SO4(或稀HCl)反应制H2,常用粗锌,它产生H2的速率快。 原因是粗锌中的杂质和锌、稀H2SO4形成原电池,加快了锌的腐蚀,使产生H2的速率加快。
(1)加快氧化还原反应速率
原电池中,一般活动性强的金属为负极,活动性弱的金属为正极。 例如有两种金属A和B,用导线连接后插入到稀硫酸中,观察到A极溶解,B极上有气泡产生, 由原电池原理可知,金属活动性A>B。
(2)比较金属的活动性强弱
在设计原电池时,若给出的是离子反应方程式 如:2Fe3++Cu == Cu2++2Fe2+
1、电解液:硫酸铁、氯化铁、硝酸铁等
2、电极材料: 负极:铜 正极:石墨或比铜不活泼的其他金属
3、电极反应式 负极: Cu - 2e - = Cu 2+ 正极:2Fe3+ + 2e - = 2 Fe2+
【目的】根据原电池原理,设计和制作简易电池,体会原电池的构成要素。【用品】水果(苹果、柑橘或柠檬等),食盐水,滤纸,铜片、铁片、铝片等金属片,石墨棒,导线,小型用电器(发光二极管、电子音乐卡或小电动机等),电流表。【实验】(1)水果电池(2)简易电池
二、原电池的设计与制作
1.一次电池——酸性锌锰干电池
(1)定义有些电池放电时所进行的氧化还原反应,在充电时可以逆向进行,使电池恢复到放电前的状态,从而实现放电(化学能转化为电能)与充电(电能转化为化学能)的循环。这种充电电池属于二次电池。 (2)常见充电电池。①铅酸蓄电池;②镍氢电池;③锂离子电池。
发展中的燃料电池 燃料电池是一种将燃料(如氢气、甲烷、乙醇)和氧化剂(如氧气)的化学能直接转化为电能的电化学反应装置,具有清洁、安全、高效等特点。燃料电池的能量转化率可以达到80%以上。当以氢气为燃料时,产物为水;以甲烷为燃料时,产物为水和二氧化碳。与常规发电厂相比,其二氧化碳排放量明显降低。燃料电池与干电池或蓄电池的主要差别在于反应物不是储存在电池内部,而是从外部提供,这时电池起着类似试管、烧杯等反应器的作用。 燃料电池的供电量易于调节,能适应用电器负载的变化,而且不需要很长的充电时间,在航天、军事和交通等领城有广阔的应用前景。
相关课件
这是一份高中人教版 (2019)第一节 化学反应与能量变化背景图课件ppt,共1页。
这是一份化学第六章 化学反应与能量第一节 化学反应与能量变化示范课ppt课件,共60页。
这是一份人教版 (2019)必修 第二册第一节 化学反应与能量变化备课ppt课件,共15页。PPT课件主要包含了遵循三个守恒,2电荷守恒,书写方法,3两式加验总式,固体氧化物燃料电池,一次电池,二次电池,燃料电池,碱性锌锰电池,铅蓄电池等内容,欢迎下载使用。










