

- 人教版2019选择性必修2第一章原子结构与性质(A卷知识通关练)高二化学分层训练AB卷(人教版含解析答案 试卷 0 次下载
- 人教版2019选择性必修2第二章分子结构与性质(A卷知识通关练)-【单元测试】高二化学分层训练AB含解析答案 试卷 0 次下载
- 人教版2019选择性必修2第二章分子结构与性质(B卷能力提升练)-【单元测试】高二化学分层训练AB含解析答案 试卷 0 次下载
- 人教版2019选择性必修2第三章晶体结构与性质(A卷知识通关练)高二化学分层训练AB卷(人教版含解析答案 试卷 0 次下载
- 人教版2019选择性必修2第三章晶体结构与性质(B卷能力提升练)高二化学分层训练AB卷(人教版含解析答案 试卷 0 次下载
人教版 (2019)选择性必修2第一节 原子结构精品达标测试
展开(时间:75分钟,满分:100分)
一、选择题(本题共16小题,每小题3分,共48分。)
1.下列关于能层与能级的说法正确的是
A.在基态多电子原子中,p轨道电子的能量不一定高于s轨道电子的能量
B.任一能层的能级总是从s能级开始,而且能级数不一定等于该能层序数
C.同是s能级,在不同的能层中所能容纳的最多电子数是不相同的
D.多电子原子中,每个能层上电子的能量一定不同
2.下列说法错误的是
A.电子排布式1s22s22p63s23p64s3违反了泡利不相容原理
B.基态原子电子排布式1s22s22p63s23p63d5违反了能量最低原理
C.根据构造原理,原子核外电子填充顺序为1s→2s→2p→3s→3p→3d→4s→4p…
D.钠原子由1s22s22p63s1→1s22s22p63p1时,原子吸收能量,由基态转变成激发态
3.下列各项叙述错误的是
A.若硫原子核外电子排布图为,则违反了泡利原理
B.若21号Sc元素的基态原子电子排布式为,则违反了构造原理
C.铍原子的核外电子排布图为,符合洪特规则和泡利原理
D.原子的电子排布式由能释放特定能量产生发射光谱
4.1817年,瑞典的贝采利乌斯从硫酸厂的铅室底部的红色粉末物质中制得硒。硒与氧元素同主族,下列关于硒及其基态原子的说法中正确的有
①位于元素周期表第四周期 ②电子占据18个原子轨道 ③有34种不同运动状态的电子 ④电子占据8个能级 ⑤电子占据的最高能级符号是4p ⑥价电子排布式为
A.3项B.4项C.5项D.6项
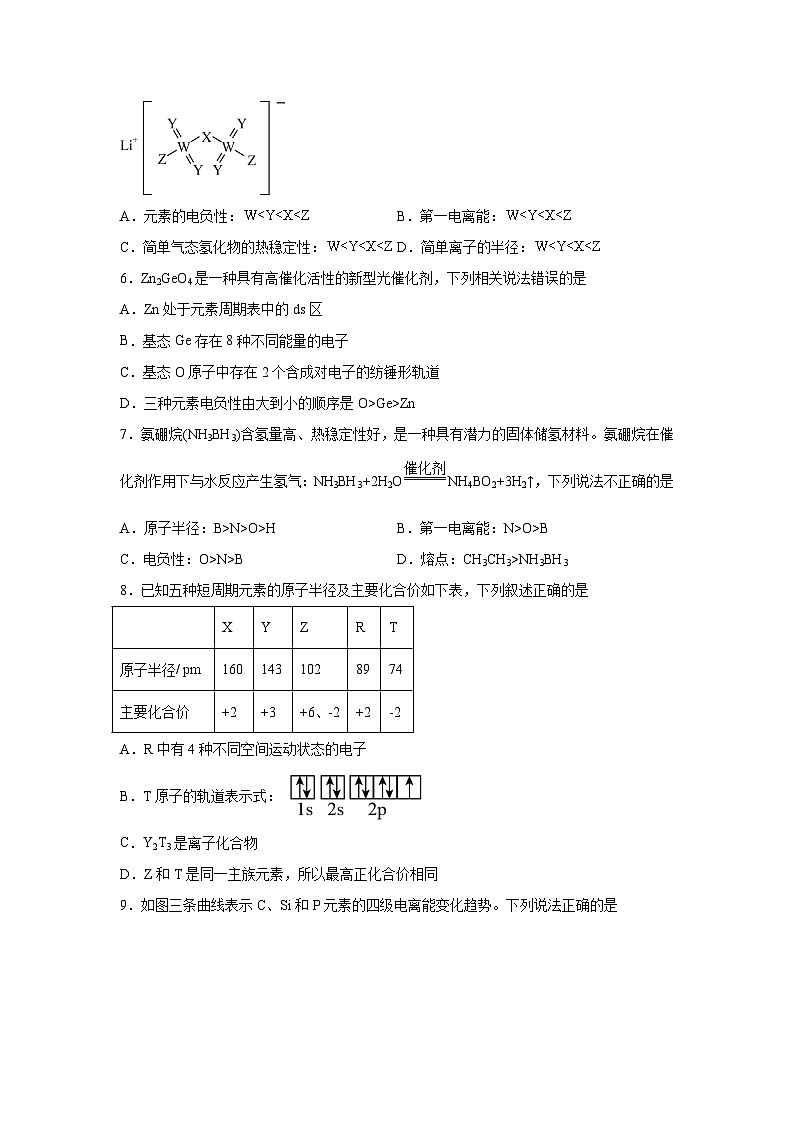
5.某锂盐的结构如图所示,其阴离子是由原子序数依次增大的短周期主族元素X、Y,Z、W形成,X,Y与Z同一周期,Y与W同族。下列说法正确的是( )
A.元素的电负性:B.第一电离能:
C.简单气态氢化物的热稳定性:D.简单离子的半径:
6.Zn2GeO4是一种具有高催化活性的新型光催化剂,下列相关说法错误的是
A.Zn处于元素周期表中的ds区
B.基态Ge存在8种不同能量的电子
C.基态O原子中存在2个含成对电子的纺锤形轨道
D.三种元素电负性由大到小的顺序是O>Ge>Zn
7.氨硼烷(NH3BH3)含氢量高、热稳定性好,是一种具有潜力的固体储氢材料。氨硼烷在催化剂作用下与水反应产生氢气:NH3BH3+2H2ONH4BO2+3H2↑,下列说法不正确的是
A.原子半径:B>N>O>HB.第一电离能:N>O>B
C.电负性:O>N>BD.熔点:CH3CH3>NH3BH3
8.已知五种短周期元素的原子半径及主要化合价如下表,下列叙述正确的是
A.R中有4种不同空间运动状态的电子
B.T原子的轨道表示式:
C.Y2T3是离子化合物
D.Z和T是同一主族元素,所以最高正化合价相同
9.如图三条曲线表示C、Si和P元素的四级电离能变化趋势。下列说法正确的是
A.最高价含氧酸的酸性:a>b>cB.I5:a>c>b
C.电负性:c>b>aD.最简单氢化物的沸点:a>b>c
10.在短周期元素中,元素的基态原子核外未成对电子数等于能层序数的元素有a种,元素的基态原子最外层电子数是未成对电子数2倍的元素有b种,则的值为
A.1B.2C.3D.4
11.X、Y、Z、W是原子序数依次增大的短周期不同主族元素,X的最外层电子数是其电子层数的3倍,Y元素原子半径在同周期中最大,Z的3p轨道有3个未成对电子,X与Y的最外层电子数之和与W的最外层电子数相等。下列说法中错误的是
A.X在元素周期表中位于p区
B.元素的第一电离能:
C.X、Z、W的单质形成的晶体类型相同
D.Z的最高价含氧酸的钠盐溶液中有三种含Z元素的微粒
12.下列说法正确的是
A.氢原子的电子云图中小黑点的疏密表示电子在核外单位体积内出现机会的多少
B.最外层电子数为ns2的元素都在元素周期表第2列
C.处于最低能量的原子叫做基态原子,1s22s22→1s22s22过程中形成的是发射光谱
D.已知某元素+3价离子的电子排布式为1s22s22p63s23p63d5,该元素位于周期表中的第四周期第VIII族位置,属于ds区
13.具有下列电子层结构的原子或离子,其对应元素一定属于同一周期的是
A.两原子核外全部都是s电子
B.最外层电子排布为3s23p6的原子和最外层电子排布为3s23p6的离子
C.原子核外M层上的s、p能级都充满电子,而3d能级上没有电子的两种原子
D.3p能级上只有一个空轨道的原子和3p能级上只有一个未成对电子的原子
14.2019年是门捷列夫提出元素周期表150周年。根据元素周期律和元素周期表,下列推断不合理的是
A.第35号元素的单质在常温常压下是液体
B.位于第四周期第ⅤA族的元素为非金属元素
C.第84号元素的最高化合价是+7
D.第七周期0族元素的原子序数为118
15.部分短周期元素原子半径的相对大小、最高正价或最低负价随原子序数的变化关系如图所示,下列说法正确的是
A.离子半径的大小顺序:e>f>g>hB.与x形成简单化合物的沸点:y>z>d
C.y、z、d三种元素第一电离能和电负性的大小顺序不一致D.e、f、g、h四种元素对应最高价氧化物的水化物相互之间均能发生反应
16.下列说法不正确的是
A.某外围电子排布为4f75d16s2基态原子,该元素位于周期表中第六周期第ⅢB族
B.在元素周期表中,s区,d区和ds区的元素都是金属元素
C.当碳原子的核外电子排布由转变为时,释放能量,由激发态转化成基态
D.非金属元素形成的共价化合物中,原子的最外层电子数不一定是2或8
二、非选择题(本题共5小题,共52分。)
17.氨硼烷(NH3BH3)含氢量高、热稳定性好,是一种具有潜力的固体储氢材料。回答下列问题:
(1)H、B、N中,原子半径最大的是 。根据对角线规则,B的一些化学性质与元素 的相似。
(2)NH3BH3分子中,与N原子相连的H呈正电性(Hδ+),与B原子相连的H呈负电性(Hδ-),电负性大小顺序是 。
(3)Li+与H−具有相同的电子构型,r(Li+) r(H−)(填“大于”或“小于”)
(4)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能Ⅰ1(Zn) Ⅰ1(Cu)(填“大于”或“小于”)。
18.A、B、C、D、E、F、G是元素周期表前四周期常见元素,且原子序数依次增大,其相关信息如表所示,请回答下列问题。
(1)A在元素周期表中的位置为 ,画出基态B原子的轨道表示式 。
(2)B的简单气态氢化物的沸点 (填“高于”或“低于”)PH3,原因是 。
(3)A、B、C三种元素的电负性由高到低的排列次序为 (用元素符号表示)。
(4)已知元素A、B形成的链状分子中所有的原子都满足8电子稳定结构,则其分子中键与键数目之比为 。
(5)G元素可形成、,其中较稳定的是,原因是 。
(6)短周期元素与元素在周期表中的位置呈现对角线关系,已知元素、的电负性分别为1.5和3.0,预测它们形成的化合物是 (填“离子”或“共价”)化合物。推测的最高价氧化物对应的水化物 (填“能”或“不能”)与的最高价氧化物对应水化物发生反应。
19.A、B、C、D、E、F为原子序数依次增大的六种元素,其中A、B、C、D、E为短周期元素,F为第四周期元素,F还是前四周期中电负性最小的元素。已知:A原子的核外电子数与电子层数相等;B元素质子核外p电子数比s电子数少1个;C原子的第一至第四电离能为I1=738738kJ/ml、I2=1 451kJ/ml、I3=7733kJ/ml、I4= 10540kJ/ml;D原子核外所有p轨道为全充满或半充满;E元素的族序数与周期序数的差为4。
(1)写出E元素在周期表中位置 ;D元素的原子的核外电子排布式 。
(2)某同学概括题目信息和掌握的知识分析C的核外电子排布图为,该同学所画的轨道式违背了 。
(3)已知BH5为离子化合物,写出其电子式 。
(4)在DE3分子中电子对更偏向 (用元素符号表示)原子,用电负性知识进行解释 。
20.如图是元素周期表的一部分,图中所列的字母分别代表某一化学元素。
(1)下列 (填序号)组元素的单质可能都是电的良导体。
①a、c、h ②b、g、k ③c、h、l ④d、e、f
(2)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去。核外电子离开该原子或离子所需要的能量主要受两大因素的影响。
原子失去核外不同电子所需的能量/()
①X可能为图中13种元素中的 (填字母)。用元素符号表示X和j形成的化合物的化学式: 。
②Y是周期表中第 族的元素。
③图中13种元素中, (填字母)元素原子失去核外第1个电子需要的能量最多。
21.根据原子结构、元素周期表和元素周期律的知识回答下列问题:
Ⅰ、①气态电中性基态原子失去最外层一个电子转化为气态基态正离子所需的最低能量叫做第一电离能(设为E)。部分元素的第一电离能如图所示:
(1)从图甲分析可知,同一主族元素原子的第一电离能I1变化规律是从上到下依次 ;(用“减小或增大或不变”填空)
(2)根据第一电离能的含义和元素周期律,可推断出
(3)通过分析电负性值变化规律,确定Mg元素电负性值的最小范围:
(5)邻氨基吡啶的铜配合物在有机不对称合成中起催化诱导效应,其结构简式如图所示。
①基态Cu原子的价电子排布式为 。在元素周期表中铜位于 区(填“s”、“P”、“d”或“ds”)
②基态Cu等多电子原子多核外电子排布中,能级会发生交错现象。以下表示的各能级能量大小关系,不符合客观事实的是
A.4s>3d>3p>3s B.6s>5p>4d>3d C.5f>4d>3p>2s D.7d>6d>5d>4d
Ⅱ、元素周期表前四周期A、B、C、D、E五种元素,A元素的原子最外层电子排布式为ns1;B元素的原子价电子排布式为ns2np2;C元素位于第二周期且原子中p能级与s能级电子总数相等;D元素原子的M能层的p能级中有3个未成对电子;E元素原子有5个未成对电子。
(1)写出元素名称:E 。
(2)C基态原子的电子排布图为 。
(3)当n=3时,B与C形成的化合物与氢氧化钠溶液反应的离子方程式是: 。
(4)若A元素的原子最外层电子排布式为2s1,B元素的原子价电子排布式为3s23p2,A、B、C、D四种元素的第一电离能由大到小的顺序是 (用元素符号表示)。
(5)E元素原子的电子排布简写式是 ,在元素周期表中的位置是 。
X
Y
Z
R
T
原子半径/ pm
160
143
102
89
74
主要化合价
+2
+3
+6、-2
+2
-2
A
原子核外有6个电子
B
原子序数比大1
C
基态原子中电子总数与p电子总数相等
D
原子半径在同周期元素中最大
E
基态原子价层电子排布式为3s23p1
F
基态原子的最外层p 轨道有2个电子的自旋状态与其他电子的自旋状态相反
G
生活中使用最多的一种金属,其高价氯化物的盐溶液常用于刻蚀铜制印刷电路板
元素
锂
X
Y
失去第1个电子
519
502
580
失去第2个电子
7296
4570
1820
失去第3个电子
11799
6920
2750
失去第4个电子
—
9550
11600
元素符号
Li
Be
B
C
O
F
Na
Al
Si
P
S
Cl
电负性值
0.98
1.57
2.04
2.55
3.44
3.98
0.93
1.61
1.90
2.19
2.58
3.16
参考答案:
1.A
【详解】A.在基态多电子原子中,同一能层的p轨道电子的能量高于s轨道电子的能量,不同能层的p轨道电子的能量不一定高于s轨道电子的能量,如2p轨道电子的能量低于3s轨道电子的能量,A正确;
B.任一能层的能级总是从s能级开始,且能级数一定等于该能层序数,B错误;
C.同是s能级,在不同的能层中所能容纳的最多电子数都是2,C错误;
D.多电子原子中,同一能级上电子的能量相同,D错误;
答案选A。
2.C
【详解】A.根据泡利不相容原理可知,轨道最多排2个电子,故A正确;
B.因为轨道能量比轨道能量低,所以基态原子电子排布式违反了能量最低原理,应该为,故B正确;
C.根据构造原理,原子核外电子填充顺序为,故C错误;
D.钠原子由时,电子从基态跃迁到激发态,要吸收能量,故D正确。
故选C。
3.A
【详解】A.根据洪特规则,填入简并轨道的电子总是先单独分占且自旋平行,该排布图违反了洪特规则,A错误;
B.根据构造原理,最后两个能级的电子应先填入4s轨道再填入3d轨道,该排布式违反了构造原理,B正确;
C.铍元素原子序数为4,1s、2s能级均只有一个原子轨道,该排布图符合洪特规则与泡利原理,C正确;
D.该变化表示电子从较高能量的激发态跃迁到基态,释放出能量,故会产生发射光谱,D正确;
故选A。
4.C
【分析】硒元素原子的核电荷数为34,核外电子排布为:1s22s22p63s23p63d104s24p4。
【详解】①硒元素位于元素周期表第四周期,正确;
②根据原子核外电子排布规律知硒原子的电子占据18个原子轨道,正确;
③硒原子核外有34个电子,则有34种不同运动状态的电子,正确;
④根据核外电子排布知电子占据8个能级,正确;
⑤硒原子有4个电子层,电子占据的最高能级符号是4p,正确;
⑥硒原子的价电子排布式为,错误。
正确的是①②③④⑤,共5项;
答案选C。
5.B
【分析】某锂盐的结构如图,其阴离子是由原子序数依次增大的短周期主族元素X、Y,Z、W形成,Y形成两个共价键,W形成六个共价键,Y与W同族,因此它们位于第ⅥA族,则W为S,Y为O;X、Y、Z位于第二周期,Z形成一个共价键,则Z为F;X形成两个共价键且使形成的阴离子带一个单位负电荷,则X为N。
【详解】A.主族元素同周期从左向右电负性逐渐增强,同主族从上到下电负性逐渐减弱,N原子半径小于S原子半径,N原子对键合电子吸引力大于S原子,因此电负性N>S,总的来说电负性W
C.非金属性越强,简单氢化物的稳定性越强,主族元素同周期从左向右非金属性逐渐增强,同主族从上到下非金属性逐渐减弱,因此非金属性大小:W
【点睛】分析X元素时注意阴离子整体的带电量。
6.C
【分析】根据元素的价电子排布式判断元素所在区,根据元素电子排布式判断含有的电子所处的能级个数;利用电子排布原则判断含有的电子轨道特点;根据元素的非金属性判断元素的电负性大小;
【详解】A.Zn元素价电子排布式是3d104s2,根据价电子排布式判断Zn元素位于ds区,故A正确;
B.基态Ge的电子排布式为1s22s22p63s23p63d104s24p2,根据能级能量不同判断共有8种能量的电子,故B正确;
C.基态O原子1s22s22p4根据洪特规则和鲍林不相容原理判断含有1个成对电子的纺锤形轨道,故C不正确;
D.电负性的判断根据非金属性的强弱判断,O>Ge>Zn,故D正确;
故选答案C。
【点睛】此题考查元素的相关性质,利用电子排布式或者价电子排布式判断所在区等性质,注意电子排布的三个原则。
7.D
【详解】A. 氢原子半径最小、同周期主族元素从左到右原子半径递减,则原子半径: ,A正确;
B.同周期从左向右第一电离能呈增大趋势 ,由于半充满结构更稳定, VA>VIA,因此第一电离能大小顺序是: ,B正确;
C.同周期从左向右电负性增大,则电负性: ,C正确;
D. 氨硼烷是固体,乙烷是气体,熔点: ,D不正确;
答案选D。
8.C
【分析】由化合价可知,X与R为同主族元素,由原子半径关系,可确定R为Be,X为Mg,从而确定Y元素是Al,Z元素是S,T元素是O。
【详解】A.空间运动状态个数=容纳电子的轨道数,Be原子核外共有2个轨道容纳电子,所以有2种不同空间运动状态的电子,A不正确;
B.T为O元素,电子排布式为1s22s22p4,则该原子的轨道表示式为,B不正确;
C.Y2T3的化学式为Al2O3,它由Al3+和O2-构成,是离子化合物,C正确;
D.O的非金属性很强,它很难失去电子,所以无最高正化合价,D不正确;
故选C。
9.B
【分析】同主族自上而下第一电离能减小,所以第一电离能C>Si,而P原子的3p轨道半满更稳定,第一电离能较大,所以第一电离能P>Si,所以三种元素第一电离能最小的是Si,即c为Si元素;P的价电子为3s23p3,所以在失去三个电子后电离能会有较大变化,所以b为P元素,a为C元素。
【详解】A.P的最高价含氧酸为H3PO4,为中强酸,C元素的最高价含氧酸为H2CO3,为弱酸,酸性:b>a,A错误;
B.C的核外电子排布为1s22s22p2,失去4个电子后再失去的是1s的电子;Si的核外电子排布为1s22s22p63s23p2,失去4个电子后再失去的是2p的电子;P原子的核外电子排布为1s22s22p63s23p3,失去4个电子后再失去的是3s的电子;能量3s>2p>1s,能量越高,电子越容易失去,所以I5:a>c>b,B正确;
C.同一主族,自上而下,元素的电负性依次减小,所以电负性:C>Si,即a>c,C错误;
D.a、b、c三种元素的最简单氢化物分别为CH4、PH3、SiH4,均为分子晶体,不含分子间氢键,相对分子质量CH4<SiH4<PH3,所以沸点CH4<SiH4<PH3,即a<c<b,D错误;
综上所述,答案为B。
10.B
【详解】在短周期元素中,寻找基态原子核外未成对电子数等于能层序数的元素可按周期序数进行,第一周期中有H,第二周期中原子核外未成对电子数为2的元素有C和O,第三周期中原子核外未成对电子数为3的元素有P,符合条件的元素共有4种,即。符合基态原子最外层电子数是未成对电子数2倍的元素,其基态原子的最外层电子数是2、4、6或8,若最外层电子数为2,则是He、Be或Mg,但这三种元素无未成对电子,不符合题意;若最外层电子数为4,则是C、Si,符合题意;若最外层电子数为6,则是O、S,最外层有2个未成对电子,最外层电子数是未成对电子数的3倍,不符合题意;若最外层电子数为8,则是Ne、Ar,但这两种元素均无未成对电子,不符合题意,则符合题意的元素共有2种,即。综上可知,的值为2。
故选B。
11.D
【分析】X、Y、Z、W是原子序数依次增大的短周期不同主族元素,X的最外层电子数是其电子层数的3倍,则X为O;Y元素原子半径在同周期中最大,则Y为Na;Z的3p轨道有3个未成对电子,则Z为P;X与Y的最外层电子数之和与W的最外层电子数相等,则W为Cl。
【详解】A .X为O,在元素周期表中位于p区,故A正确;
B.主族元素同周期从左向右第一电离能呈增大趋势,的能级处于半满稳定状态,其第一电离能大于同周期相邻元素,则第一电离能:,故B正确;
C.X为O, Z为P,W为Cl,形成的单质晶体均为分子晶体,故C正确;
D.P的最高价含氧酸钠盐为,溶液中含P微粒有、、、,故D错误;
故答案选D。
12.A
【详解】A. 核外电子的运动没有确定的方向和轨迹,只能用电子云描述它在原子核外空间某处出现机会(几率)的大小,A正确;
B. 最外层电子数为ns2的主族元素都在元素周期表第2列,副族元素也有ns2的情况,比如Zn,其核外电子排布式为[Ar]3d104s2,B错误;
C. 2px和2py的轨道能量一样,电子在这两个轨道之间变迁,不属于电子跃迁,也不会放出能量,C错误;
D. 该元素为26号元素Fe,位于VIII族,属于d区;ds区仅包含I B族、II B族,D错误;
故合理选项为A。
【点睛】为了方便理解,我们可以认为,电子云是通过千百万张在不同瞬间拍摄的电子空间位置照片叠加而成的图象(实际上还不存在这样的技术),小黑点疏密来表示空间各电子出现概率大小。
13.D
【详解】A.氢原子和锂原子都只有s电子但不在同一周期,A错误;
B.最外层电子排布为3s23p6的微粒可能是原子或离子,其核外电子数相等,但质子数可以不同,例如Ar和K+,两者对应元素不在同一周期,B错误;
C.原子核外M层上的s、p能级都充满电子,而3d能级上没有电子的两种原子,这里M层可能是最外层,则该原子为Ar,若M为次外层,该原子可能是K,两者不在同一周期,C错误;
D.3p能级上只有一个空轨道的原子,根据洪特规则可知该轨道电子为3p2,该原子可推知为Si,3p能级上只有一个未成对电子的原子,根据洪特规则可知该轨道电子为3p5,该原子可推知为Cl,两者处于同一周期,D正确。
故答案选D。
14.C
【详解】A.35号元素是溴元素,单质Br2在常温常压下是红棕色的液体,A项合理;
B.位于第四周期第ⅤA族的元素是砷元素(As),为非金属元素,B项合理;
C.第84号元素位于第六周期ⅥA族,为钋元素(P),由于最高正价等于主族序数,所以该元素最高化合价是+6,C项不合理;
D.第七周期0族元素是第七周期最后一个元素,原子序数为118,D项合理。
故答案选C。
15.C
【分析】部分短周期元素原子半径的相对大小、最高正价或最低负价随原子序数的变化关系如图所示,a位于第一周期,为H元素; b、c、d位于第二周期,b为C ,c为N, d为O元素;e、f、g、h位于第三周期,则e为Na,f为Al ,g为s , h为Cl元素,据此结合元素周期律、元素化合物知识解答。
【详解】A.根据电子层越多半径越大,电子层数相同时,核电荷数越大半径越小分析,离子半径关系为S2->Cl->Na+>Al3+,A错误;
B.三种物质分别为甲烷,氨气和水,因为氨气和水分子间存在氢键,所以沸点高,沸点顺序为H2O>NH3>CH4,B错误;
C.碳氮氧的电负性依次增加,但是氮元素为半满结构,第一电离能大于碳,故第一电离能顺序为氮>碳>氧,二者大小顺序不一致,C正确;
D.e、f、g、h四种元素对应最高价氧化物的水化物分别为氢氧化钠、氢氧化铝、硫酸、高氯酸,氢氧化铝和其他三种都能反应,但硫酸和高氯酸不能相互反应,D错误;
故选C。
16.B
【详解】A.由外围电子排布为4f75d16s2基态原子,判断此元素位于周期表中第六周期第ⅢB族,A正确,不选;
B.s区的H为非金属元素,d区和ds区的元素包括副族和第VIII族元素,副族和第VIII族元素全部是金属元素,B错误,符合题意;
C.碳原子的核外电子排布为:1s22s22p2,该原子处于基态,当核外电子排布为1s22s12p3,该原子处于激发态,所以由碳原子的核外电子排布由转变为的过程为由激发态变为基态,释放能量,C正确,不选;
D.非金属元素形成的共价化合物中,原子的最外层电子数除了2或8外,像一氧化碳、一氧化氮、二氧化硫等均不符合2或8电子结构,故D正确,不选;
答案为B。
17.(1) B Si(硅)
(2)N>H>B
(3)小于
(4)大于
【详解】(1)H、B、N中,H的电子层数最少,原子半径最小(H是所有元素中原子半径最小的元素);而B、N同周期,电子层数相同,但是N的核电荷数大,所以原子半径小,所以三种元素中原子半径最大的是B;由于周期表中B的对角线元素为Si,所以根据对角线规则,B的一些化学性质与元素Si的相似,故答案为:B;硅或者Si;
(2)NH3BH3分子中,与N原子相连的H呈正电性(Hδ+),。故电负性N>H,而与B原子相连的H呈负电性(Hδ-),故电负性H>B,所以电负性大小顺序是N>H>B,故答案为:N>H>B;
(3)Li+与H−具有相同的电子构型,核电荷数越大半径越小,故r(Li+)小于r(H−)。
(4)Zn价电子排布式为3d104s2,核外电子排布为全满稳定结构,Cu的价电子排布式为3d104s1,铜失去一个电子内层电子达到全充满稳定状态,故铜更容易失去1个电子,所以第一电离能I1(Zn)>I1(Cu)。
18.(1) 第二周期第ⅣA族
(2) 高于 氨气分子间可以形成氢键
(3)O>N>C
(4)
(5)Fe2+的价电子为3d6,而Fe3+的价电子是3d5半充满稳定状态
(6) 共价 能
【分析】A为C,B为N;C的基态原子中电子总数与p电子总数相等,C为O;D的原子半径为同周期元素中最大的,D为Na;E为Al;F的基态原子的最外层p 轨道有2个电子的自旋状态与其他电子的自旋状态相反,其价层电子排布为3s23p5,F为Cl;G为Fe。
【详解】(1)
A为C,在元素周期表中的位置为:第二周期第ⅣA族;B为N,基态原子的轨道表示式为:;
(2)N与P同主族,NH3中含分子间氢键,沸点高于PH3,原因:氨气分子间可以形成氢键;
(3)A、B、C分别为C、N、O,同周期从左往右电负性逐渐增强,故电负性由高到低的顺序为:O>N>C;
(4)元素A、B形成的为(CN)2,结构式为:,,单键全部是键,三键中有1个键和2个键,故键和键个数之比为3:4;
(5)Fe2+的稳定性弱于Fe3+,原因是:Fe2+的价电子为3d6,而Fe3+的价电子是3d5半充满稳定状态;
(6)短周期元素与元素在周期表中的位置呈现对角线关系,M为Be,M与F的电负性差值为1.5,电负性差值小于1.7,形成共价键;Be与Al处于对角线位置,化学性质相似,Al(OH)3为两性氢氧化物,Be(OH)2为两性氢氧化物,能与NaOH溶液反应。
19.(1) 第三周期ⅦA族 1s22s22p63s23p3
(2)能量最低原理
(3)
(4) Cl Cl元素的电负性大于P元素,PCl3中Cl原子对共用电子对的引力大于P原子
【分析】A、B、C、E、F为原子序数依次增大的六种元素,其中A、B、C、D、E为短周期元素,F为第四周期元素,F还是前四周期中电负性最小的元素,则F为K元素;A原子的核外电子数与电子层数相等,则A为H元素;B元素原子的核外p电子数比s电子数少1个,核外电子排布式为1s22s22p3,则B为N元素;C原子第三电离能剧增说明原子最外层有2个电子,则C为Mg元素;D原子核外所有p轨道为全充满或半充满,则D为P元素;E元素的族序数与周期序数的差为4,则E为Cl元素。
【详解】(1)氯元素的原子序数为17,位于元素周期表第三周第ⅦA族;磷元素的原子序数为15,原子的核外电子排布式为1s22s22p63s23p3,故答案为:第三周第ⅦA族;1s22s22p63s23p3;
(2)镁元素的原子序数为12,由能量最低原理可知,镁原子的核外电子排布图为,则电子排布式违背了能量最低原理,故答案为:能量最低原理;
(3)由题意可知,NH5为NH离子与H—离子形成的离子化合物,电子式为,故答案为:;
(4)氯元素的电负性大于磷元素,三氯化磷分子中氯原子对共用电子对的引力大于磷原子,所以共用电子对偏向氯原子一方,故答案为:Cl元素的电负性大于P元素,PCl3中Cl原子对共用电子对的引力大于P原子。
20. ①④ a 或 ⅢA m
【分析】由元素在周期表中位置,可知a为Na、b为H、c为Mg、d为Sr、e为Ti、f为Al、g为Ge、h为C、i为P、j为O、k为Te,l为Cl、m为Ar。金属元素及石墨是电的良导体;Li原子失去1个电子后形成稳定结构,再失去1个电子很困难;由表中数据可知,X的第二电离能剧增,故X表现+1价,处于第ⅠA族,且第一电离能比Li的小,说明比锂的金属性强,a应为周期表中的Na元素,j为O元素,二者形成的Na2O2属于离子化合物;由表中数据可知,Y的第四电离能剧增,故Y表现+3价,最外层电子数为3,应为ⅢA族元素;稀有气体最外层满足8电子稳定结构,失去核外电子需要的能量最多。
【详解】(1)从所给元素在周期表中的位置可知a、c、d、f分别为、、和,e为,它们都是电的良导体;h为碳元素,其单质石墨也是电的良导体,故应选①④。
(2)①由表中数据可知,X失去第2个电子所需能量远大于其失去第1个电子所需的能量,故第1个电子为最外层的1个电子,而其他几个电子应处于内层。结合所给的周期表片段知,X应为a,即钠元素,钠元素和j(氧元素)形成的化合物的化学式为和。故答案为:a;和;
②由表中所给数据可知,Y失去第1、2、3个电子所需能量差别不大,而失去第4个电子所需能量远大于失去第3个电子所需的能量,因此Y元素原子的最外层有3个电子,即Y为第ⅢA族的元素。故答案为:ⅢA;
③从题目所给信息可知,原子失去电子所需能量不仅与原子核对核外电子的吸引作用有关,还与原子核外电子形成稳定结构的倾向有关。结构越稳定,失电子所需能量越高,在所给13种元素中,m元素原子核外最外层已达到稳定结构,因此失去第1个电子需要的能量最多。故答案为:m。
21. 减小 419 738 0.93 1.57 共价化合物 ds A 锰 SiO2+2OH-=SiO+H2O O>P>Si>Li [Ar]3d54s2 第四周期ⅦB族
【分析】Ⅱ、A元素的原子最外层电子排布式为ns1,则A是第IA族元素;B元素的原子价电子排布式为ns2np2,所以B应该是第ⅣA族元素;C元素位于第二周期且原子中p能级与s能级电子总数相等,所以C是氧元素;D元素原子的M能层的p能级中有3个未成对电子,则D是P元素;E元素原子有五个未成对电子,则E的原子序数是25,属于第四周期的Mn元素。
【详解】Ⅰ、(1)从图甲分析可知,同一主族元素原子的第一电离能I1变化规律是从上到下依次减小,故答案为:减小;
(2)同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族和第VA族元素第一电离能大于其相邻元素;同一主族元素原子的第一电离能变化规律是从上到下依次减小。则E钾
(4)AlCl3中Al与Cl的电负性差值为1.55,根据信息,电负性差值若小于1.7,则形成共价键,所以AlCl3为共价化合物,故答案为:共价化合物;
(5)①Cu是29号元素,价电子排布式为,在元素周期表中铜位于ds区,故答案为:;ds;
②能级能量高低顺序规律为:相同n而不同能级的能量高低顺序为:ns<np<nd<nf,n不同时的能量高低:2s<3s<4s,2p<3p<4p;不同层不同能级ns<(n-2)f<(n-1)d<np,绝大多数基态原子核外电子的排布都遵循下列顺序:1s、2s、2p、3s、3p、4s、3d、4p、5s、4d、5p、6s、4f…,则A错误,B、C、D正确,故答案为:A;
Ⅱ、(1)由分析可知,E为锰元素,故答案为:锰;
(2)由分析可知,C为O元素,O元素的核电荷数是8,则根据构造原理、能量最低原理、洪特规则以及泡利原理可知,其轨道表达式为,故答案为:;
(3)当n=3时,B是硅元素,B与C形成的化合物二氧化硅与氢氧化钠溶液反应的离子方程式是SiO2+2OH-=SiO+H2O,故答案为:SiO2+2OH-=SiO+H2O;
(4)若A元素的原子最外层电子排布为2s1,则A是Li。B元素的原子价电子排布为3s23p2,则B是Si元素。由于非金属性越强,第一电离能越大,所以氧元素的第一电离能最大。Li是金属第一电离能最小。P的非金属性强于Si,第一电离能大于硅的,所以A、B、C、D四种元素的第一电离能由大到小的顺序是O>P>Si>Li,故答案为:O>P>Si>Li;
(5)E元素是Mn,原子序数是25,位于周期表的第四周期第ⅦB族,所以原子的电子排布简写式是[Ar]3d54s2,故答案为:[Ar]3d54s2;第四周期ⅦB族。
高中化学人教版 (2019)必修 第一册第二节 元素周期律单元测试同步测试题: 这是一份高中化学人教版 (2019)必修 第一册<a href="/hx/tb_c161998_t7/?tag_id=28" target="_blank">第二节 元素周期律单元测试同步测试题</a>,共18页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
人教版 (2019)必修 第一册第二节 金属材料单元测试测试题: 这是一份人教版 (2019)必修 第一册<a href="/hx/tb_c161991_t7/?tag_id=28" target="_blank">第二节 金属材料单元测试测试题</a>,共17页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
人教版 (2019)选择性必修2第一节 原子结构精品练习题: 这是一份人教版 (2019)选择性必修2<a href="/hx/tb_c4002442_t7/?tag_id=28" target="_blank">第一节 原子结构精品练习题</a>,共18页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。














