





高中第一节 硫及其化合物授课课件ppt
展开
这是一份高中第一节 硫及其化合物授课课件ppt,共28页。PPT课件主要包含了CO2,SO2,H2S,SO3,新旧草帽,新旧报纸书本,氧化性漂白,化合漂白,活性炭,吸附漂白等内容,欢迎下载使用。
硫化物:黄铜矿(CuFeS2)、黄铁矿(FeS2)等硫酸盐:石膏(CaSO4·2H2O)、芒硝(Na2SO4·10H2O)某些蛋白质、化石燃料(石油、煤)等
火山喷口附近或地壳的岩层中
三、硫元素的“位——构——性”
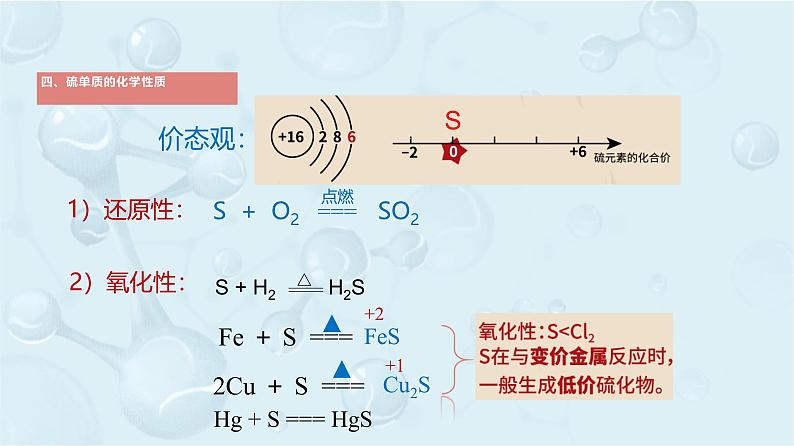
-2、0、+4、+6
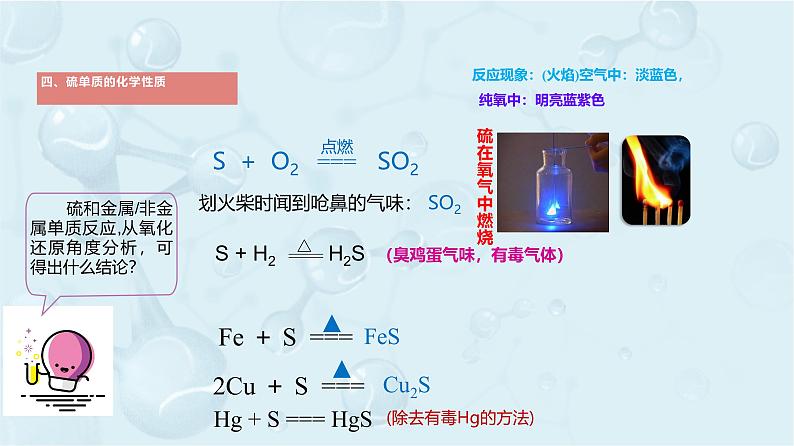
划火柴时闻到呛鼻的气味: SO2
Fe + S ===
2Cu + S ===
Hg + S === HgS
(除去有毒Hg的方法)
反应现象:(火焰)空气中:淡蓝色, 纯氧中:明亮蓝紫色
(臭鸡蛋气味,有毒气体)
如何洗涤附着在试管内壁上的硫?
可用CS2或热NaOH溶液洗涤试管内壁的硫。
S+ NaOH—— Na2S+ Na2SO3+ H2O
____色、___________气味、密度比空气大的有毒气体。此外, SO2容易液化。
一、二氧化硫(SO2)的物理性质
如图5-2所示,把充满SO2、塞有橡胶塞的试管倒立在水中,在水面下打开橡胶塞,观察试管内页面的上升。待液面高度不再明显变化时,在水下用橡胶塞塞紧试管口,取出试管,用pH试纸测定溶液的酸碱度(保留该溶液供实验5-2使用)。
试管内水位上升,pH试纸变红
SO2易溶于水,水溶液呈酸性
SO2 + H2O H2SO3
(弱酸,不稳定,易分解)
酸性:H2SO3>CH3COOH>碳酸
二、二氧化硫(SO2)的化学性质
化学上通常把向生成物方向进行的叫做正反应,向反应物方向进行的叫做逆反应。 在同一条件下,既能向正反应方向进行,同时又能向逆反应的方向进行的反应,叫做可逆反应 。
c.与碱反应:SO2少量:Ca(OH)2+SO2=CaSO3 ↓ +H2O SO2+2NaOH===Na2SO3+H2O SO2过量:NaOH+SO2=NaHSO3
a.与H2O反应:SO2+H2O⇌H2SO3
b.与碱性氧化物反应与CaO反应:CaO+SO2===CaSO3(煤固硫)。
SO2的这一性质和哪一种气体相似?
处于中间价态,_____________________________
标出SO2中S元素的化合价,推断它应具有怎样的化学性质?
既具有氧化性,又具还原性
如:O2、Cl2、Br2、KMnO4、HNO3 等
2H2S + SO2 = 3S + 2H2O
SO2+Cl2+2H2O= H2SO4+2HCl
(KMnO4 溶液褪色)
5SO2+2KMnO4+2H2O =K2SO4 +2MnSO4+2H2SO4
SO3+H2O=H2SO4
用试管取2mL在实验5-1中得到的溶液,向其中滴入1~2滴品红溶液,振荡,观察溶液的颜色变化。然后加热试管,注意通风,再观察溶液的变化。(如图5-3)
生成的无色物质不稳定 (易分解)
有些色素 无色物质
见光、加热或长时间放置
草帽、纸张为什么会泛黄?
除了SO2,还有哪些物质具有漂白性?它们的漂白原理相同吗?
HClO 、Na2O2 H2O2
1)原理: Na2SO3+H2SO4(浓) = Na2SO4 + H2O +SO2↑
2)原料: 亚硫酸钠粉末和浓硫酸
4)除杂装置:浓硫酸
5)收集装置:向上排空气法
6)尾气处理装置:用氢氧化钠溶液吸收SO2
SO3 + Ca(OH)2
= CaSO4+H2O
无色固体,熔点(16.8℃)、沸点(44.8℃ )
2) 与碱性氧化物反应:
归纳总结——SO2 的性质
+ Fe3+、X2、 KMnO4、O2、H2O2
SO2通入BaCl2溶液,能否产生白色沉淀?为什么?
利用SO2的漂白性/还原性,可通入品红/酸性高锰酸钾/溴水等溶液。
不能,因为弱酸不能制强酸。
若想产生白色沉淀,可以如何操作?
加入碱性物质如NH3/NH4·H2O,可产生BaSO3沉淀;或强氧化性物质如Cl2/酸性KMnO4等,可产生BaSO4沉淀。
相关课件
这是一份人教版 (2019)必修 第二册第五章 化工生产中的重要非金属元素第一节 硫及其化合物课前预习ppt课件,文件包含新教材精创511硫和二氧化硫课件2pptx、二氧化硫溶于水-视频实验演示mp4、二氧化硫漂白-视频实验演示mp4等3份课件配套教学资源,其中PPT共23页, 欢迎下载使用。
这是一份高中化学人教版 (2019)必修 第二册第一节 硫及其化合物教学ppt课件,共1页。
这是一份人教版 (2019)必修 第二册第一节 硫及其化合物集体备课ppt课件,共35页。PPT课件主要包含了游离态,化合态,硫单质的物理性质,黄色晶体易研成粉末,硫单质的化学性质,价态观,与金属反应,与非金属反应,氧化性Cl2>S,硫单质的用途等内容,欢迎下载使用。










